اطلاعات عمومی
بیان پروتئین چیست؟
مروری بر بیان پروتئین
بیان پروتئین به روشی اطلاق میشود که در آن پروتئینها در موجودات زنده سنتز، اصلاح و تنظیم میشوند. در تحقیقات روی پروتئین، این اصطلاح میتواند به موضوع مورد مطالعه یا تکنیکهای آزمایشگاهی مورد نیاز برای تولید پروتئینها اطلاق شود. این مقاله بر معنای اخیر بیان پروتئین تمرکز دارد. با این حال، از نظر عملی، تولید پروتئین نوترکیب به استفاده از ماشین سلولی بستگی دارد.
مقدمهای بر بیان پروتئین
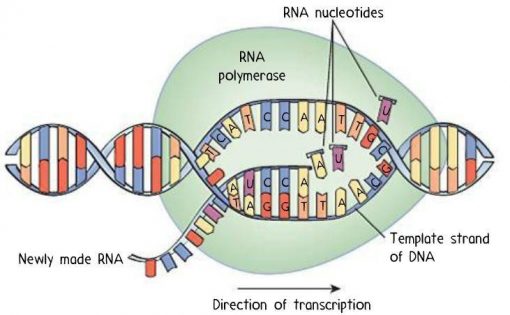
پروتئینها بسته به نیاز عملکردی سلول سنتز و تنظیم میشوند. طرحهای اولیه پروتئینها در DNA ذخیره میشوند و توسط فرآیندهای رونویسی تنظیمشده در تولید RNA پیامرسان (mRNA) رمزگشایی میشوند. سپس پیام کد شده موجود در mRNA به پروتئین ترجمه میشود. رونویسی انتقال اطلاعات از DNA به mRNA است و ترجمه سنتز پروتئین بر اساس توالی مشخص شده توسط mRNA میباشد.
نمودار ساده رونویسی و ترجمه. این جریان کلی اطلاعات از توالی جفت باز DNA (ژن) به توالی پلی پپتیدی اسید آمینه (پروتئین) را توصیف میکند.
در پروکاریوتها، فرآیند رونویسی و ترجمه به طور همزمان اتفاق میافتد. ترجمه mRNA حتی قبل از سنتز کامل رونوشت mRNA بالغ شروع میشود. این رونویسی و ترجمه همزمان یک ژن، رونویسی و ترجمه جفت شده نامیده میشود. در یوکاریوتها، فرآیندها از نظر فضایی از هم جدا میشوند و با رونویسی در هسته و ترجمه یا سنتز پروتئین در سیتوپلاسم اتفاق میافتد.
مقایسه رونویسی و ترجمه در پروکاریوتها در برابر یوکاریوتها

رونویسی و ترجمه
رونویسی در سه مرحله در پروکاریوتها و یوکاریوتها انجام میشود: آغاز، افزایش طول و پایان. رونویسی زمانی آغاز میشود که DNA دو رشتهای باز شود تا امکان اتصال RNA پلیمراز فراهم شود. پس از شروع رونویسی، RNA پلیمراز از DNA جدا میشود. رونویسی در سطوح مختلف توسط فعال کنندهها و سرکوب کنندهها و همچنین توسط ساختار کروماتین در یوکاریوتها تنظیم میشود. در پروکاریوتها، هیچ تغییر خاصی در mRNA لازم نیست و ترجمه پیام حتی قبل از تکمیل رونویسی شروع میشود. با این حال، در یوکاریوتها، mRNA برای حذف اینترونها، افزودن یک کلاهک در انتهای ‘5 و آدنینهای متعدد در انتهای ‘3 mRNA برای تولید دم polyA پردازش میشود. سپس mRNA اصلاح شده به سیتوپلاسم منتقل و در آنجا ترجمه میشود.
ترجمه یا سنتز پروتئین یک فرآیند چند مرحلهای است که به ماکرومولکول هایی مانند ریبوزومها،RNA های انتقالی (tRNA)، mRNA و فاکتورهای پروتئینی و همچنین مولکولهای کوچک مانند اسیدهای آمینه، ATP، GTP و سایر عوامل کوفاکتور نیاز دارد. برای هر مرحله از ترجمه، فاکتورهای پروتئینی خاصی وجود دارد. روند کلی در هر دو پروکاریوت و یوکاریوت مشابه است، اگرچه تفاوت های خاصی وجود دارد.
در طول شروع مرحله آغاز زیر واحد کوچک ریبوزوم متصل به t-RNA آغازگر، mRNA را که از انتهای ‘5 شروع میشود، اسکن میکند تا کدون شروع (AUG) را شناسایی و متصل شود. زیرواحد بزرگ ریبوزوم به زیر واحد ریبوزومی کوچک میپیوندد تا کمپلکس آغاز را در کدون شروع ایجاد کند. فاکتورهای پروتئینی و همچنین توالیهای موجود در mRNA در تشخیص کدون آغاز و تشکیل کمپلکس آغازین نقش دارند. در طول طویل شدن، tRNAها به آمینو اسیدهای تعیین شده خود متصل میشوند و آنها را به ریبوزوم میفرستند و در آنجا پلیمریزه میشوند تا یک پپتید تشکیل دهند. توالی اسیدهای آمینه اضافه شده به پپتید در حال رشد به دنباله mRNA رونوشت بستگی دارد. در نهایت، زمانی که ریبوزوم به کدون پایانی میرسد، پلی پپتید نوپا در مرحله پایانی آزاد میشود. در این مرحله، ریبوزوم از mRNA آزاد میشود و آماده آغاز دور دیگری از ترجمه است.

ماشین سنتز پروتئین
خلاصهای از اجزای اولیه و ویژگیهای دستگاه ترجمه پروکاریوتی و یوکاریوتی.
| یوکاریوتها | پروکاریوتها | اجزا |
| زیرواحدهای 40S و 60S | زیرواحدهای 30S و 50S | ریبوزومها |
| پس از رونویسی، رونوشت mRNA برای حذف نواحی غیر کدکننده (اینترونها) وصل میشود و یک ساختار کلاهکی (M7methyl guanosine) و یک توالی پلی آدنوزین به ترتیب در انتهای 5′ و 3′ پیام اضافه میشود.
ساختار Cap و پلی A برای ارسال mRNA به سیتوپلاسم، شروع مناسب ترجمه و پایداری mRNA در میان سایر عملکردها مهم هستند. mRNA معمولا مونوسیسترونیک است. |
پس از رونویسی هیچ پردازش دیگری از رونوشت mRNA صورت نمیگیرد.
mRNA پلی سیسترونیک و دارای چندین محل آغاز است. |
الگو یا mRNA |
| شروع ترجمه به دو صورت انجام میشود:
ترجمه وابسته به کلاهک: ساختار کلاهک و پروتئینهای اتصال کلاهک مسئول اتصال مناسب ریبوزوم به mRNA و تشخیص کدون شروع صحیح هستند. اولین کدون AUG در انتهای 5′ mRNA به عنوان کدون شروع عمل میکند. گاهی اوقات توالی کوزاک ممکن است در اطراف کدون آغازین وجود داشته باشد. ترجمه مستقل از کلاهک: اتصال ریبوزوم به mRNA از طریق “محل ورود ریبوزوم داخلی” (IRES) روی mRNA صورت می گیرد. |
توالی Shine-Dalgarno در رونوشت mRNA وجود دارد و یک توالی مکمل در زیر واحد ریبوزومی وجود دارد. این امر اتصال و همسویی ریبوزوم را در mRNA در محل آغاز ترجمه (AUG) تسهیل میکند.
اولین اسید آمینه پلی پپتید نوپا متیونین فرمیله است. |
ویژگیهای ترجمه |
| مرحله شروع، مرحله محدود کننده سرعت در ترجمه یوکاریوتی است. | سه فاکتور شروع شناخته شده است، IF1، IF2 و IF3 بیش از سه فاکتور شروع که توسط فسفوریلاسیون تنظیم میشوند. | فاکتورهای مرحله آغاز |
| EF1(α, β, γ) and EF2 | EF-Tu & EF-Ts, EF-G | فاکتورهای مرحله افزایش طول |
| eRF-1 | RF1 and RF-2 | فاکتورهای مرحله پایان |
اصلاح پس از ترجمه
پس از ترجمه، پلی پپتیدها به روشهای مختلف اصلاح میشوند تا ساختار خود را تکمیل کنند، مکان خود را تعیین کنند یا فعالیت خود را در سلول تنظیم کنند. اصلاحات پس از ترجمه (PTMs) اضافات یا تغییرات مختلفی در ساختار شیمیایی هستند و ویژگیهای حیاتی زیست شناسی سلولی کلی هستند.
انواع اصلاحات پس از ترجمه عبارتند از:
- تا شدن پلی پپتید به یک پروتئین کروی با کمک پروتئینهای چاپرون برای رسیدن به کمترین حالت انرژی
- تغییرات اسیدهای آمینه موجود، مانند حذف اولین باقی مانده متیونین
- تشکیل یا کاهش پل دی سولفیدی
- اصلاحات پروتئینی که عملکردهای اتصال را تسهیل میکند:
- گلیکوزیلاسیون
- پرنیلاسیون پروتئینها برای محلی سازی غشا
- استیلاسیون هیستونها برای اصلاح برهمکنشهای DNA هیستون
- افزودن گروههای عاملی که فعالیت پروتئین را تنظیم میکنند:
- فسفوریلاسیون
- نیتروزیلاسیون
- اتصال GTP
روشهای بیان پروتئین نوترکیب
به طور کلی، تحقیقات پروتئومیکس شامل بررسی هر جنبهای از پروتئین مانند ساختار، عملکرد، تغییرات، محلی سازی یا برهمکنشهای پروتئینی است. برای بررسی چگونگی تنظیم پروتئینهای خاص زیست شناسی، محققان معمولاً به وسیلهای برای تولید پروتئینهای کاربردی مورد علاقه نیاز دارند.
با توجه به اندازه و پیچیدگی پروتئینها، سنتز شیمیایی گزینه مناسبی نیست. در عوض، سلولهای زنده و ماشینهای سلولی معمولاً بهعنوان کارخانهها برای ساخت پروتئینها بر اساس الگوهای ژنتیکی عرضه شده مهار میشوند.
بر خلاف پروتئینها، DNA به صورت مصنوعی یا در شرایط آزمایشگاهی با استفاده از تکنیکهای DNA نوترکیب به خوبی ساخته میشود. بنابراین، الگوهای DNA ژنهای خاص، با یا بدون توالیهای گزارشگر، میتوانند به عنوان الگوهایی برای بیان پروتئین ساخته شوند. پروتئینهای تولید شده از چنین قالبهای DNA پروتئینهای نوترکیب نامیده میشوند.
استراتژیهای قدیمی برای بیان پروتئین نوترکیب شامل جابجایی سلولها با یک ناقل DNA که حاوی الگو است و سپس کشت سلولها به طوری که آنها پروتئین مورد نظر را رونویسی و ترجمه کنند. به طور معمول، سلولها سپس لیز میشوند تا پروتئین بیان شده برای خالص سازی بعدی استخراج شود. هر دو سیستم بیان پروتئین پروکاریوتی و یوکاریوتی در داخل بدن به طور گسترده مورد استفاده قرار میگیرند. انتخاب سیستم به نوع پروتئین، فعالیت عملکردی و بازده مورد نظر بستگی دارد. این سیستمهای بیانی در جدول زیر خلاصه شدهاند و شامل پستانداران، حشرات، مخمرها، باکتریها، جلبکها و بدون سلول هستند. هر سیستم دارای مزایا و معایبی است و انتخاب سیستم مناسب برای کاربرد خاص برای بیان موفقیت آمیز پروتئین نوترکیب مهم است.

بیان پروتئین پستانداران
از سیستمهای بیان پستانداران میتوان برای تولید پروتئینهای پستاندارانی استفاده کرد که به دلیل محیط فیزیولوژیکی مرتبط، دارای بیشترین ساختار و فعالیت هستند. این موضوع منجر به سطوح بالایی از پردازش پس از ترجمه و فعالیت عملکردی میشود. سیستمهای بیان پستانداران میتوانند برای تولید آنتیبادیها، پروتئینهای پیچیده و پروتئینها برای استفاده در سنجشهای مبتنی بر سلول عملکردی استفاده شوند. با این حال، این مزایا با شرایط محیطی سختتر همراه است.
سیستمهای بیان پستانداران را میتوان برای تولید پروتئینها به صورت موقت، که در آن ساختار بیانی در ژنوم میزبان ادغام میشود، استفاده کرد. در حالی که خطوط سلولی را می توان در چندین آزمایش استفاده کرد، میتواند مقادیر زیادی پروتئین را در یک تا دو هفته تولید کند. این سیستمهای بیان پستانداران از کشتهای سوسپانسیون استفاده میکنند و میتوانند با بازده گرم در لیتر تولید کنند. علاوه بر این، این پروتئینها در مقایسه با سایر سیستمهای بیانی، تغییرات فولدینگ و پس از ترجمه مانند گلیکوزیلاسیون بیشتری دارند. در مثال زیر، از 3 سیستم بیان مختلف پستانداران برای بیان پروتئین های نوترکیب استفاده شده است.
بازده پروتئین نوترکیب سیستمهای بیان Gibco FreeStyle CHO، Expi293 و ExpiCHO برای بیان موقت IgG انسان، IgG خرگوش و EPO (اریتروپویتین) با استفاده از وکتور بیانی pcDNA 3.4 استفاده شد. پروتکل Max Titer برای ExpiCHO استفاده شد و پروتئینها در روز 10-12 استخراج شدند. برای FreeStyleCHO و Expi293، پروتئینها در روز 6 یا 7 برداشت شدند. همه پروتئینها با ForteBio Octet یا ELISA اندازه گیری شدند. استفاده از ExpiCHO باعث افزایش تیتر پروتئین در مقایسه با FreeStyle CHO و Expi293 میشود.
بیان پروتئین حشرات
سلولهای حشره را میتوان برای بیان پروتئین سطح بالا با تغییراتی مشابه سیستم پستانداران استفاده کرد. چندین سیستم وجود دارد که میتواند برای تولید باکولوویروس نوترکیب استفاده شود، که میتواند برای بیان پروتئین مورد نظر در سلولهای حشرات مورد استفاده قرار گیرد. این سیستمها را میتوان به راحتی تقویت کرد و با کشت سوسپانسیون با چگالی بالا برای بیان پروتئین در مقیاس بزرگ که از نظر عملکردی شبیه پروتئین بومی پستانداران میباشد، سازگار کرد. اگرچه بازده میتواند تا 500 میلی گرم در لیتر باشد، تولید باکولوویروس نوترکیب میتواند زمان بر باشد و شرایط کشت چالش برانگیزتر از سیستمهای پروکاریوتی باشد.
خلاصه پروتکل سیستم بیان Baculovirus
سیستم بیان Baculovirus Invitrogen BaculoDirect از فناوری Invitrogen Gateway برای شبیه سازی استفاده میکند. پس از واکنش 1 ساعته رکامبیناز و ترانسفکشن در سلولهای حشره، باکولوویروس حاوی ژن مورد نظر تولید میشود. سپس یک آزمایش بیان سریع میتواند قبل از تقویت ذخایر ویروسی و افزایش مقیاس انجام شود. استفاده از این سیستم امکان بیان باکولوویروس را در سلولهای حشرات فراهم میکند.
بیان پروتئین باکتری
سیستمهای بیان پروتئین باکتریایی محبوب هستند زیرا باکتریها به راحتی کشت میشوند، سریع رشد کرده و بازده بالایی از پروتئین نوترکیب تولید میکنند. با این حال، پروتئینهای یوکاریوتی چند دامنهای که در باکتریها بیان میشوند اغلب غیرعملکردی هستند، زیرا سلولها برای انجام تغییرات پس از ترجمه یا فولدینگ مولکولی مجهز نیستند.
بیان پروتئین بدون سلول
بیان پروتئین بدون سلول، سنتز آزمایشگاهی یک پروتئین با استفاده از عصارههای سازگار با ترجمه سلول های کامل است. در واقع، عصاره سلول کامل حاوی تمام درشت مولکولها و اجزای مورد نیاز برای رونویسی، ترجمه و حتی اصلاح پس از ترجمه است. این اجزا شامل RNA پلیمراز، فاکتورهای پروتئینی تنظیم کننده، فاکتورهای رونویسی، ریبوزومها و tRNA هستند. وقتی این عصارهها با کوفاکتورها، نوکلئوتیدها و الگوی ژنی خاص تکمیل شوند، میتوانند پروتئینهای مورد علاقه را در چند ساعت سنتز کنند.
اگرچه برای تولید در مقیاس بزرگ پایدار نیست، اما سیستمهای بیان پروتئین بدون سلول یا ترجمه آزمایشگاهی (IVT) دارای مزایای متعددی نسبت به سیستمهای in vivo متعارف هستند. بیان بدون سلول امکان سنتز سریع پروتئینهای نوترکیب را بدون دردسر کشت سلولی فراهم میکند. سیستمهای بدون سلول، تگ گذاری پروتئین با اسیدهای آمینه اصلاح شده و همچنین بیان پروتئینهایی را که تحت تخریب سریع پروتئولیتیکی توسط پروتئازهای درون سلولی قرار میگیرند، ممکن میسازد. همچنین، با روش بدون سلول، بیان بسیاری از پروتئینهای مختلف به طور همزمان سادهتر است (به عنوان مثال، آزمایش جهشهای پروتئین با بیان در مقیاس کوچک از الگوهای مختلف DNA نوترکیب). در این آزمایش، یک سیستم IVT برای بیان پروتئین کاسپاز 3 انسانی استفاده شد.
بیان کاسپاز-3 در یک سیستم IVT انسانی. کاسپاز-3 با استفاده از کیت IVT انسانی با بازده بالا Thermo Scientific 1-Step (Human IVT) در E. coli (نوترکیب) بیان شد. فعالیت فعال کاسپاز 3 با استفاده از مقادیر مساوی پروتئین مورد سنجش قرار گرفت. پروتئین کاسپاز 3 بیان شده با استفاده از سیستم IVT در مقایسه با پروتئین بیان شده در باکتری فعالتر بود.
سنتز پروتئین شیمیایی
سنتز شیمیایی پروتئینها را میتوان برای پروتئینهای تگ گذاری شده با اسیدهای آمینه غیرطبیعی، پروتئینهای تگ گذاری شده در مکانهای خاص یا پروتئینهایی که برای سیستمهای بیان بیولوژیکی سمی هستند، استفاده کرد. سنتز شیمیایی پروتئین برای تولید پروتئینها و پپتیدهای کوچک به خوبی کار میکند. بازده اغلب سنتز شیمیایی بسیار کم و این روش برای تولید پلی پپتیدهای بلندتر بسیار گران است.
مترجم: امید آهنگریان ابهری

در پروکاریوتها، فرآیند رونویسی و ترجمه به طور همزمان اتفاق میافتد. ترجمه mRNA حتی قبل از سنتز کامل رونویسی mRNA بالغ آغاز میشود. این رونویسی و ترجمه همزمان یک ژن، رونویسی و ترجمه همراه نامیده میشود. در یوکاریوتها، فرایندها از نظر فضایی از هم جدا شده و به صورت متوالی با رونویسی در هسته و ترجمه یا سنتز پروتئین در سیتوپلاسم اتفاق میافتد.
روشهای بیان پروتئین نوترکیب
به طور کلی، تحقیقات پروتئومیک شامل بررسی هر جنبهای از پروتئین مانند ساختار، عملکرد، تغییرات، محلی سازی یا برهمکنش پروتئین است. برای بررسی چگونگی تنظیم پروتئینهای خاص زیست شناسی، محققان معمولاً به وسیلهای برای تولید (ساخت) پروتئینهای کاربردی مورد علاقه نیاز دارند.
با توجه به اندازه و پیچیدگی پروتئینها، سنتز شیمیایی گزینه مناسبی برای این تلاش نیست. درعوض، سلولهای زنده و ماشینهای سلولی آنها معمولاً به عنوان کارخانه برای ساخت و ساخت پروتئین بر اساس الگوهای ژنتیکی ارائه شده مورد استفاده قرار میگیرند.
برخلاف پروتئینها، ساخت DNA به صورت مصنوعی یا آزمایشگاهی با استفاده از تکنیک های DNA نوترکیب به خوبی تثبیت شده ساده است. بنابراین، الگوهای DNA ژنهای خاص، با یا بدون گزارشگر اضافی یا دنبالههای برچسب ، میتوانند به عنوان الگوهایی برای بیان پروتئین ساخته شوند. پروتئینهای تولید شده از چنین الگوهای DNA را پروتئینهای نوترکیب مینامند.
استراتژیهای سنتی برای بیان پروتئین نوترکیب شامل انتقال سلولها با بردار DNA حاوی الگو و سپس کشت سلولها است تا پروتئین مورد نظر را رونویسی و ترجمه کنند. به طور معمول، سلولها سپس لیز میشوند تا پروتئین بیان شده برای خالص سازی بعدی استخراج شود. هر دو پروکاریوت و یوکاریوت در سیستم های بیان پروتئین در داخل بدن به طور گستردهای استفاده میشود. انتخاب سیستم بستگی به نوع پروتئین، الزامات فعالیت عملکردی و عملکرد مطلوب دارد. این سیستمهای بیان در جدول زیر خلاصه شده و شامل پستانداران، حشرات، مخمر، باکتری، جلبک و بدون سلول است. هر سیستم دارای مزایا و چالشهایی است و انتخاب سیستم مناسب برای کاربرد خاص برای بیان موفقیت آمیز پروتئین نوترکیب مهم است.
مترجم: امید آهنگریان ابهری
مطالعه صدها مطلب علمی در حوزه بیولوژی
آرشیو جدیدترین خبرهای روز دنیای بیولوژی