اطلاعات عمومی
باکتریوفاژ
مقدمهای بر باکتریوفاژ
باکتریوفاژها (فاژها) انگلهای درونسلولی ضروری هستند که با استفاده از بعضی و یا همه سیستم بیوسنتز میزبان، درون باکتریها تکثیر میکنند (درواقع ویروسهای آلودهکننده باکتریها هستند).
شباهتهای زیادی بین باکتریوفاژها و ویروسهای سلولهای حیوانی وجود دارد؛ بنابراین، باکتریوفاژ را میتوان بهعنوان یک مدل برای ویروسهای سلولهای حیوانی در نظر گرفت. علاوه بر این، آگاهی از چرخه زندگی باکتریوفاژ برای درک یکی از مکانیسمهای انتقال ژنهای باکتریها (از یک باکتری به باکتری دیگر) ضروری است.
مدتها تصور بر این بود که استفاده از باکتریوفاژ میتواند راه مؤثری برای درمان عفونتهای باکتریایی باشد، اما خیلی زود مشخص شد که باکتریوفاژ سریعاً در داخل بدن از بین میرود و بنابراین ارزش بالینی کمی دارد.
بااینحال، باکتریوفاژها در آزمایشگاههای تشخیصی جهت شناسایی باکتریهای بیماریزا به کار میروند (فاژ تایپینگ). با اینکه فاژ تایپینگ در آزمایشگاههای بالینی روتین کاربردی ندارد ولی در آزمایشگاههای مرجع برای اهداف اپیدمیولوژیک اهمیت دارد. اخیراً توجه زیادی به امکان استفاده از باکتریوفاژ برای درمان و پیشگیری عفونتهای باکتریایی شده است.
ترکیب و ساختار باکتریوفاژ
ترکیب
اگرچه ممکن است باکتریوفاژهای مختلف، حاوی مواد متفاوتی باشند ولی همه آنها حاوی نوکلئیک اسید و پروتئین هستند. بسته به نوع فاژ، اسید نوکلئیک میتواند DNA و یا RNA باشد ولی نمیتواند هر دوی آنها باشد. اسید نوکلئیک فاژها اغلب حاوی بازهای غیرمعمول یا تغییریافته است. این بازهای تغییریافته از اسید نوکلئیک فاژ در برابر نوکلئازهایی حفاظت میکنند که اسید نوکلئیک میزبان را در طی آلودگی به فاژ تجزیه میکند.
اندازه اسید نوکلئیک بسته به فاژ متغیر است. سادهترین فاژها فقط تا حد کافی اسید نوکلئیک دارند که به طور متوسط ۳ تا ۵ محصول ژنی با اندازه متوسط را کد کنند درحالیکه فاژهای پیچیدهتر ممکن است تا بیش از ۱۰۰ محصول ژنی را کد کنند.
تعداد انواع مختلف پروتئینها و میزان هرکدام از آنها در ذره فاژ به فاژ بستگی دارد. سادهترین فاژها دارای نسخههای زیادی از تنها یک یا دو پروتئین مختلف هستند درحالیکه فاژهای پیچیدهتر ممکن است انواع مختلفی داشته باشند. پروتئینها در عفونت و حفاظت از اسید نوکلئیک در برابر نوکلئازهای موجود در محیط نقش دارند.
ساختار
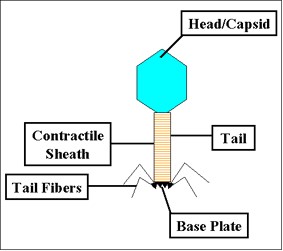
باکتریوفاژ دارای اندازهها و شکلهای مختلفی است. اجزاء ساختمانی اصلی باکتریوفاژ در شکل ۱ نشاندادهشده که فاژی به نام T4 را نشان میدهد.
اندازه
T4 جزو بزرگترین فاژهاست. این فاژ حدوداً ۲۰۰ نانومتر طول و ۱۰۰-۸۰ نانومتر عرض دارد. فاژهای دیگر کوچکتر هستند. اکثر فاژها اندازهای بین ۲۴ تا ۲۰۰ نانومتر دارند.
سر یا کپسید
همه فاژها حاوی ساختار سر هستند که شکل و اندازه متفاوتی دارد. بعضی ایکوزاهدرال (icosahedral) و بعضی دیگر رشتهای هستند. سر یا کپسید از تعداد زیادی کپی از یک یا چند نوع پروتئین مختلف تشکیل شده است. درون کپسید، نوکلئیک اسید وجود دارد. کپسید بهعنوان پوشش محافظ نوکلئیک اسید عمل میکند.
دم
بسیاری از فاژها (نه همه آنها) دارای دم متصل به کپسید هستند. دم یک لوله توخالی است که اسید نوکلئیک در هنگام عفونت از آن عبور میکند. اندازه دم میتواند متغیر باشد و بعضی فاژها حتی دم ندارند. در فاژهای پیچیدهتر مثل T4، دم توسط صفحه انقباضی احاطه شده که در طی آلودگی باکتری منقبض میشود.
در انتهای دم فاژهای پیچیدهتر، یک صفحه پایه و یک یا چند رشته دمی متصل به آن وجود دارد. صفحه پایه و رشتههای متصل به آن در اتصال فاژ به سلول باکتری نقش دارد. همه فاژها دارای صفحات پایه و رشتههای دمی نیستند. در این موارد ساختارهای دیگری در اتصال ذره فاژ به باکتری نقش دارند.
آلودگی سلول میزبان
جذب
اولین مرحله در فرایند عفونت، جذب فاژ به سلول باکتری است. این مرحله بهواسطه رشتههای دم انتهایی فاژ و یا بعضی ساختارهای معادل آن در فاژهایی که فاقد این رشتهها هستند صورت میگیرد که به شکل برگشتپذیر است.
رشتههای دمی به گیرندههایی در سطح سلول باکتری متصل شده و اختصاصی بودن میزبان برای فاژ (باکتری که قادر به آلوده شدن به فاژ است) معمولاً بستگی به نوع رشتههای دمی فاژ دارد. نوع و ماهیت گیرنده فاژ نیز بسته به نوع باکتری متفاوت است. مثلاً پروتئینهای سطح خارجی باکتری،LPS، پیلی و لیپوپروتئین جزو این رسپتورها هستند. این رسپتورها در سطح باکتریها برای اهداف دیگری وجود دارند و فاژها طوری تکامل پیدا کردهاند تا از این رسپتورها برای آلوده کردن باکتریها استفاده کنند.
اتصال برگشتناپذیر
اتصال فاژ به باکتری از طریق رشتههای دمی فاژ، اتصال ضعیف و برگشتپذیر است. اتصال غیرقابلبرگشت فاژ به باکتری بهواسطه یک یا چند جزء صفحه پایه صورت میگیرد. فاژهایی که فاقد این صفحات هستند از راههای دیگری برای اتصال محکم به سلول باکتری استفاده میکنند.
انقباض غلاف
اتصال غیرقابلبرگشت فاژ به باکتری منجر به انقباض غلاف میشود (در فاژهایی که غلاف پوششی دارند) و رشته توخالی فیبر به سمت پوشش باکتری جلو برده میشود (شکل ۲). فاژهایی که فاقد پوشش انقباضی هستند از مکانیسمهای دیگری برای عبور ذره فاژ از پوشش باکتری استفاده میکنند. بعضی فاژها دارای آنزیمهایی هستند که اجزاء مختلف پوشش باکتریها را هضم میکنند.
تزریق اسید نوکلئیک
وقتی فاژ از پوشش باکتری عبور کرد، اسید نوکلئیک آن از قسمت سر از دم توخالی فاژ عبور کرده و وارد سلول باکتری میشود. معمولاً تنها جزء فاژ که واقعاً وارد سلول باکتری میشود اسید نوکلئیک است. باقیمانده فاژ در خارج از باکتری باقی میماند که البته این حالت چند استثناء دارد. درحالیکه در اکثر ویروسهای سلول حیوانی، معمولاً خود ذره ویروس وارد سلول میشود. این تفاوت احتمالاً به دلیل ناتوانی باکتریها در بلعیدن مواد مختلف به درون خود است.
چرخه تکثیر فاژ
فاژهای لیتیک یا ویروسی
تعریف
فاژهای لیتیک یا ویروسی، فاژهایی هستند که فقط میتوانند در باکتریها تکثیر شوند و آنها را بهوسیله لیز کردن در مرحله پایانی چرخه زندگیشان بکشند.
چرخه زندگی
چرخه زندگی یک فاژ لیتیک در شکل ۳ نشانداده شده است.

دوره پنهان شدن فاژ
در طی این دوره، هیچ ذره فاژی عفونی در داخل یا خارج باکتری یافت نمیشود. اسید نوکلئیک فاژ، کنترل سیستم بیوسنتزی سلول میزبان را در دست میگیرد و mRNA و پروتئینهای اختصاصی فاژ تولید میشود.
سپس بیان ماکرومولکولها با هدایت فاژ به همان شکلی که در مورد ویروسهای حیوانی رخ میدهد، صورت میگیرد. mRNA اولیه برای پروتئینهای اولیه کد میشود که جهت سنتز DNA فاژ موردنظر و غیرفعالکردن سیستم بیوسنتز DNA،RNA و پروتئینهای میزبان نیاز هستند. در بعضی موارد، پروتئینهای اولیه در واقع کروموزوم میزبان را تجزیه میکنند.
پس از سنتز DNA فاژ، mRNA و پروتئینهای دیررس تولید میشوند.
پروتئینهای دیررس، پروتئینهای ساختاری هستند که در فاژ وجود دارند از جمله پروتئینهای موردنیاز جهت لیز سلول باکتری.
فاز تجمع درونسلولی
در این مرحله، اسید نوکلئیک و پروتئینهای ساختاری فاژ که تولید شدهاند، جمع شده و ذرات عفونی فاژ درون باکتری تجمع پیدا میکنند.
فاز لیز و رهاسازی
پس از مدتی باکتری به علت انباشته شدن پروتئین لیز کننده فاژی در داخل آن شروع به لیز شدن میکند و فاژهای داخل سلول باکتری به محیط آزاد میشوند. تعداد فاژهای آزاد شده از هر باکتری آلوده شده حتی ممکن است به 1000 عدد هم برسد.
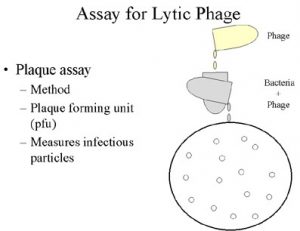
سنجش فاژ لیتیک
سنجش پلاک
فاژهای لیتیک بهوسیله سنجش پلاک شمارش میشوند. پلاک در واقع ناحیه روشنی است که در نتیجه لیز باکتری ایجاد میشود (شکل ۴). هر پلاک از یک فاژی عفونی ناشی میشود.
فاژ لیزوژنیک یا معتدل
تعریف
فاژهای لیزوژنیک یا معتدل فاژهایی هستند که هم میتوانند از طریق چرخه لیتیک تکثیر پیدا کنند و هم اینکه وارد یک مرحله خاموش درون سلول شوند. در این مرحله، اکثر ژنهای فاژ رونویسی نمیشوند و ژنوم فاژ در حالت مهار شده قرار دارد.
DNA فاژ در این مرحله پروفاژ نام دارد زیرا این ذره یک فاژ نیست ولی پتانسیل تولید فاژ را دارد. در اغلب موارد، DNA فاژ به کروموزوم میزبان ملحق میشود و همراه با آن تکثیر میشود و به سلولهای دختری منتقل میشود. سلول حاوی پروفاژ تحتتأثیر حضور پروفاژ قرار نمیگیرند و مرحله لیزوژنی ممکن است مدت نامعلومی باقی بماند. سلول حاوی پروفاژ، لیزوژن نامیده میشود.
وقایع منتهی به لیزوژنی – فاژ نمونه: لامبدا (Lambda)
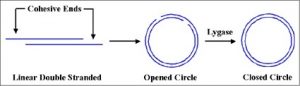
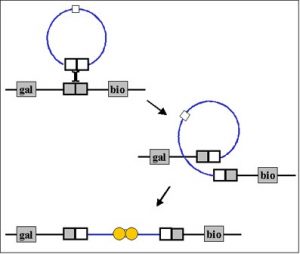
حلقوی شدن کروموزوم فاژ
فاژ لامبدا یک مولکول دو رشتهای خطی است که دارای نواحی تک رشته کوچک در انتهای 5’است. این انتهاهای تکرشتهای (انتهای چسبنده) مکمل هستند، بنابراین میتوانند جفت شوند و یک مولکول حلقوی ایجاد کنند. در سلول، انتهاهای آزاد میتوانند به هم متصل شده و یک مولکول حلقوی کووالانسی را ایجاد کنند که در شکل ۵ نشاندادهشده.
نوترکیبی در جایگاه اختصاصی
فرایند نوترکیبی بهوسیله آنزیمی که توسط فاژ کد میشود، کاتالیز میشود و نوترکیبی بین یک جایگاه خاص روی DNA حلقوی فاژ و جایگاه خاصی روی کروموزوم میزبان صورت میگیرد. در نتیجه، ژنوم فاژ به کروموزوم باکتری ملحق میشود که در شکل ۶ نشاندادهشده است.
مهار ژنوم فاژ
یک پروتئین مهارکننده (رپرسور) تولید میشود که به محل خاصی روی DNA فاژ به نام اپراتور متصل میشود و رونویسی اکثر ژنهای فاژی بهاستثنای ژن رپرسور را متوقف میکند. در نتیجه یک ژنوم فاژی سرکوب شده پایدار ایجاد میشود که به کروموزوم میزبان ملحق میشود. هر فاژ معتدل فقط DNA خودش را سرکوب میکند نه دیگر فاژها، بنابراین مهار، یک عمل بسیار اختصاصی است.
وقایعی که منجر به پایان لیزوژنی میشوند
هر زمانی که یک باکتری لیزوژن در معرض شرایط نامناسب قرار بگیرد، وضعیت لیزوژنی پایان مییابد. این فرایند القاء نامیده میشود. شرایطی که موجب پایان مرحله لیزوژنی میشوند عبارتاند از: خشکشدن، قرارگرفتن در معرض تابش UV و یا تابشهای یونیزان، مواد شیمیایی جهشزا و …
شرایط نامساعد منجر به تولید پروتئازها (پروتئین recA) میشود که پروتئین رپرسور را از بین میبرد. این عمل منجر به بیان ژنهای فاژ، معکوس شدن فرایند الحاق و تکثیر لیتیک میشود.
چرخه لیتیک در برابر لیزوژنیک
تصمیم فاژ لامبدا برای ورود به چرخه لیزوژنیک یا لیتیک در زمان ورود به سلول توسط غلظت پروتئین رپرسور و پروتئین فاژی دیگری به نام cro در سلول تعیین میشود.
پروتئین cro سنتز رپرسور را متوقف میکند، بنابراین مانع ایجاد فاز لیزوژنی میشود. شرایط محیطی که موجب ایجاد این پروتئین میشوند منجر به ایجاد چرخه لیتیک و شرایطی که موجب ایجاد پروتئین رپرسور میشوند منجر به ایجاد چرخه لیزوژنی میشود.
اهمیت لیزوژنی
مدل برای تبدیل ویروس حیوانی
تبدیل لیزوژنی
وقتی یک سلول لیزوژن میشود، گاهی ژنهای اضافی که توسط فاژ حمل میشوند در سلول بیان میشوند. این ژنها میتوانند خصوصیات سلول باکتری را تغییر دهند. این فرایند، تبدیل لیزوژنی نامیده میشود که از نظر بالینی حائز اهمیت است. مثلاً فاژهای لیزوژنی وجود دارند که حامل ژنهایی هستند که آنتیژن O سالمونلا را تغییر میدهند که یکی از آنتیژنهای اصلی باکتری برای هدایت پاسخ ایمنی است.
تولید توکسین توسط کورینه باکتریوم دیفتریا (Corynebacterium diphtheriae) بهواسطه ژنی است که یک فاژ آن را حمل میکند و تنها سویههایی که توسط لیزوژنی تغییر پیدا کردهاند بیماریزا هستند.
مطالعات بیشتر در بخش ویکیژن سایت
مترجم: مریم محجوب