اطلاعات عمومی, ویکی ژن
وزیکول های خارج سلولی و اهمیت آن ها در تحقیقات
شواهد وجود وزیکول های خارج سلولی
شواهد مبنی بر وجود وزیکول های خارج سلولی (EVs) به تقریباً ۶۰ سال پیش بازمیگردد، زمانی که وزیکول های ۲۰ تا ۵۰ نانومتری حامل عوامل انعقادی در پلاسمای عاری از پلاکت انسان شناسایی شدند. این وزیکول های غنی از لیپید بهعنوان ذرات کوچکی توصیف شدند که به آنها “گرد و غبار پلاکتی” میگفتند، زیرا طی فعالسازی پلاکتها آزاد میشدند.
نتایج میکروسکوپ الکترونی نشان داد که وزیکول های خارج سلولی فسفولیپیدها و فاکتور پلاکتی ۳ (فاکتور بافتی) را حمل میکنند تا فرآیند انعقاد را تسهیل کنند. از آن زمان تاکنون، تعریف و چشمانداز این ذرات که اکنون بهعنوان EVs شناخته میشوند، تغییر کرده است. امروزه، وزیکول های خارج سلولی بهعنوان گروهی از ساختارهای محصورشده در غشای دو لایه لیپیدی در نظر گرفته میشوند که توسط اکثر سلولها به فضای خارج سلولی ترشح میشوند تا محصولات زائد خود را دفع کنند یا با سلولهای همسایه یا دوردست و حتی با ماتریکس خارج سلولی (ECM) ارتباط برقرار کنند.
این بدان معنی است که محتوای وزیکول های خارج سلولی میتواند شامل پروتئینها، لیپیدها و اسیدهای نوکلئیک باشد که رفتار سلولهای دریافتکننده را تغییر میدهند. تاکنون چندین نوع از وزیکول های خارج سلولی در مایعات زیستی مانند ادرار، خون، مایع صفاقی و مایع مغزی نخاعی شناسایی شدهاند.
بر اساس اندازه، این وزیکولها به سه گروه تقسیم میشوند:
- اگزوزومها با محدوده اندازه ۳۰ تا ۱۵۰ نانومتر،
- اجسام آپوپتوتیک با اندازه ۵۰ تا ۵۰۰۰ نانومتر،
- و میکرووزیکولها (همچنین بهعنوان اکتوزومها، وزیکول های ترشحی یا میکروذرات شناخته میشوند) با قطر ۱۰۰ تا ۱۰۰۰
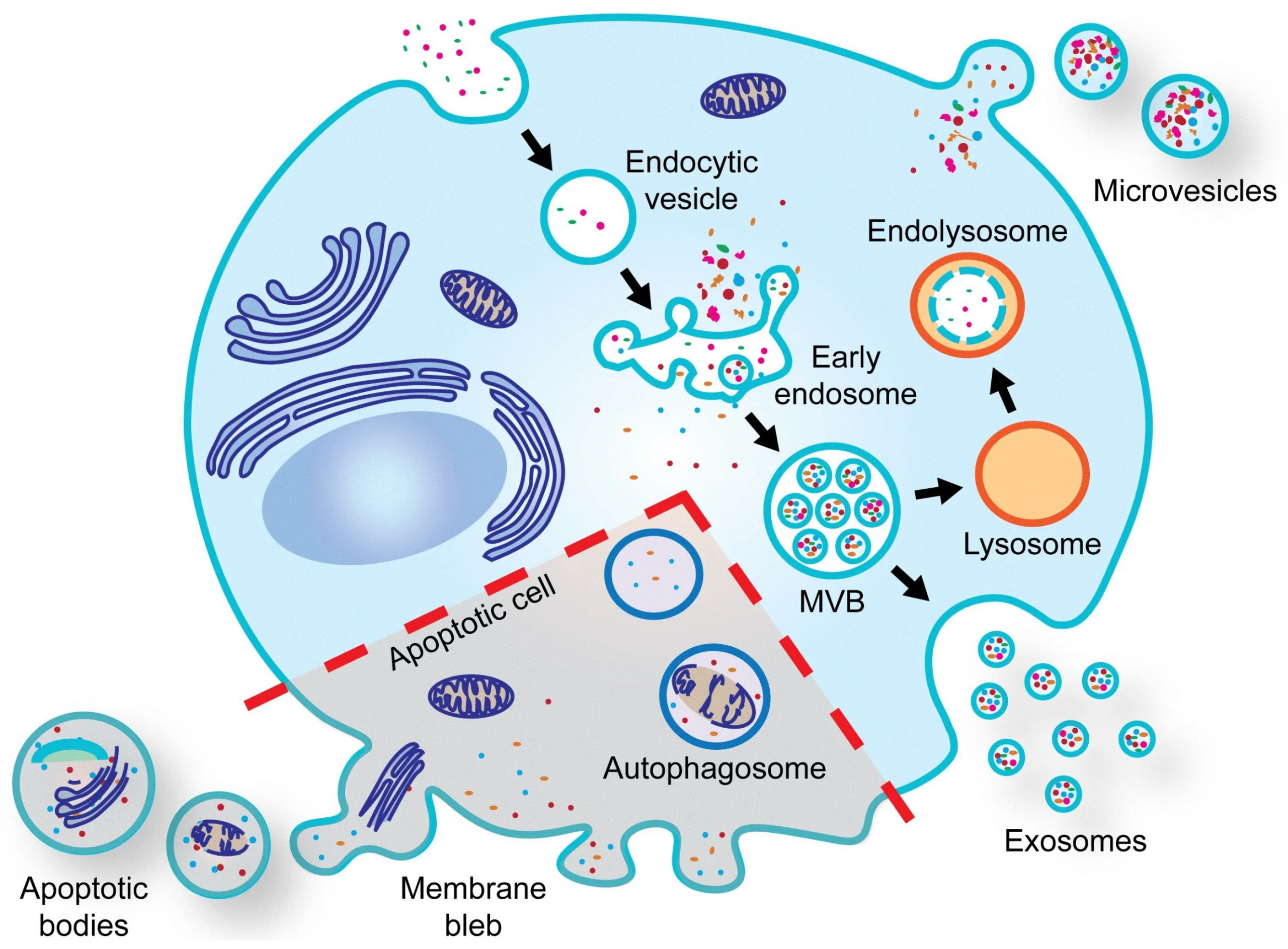
علاوه بر اندازه، مکانیسم آزادسازی وزیکول های خارج سلولی نیز با یکدیگر متفاوت است. در حالی که اگزوزومها برای انتقال به اجسام چندوزیکولی (MVBs) نیاز دارند، اجسام آپوپتوتیک و میکرووزیکولها از طریق تعامل با غشای پلاسمایی آزاد میشوند. از میان EVهای ذکر شده، شایان ذکر است که اگزوزومها بیشترین مشارکت را در ارتباطات بینسلولی، ارتباطات عصبی، ارائه آنتیژن، پاسخهای ایمنی، توسعه اندامها و عملکردهای تولیدمثلی دارند. این بدان معنی است که اگزوزومها ممکن است نقشهای بنیادیتری در شرایط پاتوفیزیولوژیک نیز داشته باشند .
بیوژنز اگزوزومها
بیوژنز اگزوزومها شامل سه مرحله اصلی است: تشکیل اندوزومهای اولیه (EEs) و اندوزومهای دیررس (LEs) یا اجسام چندوزیکولی (MVBs)، تشکیل وزیکول های درونلومنی (ILVs)، و ترشح ILVs به فضای خارج سلولی.
تشکیل اندوزومهای اولیه
اندوزومهای اولیه در نتیجه جوانهزدن غشا به داخل سلول تشکیل میشوند. این اندوزومها سپس با وزیکول های اندوسیتیک ترکیب شده و محتوای خود را ادغام میکنند.
مراحل بلوغ اندوزومها
اندوزومهای اولیه پس از دفع اندوزومهای بازیافتی، مراحل بلوغ متعددی را طی میکنند تا اندوزومهای دیررس (LEs) یا MVBs را تشکیل دهند.
سرنوشت اجسام چندوزیکولی
MVBها یا با لیزوزوم ادغام شده و تخریب میشوند یا محتوای خود را بهصورت وزیکول های ۳۰ تا ۱۰۰ نانومتری (ILVs) بستهبندی کرده و با غشای پلاسمایی ادغام شده و به فضای خارج سلولی آزاد میکنند.
بهعنوان حامل اطلاعات به سلولهای گیرنده، وزیکول های خارج سلولی (EVs) باید به درستی و سلامت کامل به سلولهای هدف تحویل داده شوند. در واقع، ساختار وزیکولی EVها محتویات آنها را از تخریب آنزیمی محافظت کرده و تضمین میکند که محموله به شکل اصلی خود به سلولهای هدف منتقل شود.
نکته قابل توجه در مورد ترشح وزیکول های خارج سلولی این است که در شرایط استرسزا، سلولها تمایل بیشتری به تولید EV دارند. این پدیده را میتوان به دو صورت توضیح داد:
اول، این یک تلاش از سوی سلولها برای دفع عوامل مضر و آسیبرسان است؛ دوم، این یک ابزار ارتباطی برای آگاهسازی سلولهای مجاور از رویداد در حال وقوع است. شواهد معتبری برای هر دو فرضیه وجود دارد. گزارش شده است که در پاسخ به آسیب DNA و بهعنوان نتیجه فعالسازی p53، سرعت آزادسازی وزیکول های خارج سلولی افزایش مییابد. همچنین، در طی هیپوکسی (کمبود اکسیژن)، تمایل سلولها به تولید EV بسیار بیشتر از شرایط نرموکسی (شرایط اکسیژن نرمال) است.
بدون توجه به هدف ترشح EVها، هنگامی که این وزیکولها آزاد میشوند، باید به سلولهای گیرنده تحویل داده شوند. مولکولهای فعالکننده یا مهارکننده متصل به غشای EVها سیگنالی را به سلولهای گیرنده منتقل میکنند تا مجوز ورود EVها صادر شود. مانند سایر وزیکول های در گردش، EVها نیز از طریق اندوسیتوز یا ادغام غشایی با غشای سلولهای گیرنده وارد سلول میشوند.
پس از ورود EVها به سلولها، آنها محتویات ارزشمند و فعال زیستی خود را آزاد میکنند تا رفتار سلولی را تغییر دهند.
به عنوان مثال، miRNAها یا lncRNAهای منتقلشده میتوانند به صورت اپیژنتیکی بیان طیف گستردهای از مولکولها را تغییر دهند، مسیرهای سیگنالینگ مختلف را فعال یا مهار کنند و ساختار کروموزومی را تغییر دهند. همچنین، mRNA منتقلشده میتواند به پروتئینهایی ترجمه شود که پیشتر در سلولهای گیرنده وجود نداشتهاند.
میکرو RNAهای مشتق شده از وزیکول های خارج سلولی: اسب تروجان برای توسعه سرطان
تولید و انتقال وزیکول های خارج سلولی (EVs) توسط سلولهای سرطانی میتواند نه تنها سلولهای مجاور را به همتای بدخیم تبدیل کند، بلکه خواص سلولهای اطراف را نیز به نفع سلولهای سرطانی تغییر دهد. اولین شواهد دخالت EVها در تومورزایی توسط Skog و همکارانش گزارش شد.
آنها نشان دادند که EVهای ترشحشده از سلولهای گلیوبلاستوما فرآیند رگزایی را در سلولهای اندوتلیال مغزی تقویت میکنند. بهزودی شواهد مشابهی در انواع دیگر سرطانهای انسانی مانند کارسینوم سلول سنگفرشی، سرطان پستان و سرطان کولورکتال یافت شد، که همگی نشان میدهند EVها بهعنوان اسب تروجان عمل میکنند تا ریزمحیط را بر اساس نیاز سلولهای تومور تغییر دهند
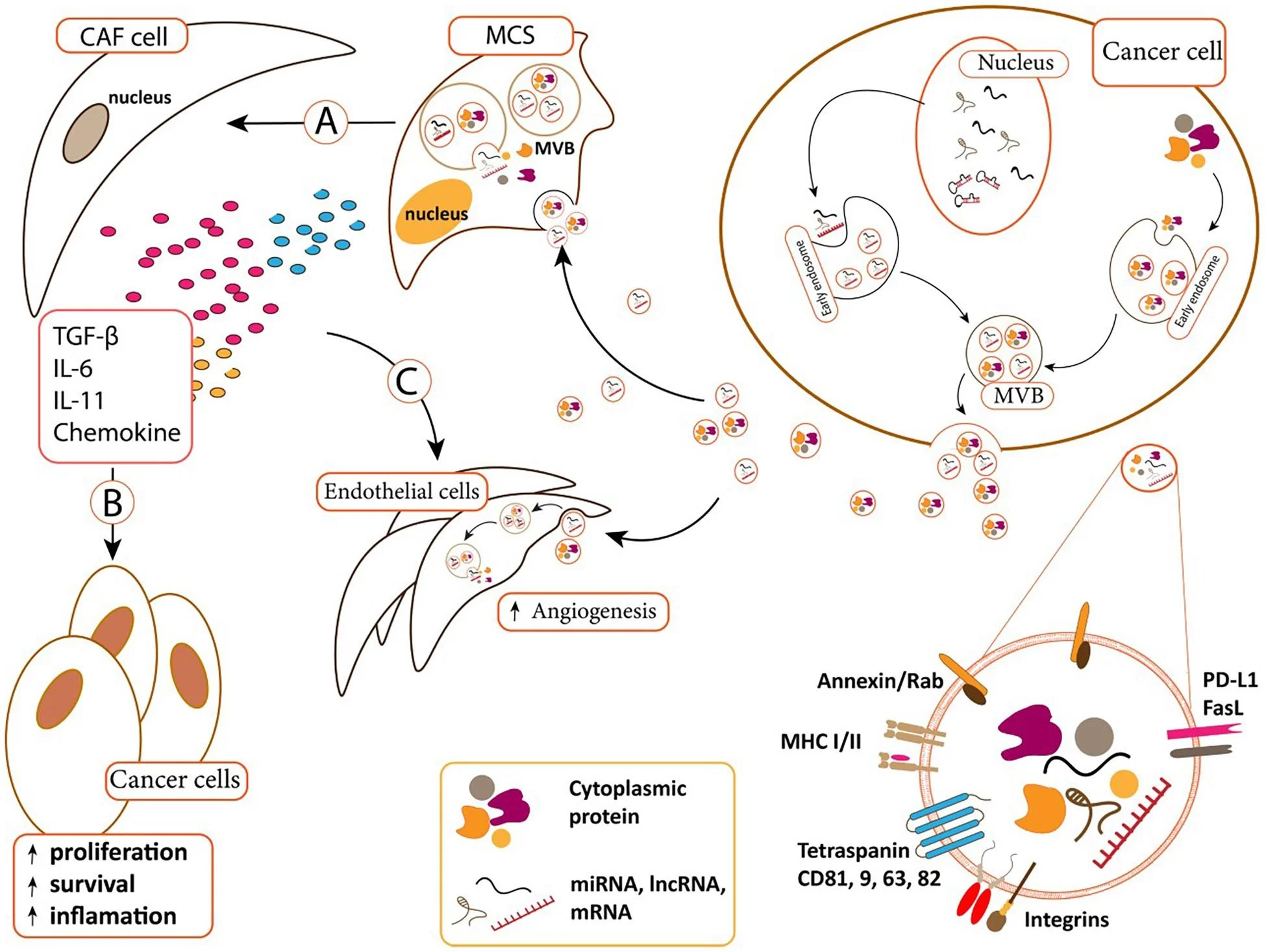
EVهای مشتقشده از تومورها همچنین میتوانند از طریق افزایش بیان مولکولهای مهارکننده لنفوسیتها یا تقویت تمایز سلولهای مهارکننده مشتقشده از میلوئید، باعث خستگی ایمنی در ریزمحیط تومور شوند.
بهعنوان مثال، گزارش شده است که EVهای مشتقشده از لوسمی میلوئید مزمن (CML) سلولهای استرومایی مغز استخوان را وادار به تولید IL-8 میکنند، یک سایتوکین که بقای سلولهای CML را افزایش میدهد. در مولتیپل میلوما، گزارش شده است که EVهای ترشحشده از سلولهای استرومایی مزانشیمی مغز استخوان، ظرفیت تکثیر سلولهای مولتیپل میلوما را از طریق انتقال miR-15a افزایش میدهند.
نتیجه گیری
این وزیکول های کوچک در گردش نقشهای اساسی در لوسمیزایی، تکثیر سلولی، بقا و همچنین رگزایی ایفا میکنند. اجزای EVها بهراحتی ساختار مغز استخوان را تغییر میدهند بهگونهای که از سلولهای لوسمیک در برابر سیستم ایمنی تطبیقی و عوامل ضدسرطانی محافظت میکنند. تاکنون، بسیاری از مطالعات بر اهمیت و ارزش EVها در تعیین نتایج بیماران مبتلا به لوسمی متمرکز شدهاند؛ اما هنوز راه طولانی برای دستیابی به بهترین نتایج باقی مانده است.
همانطور که پیشتر ذکر شد، بر اساس اندازه وزیکول های خارج سلولی، سه دسته از این وزیکول های در گردش در مایعات بدن شناسایی شدهاند و بهطور قطع، هر کدام ممکن است در برخی فرآیندهای زیستی خاص نقش داشته باشند. با این حال، به دلیل همپوشانی اندازه و ناتوانی تکنولوژیهای فعلی جداسازی و شناسایی، امکان تفکیک این وزیکولها از یکدیگر و تحلیل محتوای آنها به صورت جداگانه وجود ندارد.
علاوه بر این، بسیاری از نتایج منتشر شده در این زمینه متناقض و غیرقابل مقایسه هستند، زیرا هر گروه تحقیقاتی ممکن است از تکنیکهای متفاوتی برای جمعآوری، پردازش و ذخیره EVها استفاده کرده باشد.
با توجه به این محدودیتها، به نظر میرسد که مسائل بیشتری باید حل شوند تا EVها بتوانند به کاربردهای بالینی در لوسمی حاد وارد شوند. با این وجود، مسیر کشف EVها در لوسمی همچنان جذاب و شگفتانگیز است.
همچنین بخوانید:
- اندوسیتوز چیست؟ تعریف، فرآیند و انواع با مثال
- اگزوزوم چیست؟
- شناسایی وزیکولهای خارج سلولی در ادرار با استفاده از فلوسایتومتری
- اگزوسیتوز: تعریف، فرآیند و انواع با مثال
نویسنده: مهرداد ایزدی راد
Izadirad M, Huang Z, Jafari F, Hamidieh AA, Gharehbaghian A, Li YD, Jafari L, Chen ZS. Extracellular vesicles in acute leukemia: A mesmerizing journey with a focus on transferred microRNAs. Frontiers in Cell and Developmental Biology. 2021 Oct 6;9:766371.