اطلاعات عمومی، ویکی ژن
مولکول پروتئین چیست؟ خواص، ساختار، انواع، عملکرد پروتئینها
مقدمهای بر پروتئینها
- پروتئینها درشت مولکولهایی هستند که از مونومرهایی به نام اسیدهای آمینه تشکیل شدهاند. آمینو اسیدها واحد سازنده همه پروتئینها هستند.
- اسید آمینه یک ترکیب آلی ساده است که از یک گروه بازی (-NH2)، یک گروه اسیدی (-COOH) و یک گروه R آلی تشکیل شده است که برای هر اسید آمینه منحصر به فرد است.
- واژه اسید آمینه کوتاه کلمه آلفا آمینو کربوکسیلیک اسید است. هر مولکول دارای یک اتم کربن مرکزی به نام α-کربن است که هر دو گروه به آن متصل هستند.
- دو پیوند باقی مانده برای کربن مرکزی توسط اتم هیدروژن و یک گروه R آلی ختم میشوند.
- گروه R آلی میتواند به سادگی یک اتم هیدروژن (H) یا یک گروه متیل (-CH3) یا یک گروه پیچیدهتر باشد.
- بنابراین، کربن α در همه اسیدهای آمینه نامتقارن است به جز در گلیسین که در آن کربن α با یک اتم هیدروژن به عنوان گروه R متقارن است.
- به دلیل این عدم تقارن، آمینو اسیدها (به جز گلیسین) به دو شکل فعال نوری وجود دارند: آنهایی که دارای گروه NH2 در سمت راست هستند به عنوان فرم D و آنهایی که دارای گروه NH2 در سمت چپ به عنوان L-فرم هستند.
- دو شکل نوری متفاوت به عنوان کایرالیته نام گذاری میشود.
- آمینو اسیدها ترکیباتی آمفوتریک با هر دو گروه اسیدی و قلیایی هستند. اینها نیز همیشه به صورت یون به جز در نقطه ایزوالکتریک وجود دارند.
فرمول کلی اسید آمینه به صورت زیر است:
COOH-CH-NH2
|
R
پروتئین چیست؟
- پروتئینها ماکرومولکولهای بسیار پیچیدهای هستند که از یک یا چند زنجیره بلند آمینواسید تشکیل شده و توسط پیوندهای پپتیدی به هم متصل شدهاند.
- پروتئین یک درشت مغذی است که در همه موجودات زنده وجود دارد و مستقیماً در مسیرهای متابولیک مختلف دخالت دارد.
- پروتئینها برای گونههای خاص هستند و برای هر موجودی منحصر به فرد هستند. به طور مشابه، اینها همچنین مختص اندامها هستند، زیرا پروتئینهای مغز با پروتئینهای ماهیچهها متفاوت است.
- پروتئینها از 20 اسید آمینه مختلف تشکیل شدهاند و خاصیت یک مولکول پروتئین تابعی از اسیدهای آمینه موجود است.
- گیاهان قادر به سنتز تمام اسیدهای آمینه لازم برای ساخت پروتئین هستند، در حالی که جانوران نمیتوانند.
- اسیدهای آمینه موجود در پروتئینها توسط پیوندهای پپتیدی که بین گروه NH2 یک اسید آمینه به گروه COOH یک اسید آمینه دیگر تشکیل شده، به یکدیگر متصل میشوند.
- پروتئینها نیز پلی پپتید نامیده میشوند، زیرا آنها زنجیرههای بلندی از اسیدهای آمینه هستند که توسط پیوندهای پپتیدی به هم متصل میشوند.
سنتز پپتیدها
- پپتید یک زنجیره کوتاه است که از اسید آمینه تشکیل شده است که همراه با سایر پپتیدها یک پروتئین را تشکیل میدهد.
- زنجیرههای پپتیدی زمانی تشکیل میشوند که دو یا چند اسید آمینه توسط پیوندهای پپتیدی به یکدیگر متصل شوند.
- یک زنجیره پپتیدی میتواند کمتر از دو اسید آمینه داشته باشد. پپتیدهای بلندتر به نام پلی پپتید دارای پنجاه تا صد اسید آمینه هستند.
- پپتیدها بر اساس تعداد اسیدهای آمینه موجود در پپتید به گروههای مختلفی دستهبندی میشوند. پپتیدهای دارای دو اسید آمینه دی پپتید نامیده میشوند در حالی که پپتیدهایی با بیش از ده اسید آمینه پلی پپتید نامیده میشوند.
- پیوند پپتیدی تشکیل شده در پروتئینها نوع خاصی از پیوند آمیدی است که بین دو مولکول وجود دارد که در آن یک گروه α-کربوکسیل از یک مولکول با گروه α-آمینه یک مولکول دیگر ترکیب میشود.
- بنابراین زنجیره اسیدهای آمینه حاصل پپتید نامیده میشود.
تشکیل پیوند پپتیدی
یک پیوند پپتیدی بین دو مولکول اسید آمینه تشکیل میشود که در آن گروه α-کربوکسیل یک مولکول آمینو اسید با گروه α-آمینه یک مولکول مجاور واکنش میدهد و در نتیجه نوع خاصی از پیوند آمیدی ایجاد میشود.
تراکم
- واکنش درگیر در تشکیل پیوند پپتیدی نمونهای از واکنش تراکم است که منجر به کم آبی (حذف آب) میشود.
- تشکیل پیوند پپتیدی زمانی آغاز میشود که گروه کربوکسیل یک اسید آمینه به سمت گروه آمینو اسید آمینه دیگر حرکت میکند.
- در طول فرآیند، یک گروه هیدروکسیل (OH) از گروه کربوکسیل (COOH) اولین اسید آمینه از بین میرود در حالی که، یک هیدروژن از گروه آمینه (NH2) اسید آمینه دیگر از بین میرود.
- بنابراین، یک مولکول آب (H2O) همراه با تشکیل یک پیوند آمیدی (C-N) بین دو اسید آمینه آزاد میشود.
- تشکیل یک پیوند پپتیدی منفرد بین دو اسید آمینه باعث ایجاد یک مولکول دی پپتیدی میشود.
- تشکیل پیوند پپتیدی یک واکنش سنتز کم آبی است زیرا این فرآیند شامل حذف یک مولکول آب همراه با سنتز پروتئین است.
هیدرولیز
- هیدرولیز پپتید یک فرآیند ضروری در برخی از واکنشهای مصنوعی است که در آن اسیدهای آمینه در یک پپتید شکافته شده و به پپتید دیگر منتقل شده و در نتیجه یک زنجیره پپتیدی جداگانه سنتز میشود.
- هیدرولیز پیوند پپتیدی نیز یکی از مکانیسمهای تخریب پیوند پپتیدی است. این شامل تقسیم پلی پپتیدها به پپتیدهای کوچکتر یا تجزیه پپتیدهای کوچکتر به مولکولهای اسید آمینه منفرد است.
- هیدرولیز پیوند پپتیدی با حضور اسید کاتالیز میشود و شامل افزودن یک مولکول آب است.
- در طول هیدرولیز، یک مولکول آب بین پیوند CO-NH در توالی پپتیدی وارد میشود. در نتیجه، دو اسید آمینه با گروه NH2 انتهایی در یک و گروه COOH در دیگری از هم جدا میشوند.
پلی پپتیدها چیست؟
- پلی پپتیدها زنجیرههای بلندی از اسیدهای آمینه هستند که در آن بیش از ده اسید آمینه توسط پیوندهای پپتیدی به یکدیگر متصل شدهاند.
- یک یا چند پلی پپتید متصل به هم پروتئینی را تشکیل میدهند.
- یک انتهای یک پلی پپتید دارای یک گروه آمینه آزاد به نام آمینو ترمینال یا N-ترمینال است، در حالی که انتهای دیگر دارای یک گروه کربوکسیل آزاد به نام کربوکسیل ترمینال یا ترمینال C است.
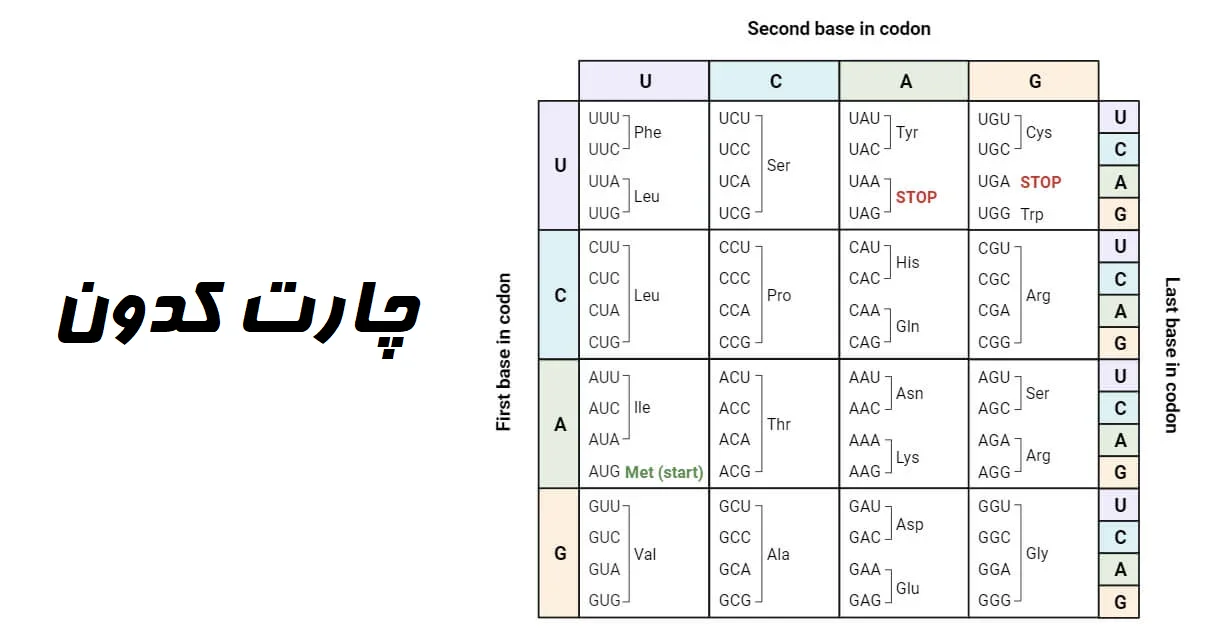
- توالی اسیدهای آمینه در یک پلی پپتید توسط کدونهای موجود در RNA پیام رسان که پلی پپتید از آن ترجمه شده تعیین میشود.
- توالی کدونها در mRNA به نوبه خود به توالیهای نوکلئوتیدی در مولکول DNA وابسته است.
خواص پروتئینها
حلالیت در آب
- رابطه پروتئینها با آب پیچیده است.
- ساختار ثانویه پروتئینها تا حد زیادی به تعامل پیوندهای پپتیدی با آب از طریق پیوندهای هیدروژنی بستگی دارد.
- پیوندهای هیدروژنی نیز بین پروتئین (ساختارهای آلفا و بتا) و آب تشکیل میشود. استاتیک ball غنی از پروتئین نسبت به ساختارهای مارپیچ حلالیت بیشتری دارد.
- در ساختار سوم، آب باعث جهت گیری زنجیرهها و رادیکالهای آبدوست به سمت خارج مولکول میشود. در حالی که زنجیرهها و رادیکالهای آبگریز تمایل به واکنش با یکدیگر در داخل مولکول دارند (اثر آبگریز).
دناتوره سازی و دناتوراسیون
- پروتئینها میتوانند توسط عواملی مانند گرما و اوره که باعث باز شدن زنجیرههای پلی پپتیدی بدون ایجاد هیدرولیز پیوندهای پپتیدی، دناتوره شوند.
- عوامل دناتوره کننده ساختارهای ثانویه و سوم را بدون تأثیر بر ساختار اولیه تخریب میکنند.
- اگر یک پروتئین دناتوره شده پس از حذف عامل دناتوره به حالت اصلی خود بازگردد، این فرآیند را renaturation مینامند.
برخی از عوامل دناتوره کننده عبارتند از
- عوامل فیزیکی: گرما، تشعشع، pH
- عوامل شیمیایی: محلول اوره که پیوندهای هیدروژنی جدیدی در پروتئین ایجاد میکنند، مانند حلالهای آلی، مواد شوینده.
انعقاد
هنگامی که پروتئینها توسط گرما دناتوره میشوند، ذرات نامحلول را تشکیل میدهند که به عنوان منعقد کننده شناخته میشوند. همه پروتئینها قابل انعقاد حرارتی نیستند، فقط تعداد کمی مانند آلبومینها، گلوبولینها انعقادکننده حرارتی هستند.
نقطه ایزوالکتریک
نقطه ایزوالکتریک (pI) pH است که در آن تعداد بارهای مثبت برابر با تعداد بارهای منفی بوده و بار کلی اسید آمینه صفر است.
در این مرحله، وقتی پروتئینها در معرض میدان الکتریکی قرار میگیرند، به سمت آند یا کاتد حرکت نمیکنند، بنابراین از این خاصیت برای جداسازی پروتئینها استفاده میشود.
وزن مولکولی پروتئینها
- میانگین وزن مولکولی یک اسید آمینه 110 در نظر گرفته میشود.
- تعداد کل آمینو اسیدهای موجود در پروتئین ضربدر 110 وزن مولکولی تقریبی آن پروتئین را به دست میدهد.
- پروتئینهای مختلف دارای ترکیبات اسید آمینه متفاوتی هستند و از این رو وزن مولکولی آنها متفاوت است.
- وزن مولکولی پروتئینها از 5000 تا 109 دالتون متغیر است.
اصلاحات پس از ترجمه
- پس از سنتز پروتئین روی ریبوزوم اتفاق میافتد.
- فسفوریلاسیون، گلیکوزیلاسیون، ریبوزیلاسیون ADP، متیلاسیون، هیدروکسیلاسیون و استیلاسیون بر بار و فعل و انفعالات بین بقایای اسید آمینه تأثیر میگذارد. همچنین پیکربندی سه بعدی و در نتیجه عملکرد پروتئین را تغییر میدهد.
ساختار پروتئین
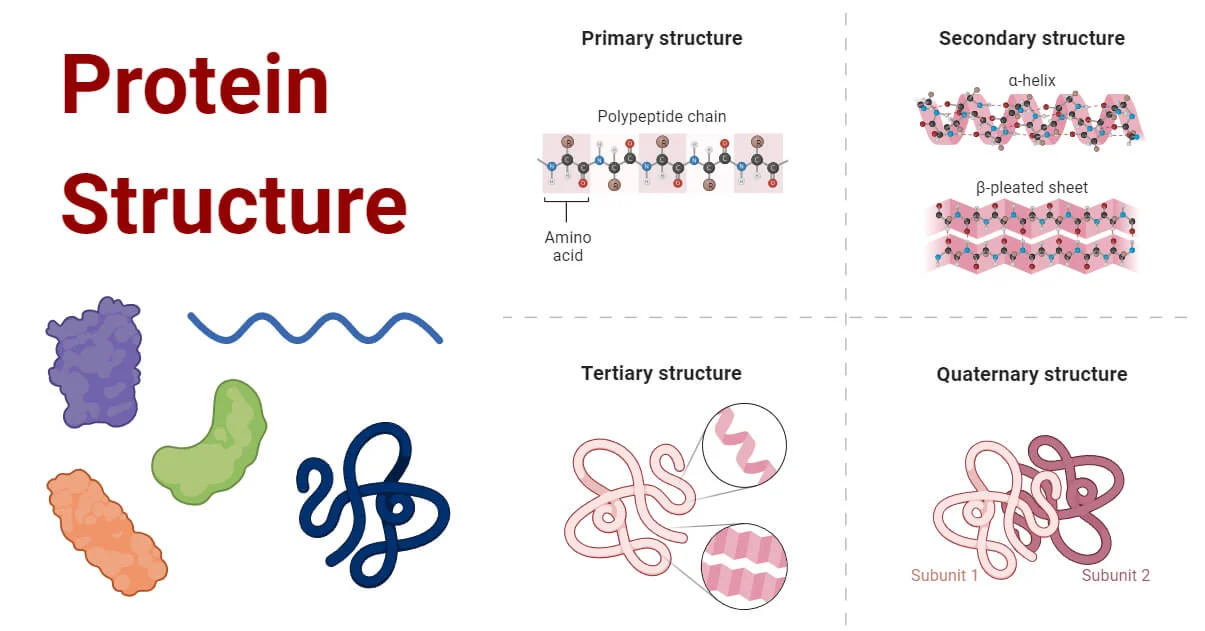
- از آنجایی که پروتئین یک ماکرومولکول پیچیده است، ساختار آن با استفاده از چهار سطح ساختاری اساسی توصیف شده است.
- این سطوح ساختاری اغلب به عنوان اولیه، ثانویه، سوم و چهارم نامیده میشوند.
- سه مورد از این سطوح ساختاری (اولیه، ثانویه و سوم) میتوانند در مولکولهای متشکل از یک زنجیره پلی پپتیدی منفرد وجود داشته باشند. در مقابل، ساختار چهارم شامل برهمکنش پلی پپتیدها در یک مولکول پروتئین چند زنجیرهای است.
-
ساختار اولیه
- ساختار اولیه پروتئین نسبتاً ساده است و از یک یا چند زنجیره خطی از تعدادی واحد اسید آمینه تشکیل شده است.
- ساختار اولیه پروتئین تعداد و توالی اسیدهای آمینه را نشان داده که واحدهای تشکیل دهنده زنجیره پلی پپتیدی را تشکیل میدهند.
- پیوند اولیه بین آمینو اسیدها در پروتئینها پیوند پپتیدی است که گروه α-کربوکسیل یک باقیمانده اسید آمینه را به گروه α-آمینه اسید آمینه مجاور پیوند میدهد. پروتئینها ممکن است از یک یا چند زنجیره پلی پپتیدی تشکیل شوند.

- یک پیوند دوگانه جزئی بین کربن و نیتروژن پیوند آمید ایجاد میشود که به تثبیت پیوند پپتیدی کمک میکند.
- هنگامی که نیتروژن درگیر در پیوند، جفت تنها خود را به گروه کربونیل اهدا میکند، یک اثر رزونانس ایجاد میشود.
- مکانیسم تشدید بسیار پایدار است زیرا الکترونها را میتوان روی اتمهای متعدد جابجا کرد و ساختاری را ایجاد کرد که نسبت به ساختار اصلی پایدار است.
- ساختار تشدید ایجاد شده پیوند را تثبیت کرده اما همچنین چرخش پیوند آمیدی را به دلیل پیوند دوگانه جزئی محدود میکند.
- پیوندهای پپتیدی یک پیکربندی مسطح ایجاد میکنند که کمترین حرکت را در اطراف پیوند C-N انجام میدهد. اما سایر پیوندهای منفرد در دو طرف پیوند C-N درجه بالایی از حرکت چرخشی را نشان میدهند.
-
ساختار ثانویه
- ساختار اولیه خطی و بازشده زنجیره پلی پپتیدی است که اغلب یک شکل مارپیچ برای تولید ساختار ثانویه به خود میگیرد.
- ساختار ثانویه پروتئینها به رابطه فضایی اسید آمینهای اشاره دارد که در توالی آن به یکدیگر نزدیک هستند.

- چین خوردگی زنجیره عمدتاً به دلیل وجود پیوندهای هیدروژنی است که میتواند درون مولکولی یا بین مولکولی است.
- تاخوردگی و پیوند هیدروژنی بین اسیدهای آمینه مجاور منجر به تشکیل ساختاری به نام مارپیچ میشود.
- ساختارهای ثانویه در پروتئینها بر اساس ماهیت پیوند هیدروژنی دو نوع هستند. ورق α-هلیکس و β-شیت.
آ. ساختار آلفا هلیکس
ساختار آلفا هلیکس زمانی تشکیل میشود که گروه CO هر اسید آمینه با پیوند هیدروژنی به گروه NH اسید آمینه که چهار پیوند جلوتر در توالی خطی وجود دارد، متصل شود.
ساختار α-هلیکس به پیوند هیدروژنی درون مولکولی بین گروههای NH و CO پیوندهای پپتیدی بستگی دارد.
ب ساختار بتا شیت
ساختار ورقه β- شیت از تراز موازی تعدادی زنجیره پلی پپتیدی، با پیوندهای هیدروژنی بین گروههای >C = O و N-H زنجیرههای مجاور تشکیل میشود.
گروههای R آمینو اسیدهای تشکیل دهنده در یک زنجیره پلی پپتیدی به طور متناوب در بالا و زیر صفحه قرار میگیرند.
تشکیل صفحات بتا به پیوند هیدروژنی بین مولکولی بستگی دارد، اگرچه پیوندهای هیدروژنی درون مولکولی نیز وجود دارد.
-
ساختار سوم
- ساختار سوم مولکول پروتئین یک ساختار سه بعدی از پروتئین است که از تا شدن ساختار ثانویه در الگوهای خاص تشکیل شده است.
- ساختار سوم عموماً توسط برهمکنشهای هیدروژنی آبدوست و پیوند یونی خارجی قطبی و برهمکنشهای آبگریز داخلی بین زنجیرههای جانبی اسید آمینه غیرقطبی تثبیت میشود.

- بر اساس ساختار سوم، پروتئینها اغلب به انواع کروی یا فیبری تقسیم میشوند.
آ. پروتئینهای فیبری
پروتئین های فیبری ساختارهای طناب مانند درازی دارند که قوی و آبگریز هستند. معمولاً و عمدتاً از یک نوع ساختار ثانویه تشکیل شدهاند. ساختارهایی که شکلدهی و محافظ خارجی را برای مهره داران فراهم میکنند از پروتئینهای فیبری مانند α-کراتین ساخته شدهاند.
ب. پروتئینهای کروی
پروتئینهای کروی اغلب حاوی چندین نوع ساختار ثانویه هستند و بیشتر کروی و آبدوست هستند. بنابراین، بیشتر آنزیمها و پروتئینهای تنظیم کننده مانند ایمونوگلوبولینها پروتئینهای کروی هستند.
-
ساختار کواترنری (ساختار چهارم)
آرایش سه بعدی زیرواحدهای پروتئینی در پروتئینهای حاوی دو یا چند زنجیره پلی پپتیدی یکسان یا متفاوت یا زیرواحد ساختار چهارتایی است.

زیرواحدها توسط نیروهای غیرکووالانسی بین نواحی آبگریز و آبدوست سطح مکمل روی زیرواحدهای پلی پپتیدی کنار هم نگه داشته میشوند. این نیروها به زنجیرههای پلی پپتیدی اجازه می دهند تا تحت تغییرات سریع ساختاری قرار گیرند که بر فعالیت بیولوژیکی پروتئینها تأثیر میگذارد.
پیوند پروتئینها
علاوه بر پیوندهای پپتیدی اولیه، چندین پیوند ثانویه دیگر مسئول تشکیل ساختار خالص پروتئینها هستند.
برخی از پیوندهای ثانویه رایج موجود در پروتئینها عبارتند از:
-
پیوندهای هیدروژنی
پیوند هیدروژنی در پروتئینها به دلیل تمایل یک اتم هیدروژن که به طور کووالانسی به اتصال با یک اتم الکترونگاتیو، برای به اشتراک گذاشتن الکترونها با اتمهای مجاور مانند O یا N است.
در یک پیوند پپتیدی، پیوند هیدروژنی را میتوان به صورت زیر مشاهده کرد:
-C=O∙∙∙∙∙∙∙∙∙∙∙∙HN-
خط نقطه چین بین اتمهای اکسیژن و هیدروژن در پیوند پپتیدی نشان دهنده یک پیوند هیدروژنی است.
پیوند هیدروژنی در پروتئین مهم است زیرا ساختار ثانویه پروتئینها را تثبیت میکند.
-
پیوندهای یونی
- پیوندهای یونی در پروتئینها بین گروههای اسیدی و بازی اسیدهای آمینه تشکیل دهنده مشاهده میشود.
- فعل و انفعالات الکترواستاتیکی نیز بین گروههای دارای بار متفاوت موجود در زنجیرههای جانبی اسیدهای آمینه وجود دارد.
- گروههای یونیزه به جای تثبیت ساختار پروتئین در تثبیت فعل و انفعالات بین پروتئین و سایر مولکولها نقش دارند.
- این پیوندهای یونی، اگرچه ضعیفتر از پیوندهای هیدروژنی هستند، اما مسئول حفظ ساختار سه بعدی یا ساختار سوم پروتئینهای کروی هستند.
-
پیوندهای دی سولفیدی
- پیوند دی سولفیدی دومین نوع پیوند کووالانسی است که بین پروتئینها و پلی پپتیدها تشکیل میشود.
- این پیوند با اکسیداسیون گروههای تیول یا سولفیدریل (-SH) از دو سیستئین ایجاد میشود.
- حتی اگر پلهای دی سولفیدی در مقایسه با استحکام پیوندهای غیرکووالانسی بسیار قوی باشند، آنها برد کوتاهی دارند. همچنین تنها زمانی که پیوند کاملاً تشکیل شد میتوانند ساختار سوم را تثبیت کنند.
فعل و انفعالات آبگریز و آب دوست
- فعل و انفعالات آبگریز بین زنجیرههای جانبی یا گروههای R آبگریز رخ میدهد.
- گروههای آبگریز در بین خود متحد شده و باعث از بین رفتن آب بین بخشهای مختلف یک زنجیره یا بین زنجیرههای مختلف میشوند.
- فعل و انفعالات آبگریز همچنین ممکن است بین پیوندهای دیگر مانند پیوندهای هیدروژنی یا پیوندهای یونی بین گروههای دیگر منجر شود.
- پیوندهای آبگریز همچنین به سایر فعل و انفعالات پروتئینی کمک میکنند. به عنوان مثال، تشکیل کمپلکسهای آنزیم-سوبسترا و برهمکنشهای آنتی بادی-آنتی ژن.
- فعل و انفعالات آبدوست منجر به پیوند هیدروژنی بین اتمهای الکترونگاتیو و اتمهای هیدروژن میشود.
پروتئینهای فیبری
کلاژن
- کلاژن فراوانترین پروتئین پستانداران است که حدود 25 تا 33 درصد از کل پروتئینهای بدن را تشکیل میدهند.
- این عنصر ساختاری اصلی بدن انسان است که در بافتهای همبند مانند تاندونها، غضروفها، استخوانها و قرنیه چشم یافت میشود.
- از نظر ساختاری، مارپیچ کلاژن یک ساختار ثانویه منحصر به فرد است که کاملاً از مارپیچ α متمایز است. چپ گرد است و سه اسید آمینه باقی مانده است.
- کلاژن نیز یک هلیکس است، اما با ساختارهای سوم و چهارم مشخص که در آن سه پلی پپتید مجزا به نام زنجیره α در اطراف یکدیگر پیچیده شدهاند.
- به طور معمول آنها حاوی حدود 35٪ گلیسین، 11٪ آلانین، و 21٪ پرولین و 4-هیدروکسی پرولین هستند.
کراتین
- کراتین یا α-کراتین یک پروتئین فیبری است که تقریباً کل وزن خشک مو، پشم، ناخن، پنجه، شاخ، سم و بیشتر لایه بیرونی پوست پستانداران را تشکیل میدهد.
- Α-کراتینها بخشی از خانواده وسیعتری از پروتئینها به نام پروتئینهای رشته میانی (IF) هستند.
- مارپیچ α-کراتین یک مارپیچ α راست گرد است، ساختار ثانویهای که در بسیاری از پروتئینهای دیگر یافت میشود.
- دو رشته α-کراتین که به صورت موازی قرار گرفتهاند، در اطراف یکدیگر پیچیده شدهاند تا یک سیم پیچ فوق العاده پیچ خورده را تشکیل دهند که استحکام ساختار کلی را تقویت میکند.
- یک پلی پپتید مجزا در هلیکس آلفا-کراتین دارای ساختار سوم نسبتاً ساده است که توسط یک ساختار ثانویه α-هلیکس با محور مارپیچ آن که در یک ابرمارپیچ چپ گرد پیچ خورده است.
- درهم تنیدگی دو پلی پپتید α-هلیکس در کراتین به عنوان نمونه ایاز ساختار چهارتایی عمل میکند.

الاستین
- الاستین یک پروتئین اصلی است که در اندامهای مختلفی یافت می شود که به آنها خاصیت ارتجاعی میدهد. این اندامها شامل ریهها، مثانه و غضروفهای الاستیک هستند.
- زنجیره پلی پپتیدی از پروتئین تروپوالاستین، حاوی گلیسین و والین و آلانین و پرولین اصلاح شده تشکیل شده است.
- به دلیل عملکرد ساختاری و نامحلول بودن، به عنوان پروتئین فیبری طبقه بندی میشود.
- الاستین فاقد ساختار ثانویه منظم است. دارای پیوندهای متقابل توالیهای مختلف پروتئینی است.
- الاستین همچنین غنی از گلیسین و پرولین است.
پروتئینهای گلوبولار
هموگلوبین
- هموگلوبین ناقل اکسیژن در گلبولهای قرمز است و حدود 90 درصد پروتئین گلبولهای قرمز را تشکیل میدهد.
- این یک پروتئین تترامری با چهار زنجیره پلی پپتیدی است که توسط فعل و انفعالات غیرکووالانسی به هم متصل میشوند.
- دو تا از چهار زنجیره پلی پپتیدی زنجیره α هستند و دو زنجیره باقی مانده زنجیره β هستند.
- زنجیرههای α و β هموگلوبین حاوی چندین بخش از مارپیچ α هستند که به صورت توسط پیوندهای یونی و هیدروژنی کنار هم قرار گرفتهاند.
- به طور مشابه، چهار زنجیره پلی پپتیدی تقریباً به صورت چهار وجهی با هم قرار میگیرند تا ساختار چهارتایی مشخصه را ایجاد کنند.
انسولین
- انسولین یک هورمون پپتیدی است که توسط سلولهای بتا پانکراس تولید میشود و متابولیسم کربوهیدراتها، چربیها و پروتئینها را تنظیم میکند.
- انسولین تولید شده در بدن به شکل هگزامر ذخیره میشود، اما شکل فعال آن یک مونومر است.
- هگزامر به عنوان راهی برای پایدار نگه داشتن پروتئین و محافظت از آن عمل میکند.
- یک مونومر پروتئینی انسولین از 51 اسید آمینه تشکیل شده است توسط دو زنجیره پپتیدی که توسط پیوندهای دی سولفیدی به هم مرتبط شدهاند تشکیل شده است.
- یکی از زنجیرهها دارای دو مارپیچ α است. در حالی که زنجیرههای دیگر دارای یک مارپیچ α و دو β شیت هستند.
- توالی اسیدهای آمینه در انسولین به شدت حفظ شده است و بین گونههای مختلف فقط کمی متفاوت است.

پپسین
- پپسین آنزیمی است که پروتئینها را به پپتیدها یا اسیدهای آمینه کوچکتر تجزیه میکند.
- این یکی از سه پروتئاز مهم در بدن انسان به همراه تریپسین و کیموتریپسین است.
- پپسین توسط سلولهای دیواره معده به شکل پپسینوژن آزاد شده که پس از مخلوط شدن با اسید هیدروکلریک به پپسین تبدیل میشود.
- ساختار ثانویه غالب در پپسین صفحات β به همراه شش مارپیچ α راست گرد است.
- پپسین همچنین بخشی از مایه پنیر است که برای بستن شیر در هنگام تولید پنیر استفاده میشود.
پروتئین های کنژوگه
گلیکوپروتئینها
- گلیکوپروتئینها پروتئینهای حاوی کربوهیدراتها به عنوان یک گروه مصنوعی هستند. آنها حاوی مقادیر کمی کربوهیدرات (معمولا کمتر از ۴٪) هستند.
- گلیکوپروتئینها به عنوان پروتئینهای جداییناپذیر مهم در غشاهای بیولوژیکی مختلف عمل میکنند که به تعاملات سلول-سلول کمک میکنند.
- ایمونوگلوبولینها گلیکوپروتئینهای مهم سیستم ایمنی هستند که به عنوان آنتی بادی عمل میکنند و در برابر آنتی ژنها محافظت میکنند.
- به طور مشابه، گلیکوپروتئینهای محلول نیز در آلبومین تخم مرغ و پلاسمای خون یافت میشوند.
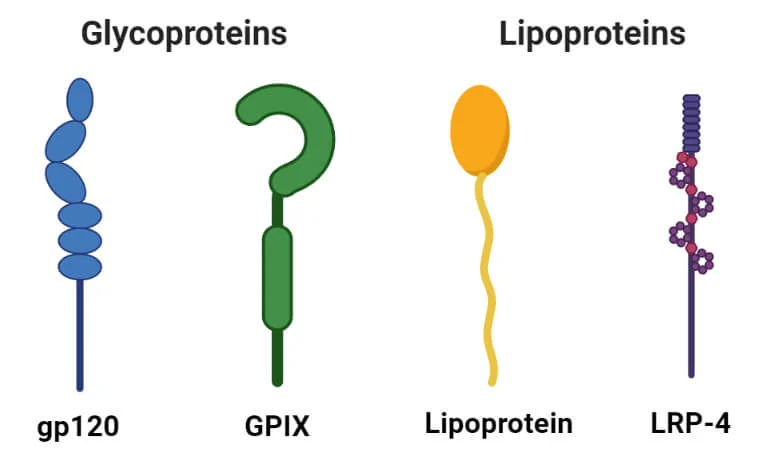
لیپوپروتئینها
- لیپوپروتئینها پروتئینهایی هستند که با لیپیدهایی مانند سفالین، لسیتین و کلسترول کمپلکس تشکیل میدهند.
- اینها در آب محلول هستند اما در حلالهای آلی نامحلول هستند.
- لیپوپروتئینها به عنوان واسطههای موقت در فرآیند انتقال لیپیدها از محل جذب به محل استفاده عمل میکنند.
- لیپوپروتئینها در تکنیک جداسازی گرادیان چگالی به چهار گروه طبقهبندی میشوند.
دناتوره شدن پروتئین
- دناتوره شدن پروتئین فرآیند تخریب ساختارهای چهارم، سوم و ثانویه پروتئینها با اعمال نیروی خارجی یا مواد شیمیایی قوی مانند اسید و باز است.
- دناتوره شدن پروتئین ممکن است فعالیت سلولی را از بین ببرد زیرا بسیاری از مسیرهای متابولیک به پروتئین در یک شکل یا شکل دیگر نیاز دارند.
- پس از دناتوره شدن، پروتئینها طیف وسیعی از خواص مانند تغییر ساختار و از دست دادن حلالیت را نشان میدهند.
- پیوندهای هیدروژنی مسئول ساختار سوم پروتئینها ضعیف هستند و به راحتی با گرما و تشعشع میشکنند.
- با این حال، دناتوراسیون بر ساختار اولیه پروتئینها تأثیر نمیگذارد.
- در برخی موارد، دناتورهسازی برگشتپذیر است و پروتئینها میتوانند پس از حذف عامل استرس، شکل اصلی خود را به دست آورند. با این حال، برخی از موارد دناتوره شدن غیر قابل برگشت هستند.
طبقهبندی پروتئینها
بر اساس ماهیت شیمیایی، ساختار، شکل و حلالیت، پروتئینها به صورت زیر طبقهبندی میشوند:
- پروتئینهای ساده: آنها فقط از باقی مانده اسید آمینه تشکیل شدهاند. در هیدرولیز، این پروتئینها تنها اسیدهای آمینه تشکیل دهنده را تولید میکنند. بیشتر به موارد زیر تقسیم میشود:
- پروتئین فیبری: کراتین، الاستین، کلاژن
- پروتئین گلوبولار: آلبومین، گلوبولین، گلوتلین، هیستون
- پروتئینهای مزدوج: با بخش غیر پروتئینی ترکیب میشوند. به عنوان مثال نوکلئوپروتئین، فسفوپروتئین، لیپوپروتئین، متالوپروتئین و غیره.
- پروتئینهای مشتق شده: مشتقات یا محصولات تجزیه شده پروتئینهای ساده و مزدوج هستند.
- پروتئین مشتق شده اولیه: متاپروتئینها، پروتئینهای انعقادی
- پروتئینهای مشتق ثانویه: پروتئوزن یا آلبونوزها، پپتونها، پپتیدها.
عملکرد پروتئینها
پروتئینها مولکولهای زیستی ضروری هستند که برای حیات و انجام فعالیتهای مختلف ضروری هستند. برخی از نقشهای بیولوژیکی مهم پروتئینها عبارتند از:
- بسیاری از پروتئینها به عنوان کاتالیزور عمل میکنند که سرعت واکنشهای شیمیایی را در مسیرهای متابولیکی مختلف افزایش میدهد.
- پروتئینهای فیبری جزئی از بافتهای مختلف هستند. اینها عناصر اسکلتی مانند کلاژن، که یک واحد ساختاری از بافتهای همبند است، را در کنار هم نگه میدارند.
- نوکلئوپروتئینها به عنوان حامل ویژگیهای ژنتیکی عمل میکنند و از این رو بر وراثت صفات تاثیر میگذارند.
- پروتئینها همچنین عملکردهای انتقالی را انجام میدهند که حمل و نقل بسیاری از ترکیبات را به داخل و خارج سلولها تنظیم میکند و در غلظتهای بسیار بالاتر از آنچه از انتشار انتظار میرود در داخل تجمع مییابد.
- هورمونهای پروتئینی مختلف علاوه بر کنترل بسیاری از عملکردهای فیزیولوژیکی دیگر، رشد گیاهان و جانوران را تنظیم میکنند.
- پلاسمای خون دارای پروتئینهای محلول متعددی است که میتوان از آنها برای درمان شوک ناشی از جراحات استفاده کرد.
- اینترفرونها گلیکوپروتئینهای تنظیمی هستند که توسط بسیاری از سلولهای یوکاریوتی در پاسخ به عفونت ویروسی، اندوتوکسینها، محرکهای آنتی ژنی و بسیاری از ارگانیسمهای انگلی تولید میشوند.
- پپتیدهای انسان به نام دفنسین ماهیت آنتی بیوتیکی دارند.
همچنین بخوانید:
- انواع ساختار پروتئینها با شکل
- لیپوپروتئین چیست؟ انواع و میزان طبیعی
- لیپید چیست؟ خواص، ساختار، طبقه بندی، انواع
- پروتئین های پلاسما (Plasma Proteins): تعریف، ساختار و کارکردها
مترجم: شقایق مرتاضی




عالی بود💖🌺🌺
نقطه TM به چه علت محدود است