ویکی ژن
آماده سازی وکتور برای کلونینگ ژن
نکات مهم در مورد آماده سازی وکتور برای کلونینگ ژن
یکی از مهم ترین مراحل در هر روش کلونینگ، تهیه وکتور است. در صورت اشتباه در انتخاب وکتور، شانس موفقیت شما به شدت کاهش می یابد. هدف کلی برای آماده سازی وکتور خوب، به دست آوردن یک استوک نسبتا غلیظ از DNA پلاسمید آسیب نخورده و کاملا هضم شده است که عاری از آلودگی باشد. از دست دادن هر یک از این اهداف بر کارایی ligation تأثیر می گذارد و علت بسیاری از مشکلات محققان با کلونینگ است.
در اینجا به یکسری از نکات مهم برای آماده سازی وکتور اشاره می کنیم:
۱- با یک استوک پلاسمید خوب شروع کنید
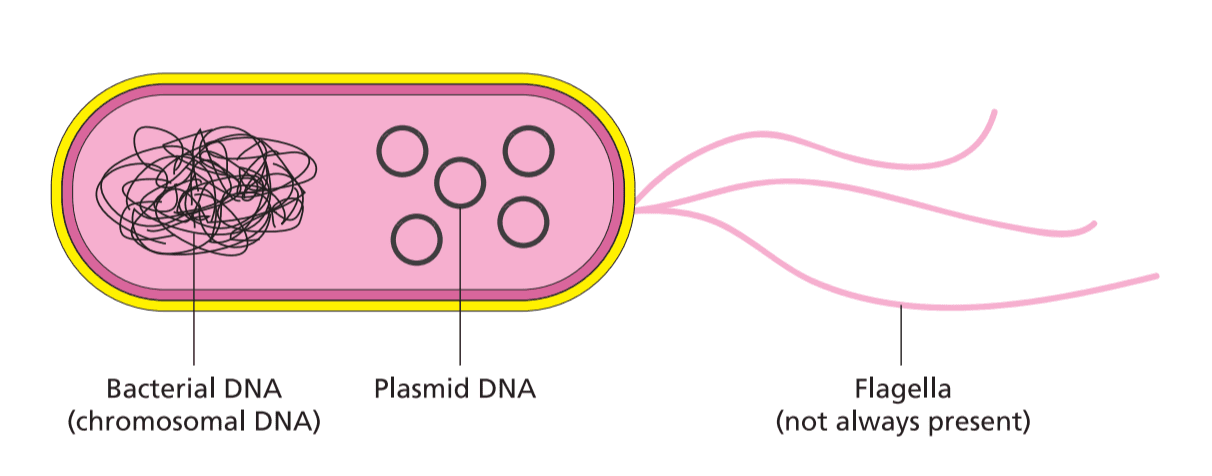
ممکن است بدیهی به نظر برسد، اما شروع با یک استوک پلاسمید با کیفیت پایین باعث ایجاد مشکل می شود. پس از تهیه DNA، کیفیت آن را با استفاده از ژل آگارز و مشخصات UV بررسی کنید. اگر استوک پلاسمید ضعیف است (غلظت DNA پایین، آلودگی RNA، gDNA، آلودگی پروتئینی، آلودگی نمکی، آلودگی فنلی و اتانول و …)، بایستی استوک مورد نظر را دور بریزید و یک نمونه جدید بسازید.
۲- به دایجست توجه کنید
مرحله ی دایجست آسان به نظر می رسد، اما اهمیت برنامه ریزی و اجرای خوب در این بخش از روش را دست کم نگیرید. در اینجا یکسری قوانین کلی برای هضم وجود دارد:
از بالاترین حجم واکنش عملی استفاده کنید. حجم دایجست با مرحله مورد نظر بعدی محدود می شود (مثلا حجمی که ژل آگارز شما می تواند نگه دارد) اما با حجم بالاتر، ناخالصی های موجود در آماده سازی پلاسمید که می تواند واکنش شما را مهار کند بیشتر رقیق می شود.
همیشه BSA را به دایجست اضافه کنید. بسیاری از آنزیمهای محدودکننده به آن نیاز دارند و آنهایی که نیاز ندارند تحت تأثیر حضور آن قرار نمیگیرند. اگر همیشه آن را اضافه کنید، نمیتوانید در صورت نیاز آن را فراموش کنید.
حجم آنزیم محدود کننده را حداکثر به 10 درصد از حجم کل محدود کنید، در غیر این صورت گلیسرول و EDTA در بافر آنزیم می تواند واکنش را مهار کند. (استفاده از حداقل ۲۰ واحد آنزیم در هر میکروگرم DNA پلاسمید برای انکوباسیون ۱ ساعته)
تأیید کنید که دایجست موفقیت آمیز بوده است. به عنوان مثال، یک نمونه پلاسمید هضم نشده را در کنار دایجست روی یک ژل ران کنید. پلاسمید هضم شده باید مهاجرت متفاوتی نسبت به پلاسمید دایره ای هضم نشده داشته باشد.
اگر از بیش از یک آنزیم محدود کننده استفاده می کنید، دایجست های منفرد را با هر آنزیم انجام دهید تا اطمینان حاصل شود که هر دو آنزیم به درستی برش داده می شوند. اگر بیش از یک باند وجود داشته باشد به این معنی است که دایجست کامل نشده است و پلاسمید برش نخورده است. دایجست را دور بریزید و تکرار کنید. ممکن است لازم باشد که وکتور دوباره آماده شود زیرا یک آلودگی در آماده سازی وکتور می تواند دایجست را مهار کند.
۳- جلوگیری از دایجست مجدد
اگر انتهای بریده شده وکتور بتواند به طور موثر در مرحله دایجست، مجددا بسته شود، پس زمینه بالایی در دایجست به دست خواهید آورد. این مشکل عمدتا در کلونینگ با انتهای blunt-end است و راه حل آن دفسفریله کردن وکتور با استفاده از یک فسفاتاز است. برای کلونینگ جهت دار، مشکل پیوند مجدد را می توان با انتخاب آنزیم هایی که انتهای ناسازگار تولید می کنند به طور کامل از بین برد که در آن یکی از آنزیمها یک overhang 5’ و دیگری یک برآمدگی 3’ ایجاد می کند.
۴- یک separation خوب داشته باشید
حتی در یک دایجست خوب، مقداری پلاسمید هضم نشده باقی میماند و میتواند باعث ایجاد پسزمینه بالایی در دایجست شود. معمولا از ژل آگارز برای جداسازی این گونه ها استفاده می شود، اما جداسازی درست نیاز به کمی کار دارد. سعی کنید تا زمانی که ممکن است ژل را ران کنید. اگر دایجست شما خوب است، DNA دایجست نشده باید نامرئی باشد. استفاده از غلظت صحیح آگارز برای اندازه برداری شما با اطمینان از جداسازی بهینه دو گونه کمک خواهد کرد. به عنوان مثال، می توانید از آگارز ۰.۶ درصد برای وکتورهای ۶-۴ کیلوبایتی استفاده کنید.
متداول ترین روش برای تجسم DNA پلاسمید استفاده از اتیدیوم بروماید و UV است. نور ماوراء بنفش به پلاسمید آسیب می رساند و روش معمول تلاش برای به حداقل رساندن آسیب با قرار گرفتن در معرض پلاسمید برای کوتاه ترین زمان ممکن است. پلاسمید میتواند آسیب زیادی را حتی با قرار گرفتن بسیار کوتاه تحمل کند و کارایی کلونینگ را به شدت کاهش دهد.
روش ترجیحی استفاده از رنگی مانند کریستال ویولت یا متیلن بلو برای تجسم پلاسمید است که برهمکنش بسیار ضعیفتری با DNA دارند، بنابراین تنها باندهای حاوی بیش از ۰.۵ میکروگرم DNA قابل مشاهده هستند. این کار را کمی دشوار می کند.
مطالب مرتبط:




