مقدمهای بر استئوسارکوم
سرطان زمانی شروع میشود که سلولهای بدن شروع به رشد خارج از کنترل میکنند. سلولها تقریباً در هر قسمت از بدن میتوانند به سرطان تبدیل شوند و سپس به سایر قسمتهای بدن گسترش یابند.
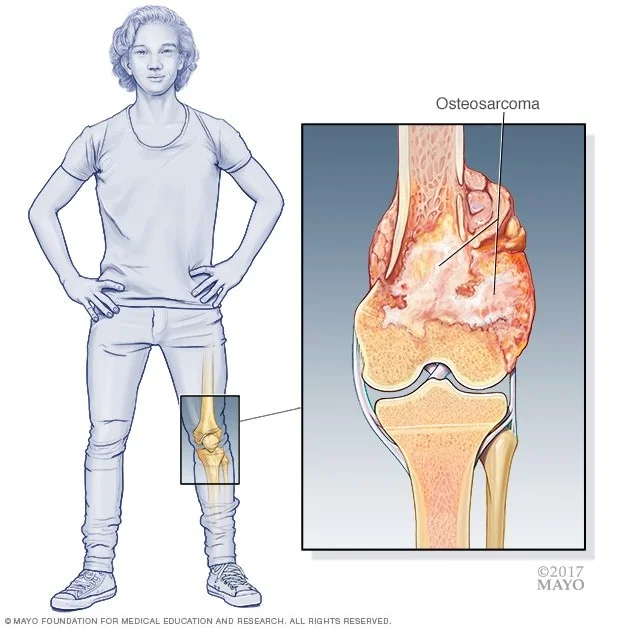
استئوسارکوم (که به آن سارکوم استخوانی نیز میگویند) شایع ترین نوع سرطان است که از استخوانها شروع میشود. سلولهای سرطانی در این تومورها شبیه اشکال اولیه سلولهای استخوانی هستند که به طور معمول به ساخت بافت استخوانی جدید کمک میکنند اما بافت استخوانی در استئوسارکوم به اندازه استخوانهای طبیعی قوی نیست.
بیشتر استئوسارکومها در کودکان، نوجوانان و جوانان رخ میدهند. نوجوانان شایع ترین گروه سنی مبتلا هستند اما استئوسارکوم میتواند در هر سنی ایجاد شود.
استئوسارکوم از کجا شروع میشود؟
در کودکان، نوجوانان و بزرگسالان جوان، استئوسارکوم معمولاً در مناطقی شروع میشود که استخوان به سرعت در حال رشد است، مانند نزدیک انتهای استخوانهای پا یا بازو:
- اکثر تومورها در استخوانهای اطراف زانو یا در قسمت تحتانی استخوان ران (دیستال فمور یا distal femur) یا قسمت فوقانی استخوان ساق پا (درشت نی پروگزیمال یا proximal tibia) ایجاد میشوند.
- استخوان بازو نزدیک به شانه (پروگزیمال هومروس یا proximal humerus) شایع ترین محل بعدی است.
با این حال، استئوسارکوم میتواند در هر استخوانی، از جمله استخوانهای لگن (hips)، شانه، و فک ایجاد شود. این امر به ویژه در افراد مسن صادق است.
زیر شاخههای استئوسارکوم
بر اساس اینکه سلولهای سرطانی زیر میکروسکوپ چگونه به نظر میرسند، استئوسارکومها را میتوان به درجه بالا، درجه متوسط یا درجه پایین طبقه بندی کرد. درجه تومور به پزشکان میگوید که چقدر احتمال دارد سرطان به سرعت رشد کرده و به سایر قسمتهای بدن گسترش یابد.
استئوسارکومهای درجه بالا (High-grade osteosarcomas)
اینها سریع ترین انواع استئوسارکوم در حال رشد هستند. وقتی با میکروسکوپ دیده میشوند، شبیه استخوان طبیعی نیستند و بسیاری از سلولهای سرطانی در حال تقسیم شدن به سلولهای جدید هستند. اکثر استئوسارکومهایی که در کودکان و نوجوانان رخ میدهد درجه بالایی دارند. انواع بسیاری از استئوسارکومهای با درجه بالا وجود دارد (اگرچه 3 مورد اول شایع ترین هستند).
- استئوبلاستیک (Osteoblastic)
- کندروبلاستیک (Chondroblastic)
- فیبروبلاستیک (Fibroblastic)
- سلول کوچک (Small cell)
- تلانژکتاتیک (Telangiectatic)
- سطح با درجه بالا (juxtacortical high grade)
سایر استئوسارکومهای درجه بالا عبارتند از:
- Pagetoid: توموری که در فرد مبتلا به بیماری استخوانی پاژه (Paget disease of the bone) ایجاد میشود.
- خارج اسکلتی (Extraskeletal): توموری که در قسمتی از بدن به غیر از استخوان شروع میشود (اما همچنان بافت استخوانی میسازد).
- پس از تابش (Post-radiation): توموری که در استخوانی شروع میشود که زمانی در معرض تشعشع قرار گرفته است.
استئوسارکوم درجه متوسط (Intermediate-grade osteosarcomas)
این تومورهای غیر معمول بین استئوسارکومهای درجه بالا و درجه پایین قرار میگیرند. (آنها معمولاً مانند استئوسارکومهای درجه پایین درمان میشوند.)
- پریوستال (juxtacortical intermediate grade یا Periosteal)
استئوسارکومهای درجه پایین (Low-grade osteosarcomas)
این استئوسارکومها دارای کند ترین رشد هستند. تومورها بیشتر شبیه استخوان طبیعی هستند و وقتی با میکروسکوپ دیده میشوند سلولهای تقسیم شونده کمی دارند.
- پاروستئال (juxtacortical low grade یا Parosteal)
- داخل مدولری یا داخل استخوانی با تمایز خوب (low-grade central)
درجه تومور در تعیین مرحله آن و نوع درمان مورد استفاده نقش دارد. برای اطلاعات بیشتر در مورد مرحله بندی، مبحث مراحل استئوسارکوم را ببینید.
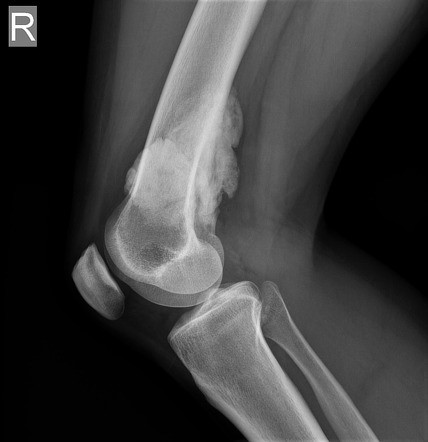
انواع دیگر تومورهای استخوانی
چندین نوع دیگر از تومورها میتوانند در استخوانها شروع شوند.
تومورهای بدخیم (سرطانی) استخوان
تومورهای یوینگ (Ewing sarcomas) دومین سرطان شایع استخوان در کودکان هستند. آنها در مطلب خانواده تومورهای Ewing توضیح داده شده اند.
اکثر انواع دیگر سرطانهای استخوان معمولا در بزرگسالان یافت میشوند و در کودکان غیر معمول هستند. اینها شامل:
- کندروسارکوم یا Chondrosarcoma (سرطانی که از غضروف ایجاد میشود)
- سارکوم پلئومورفیک تمایز نیافته (Undifferentiated pleomorphic sarcoma یا UPS) استخوان که قبلا به عنوان هیستیوسیتوم فیبروز بدخیم (malignant fibrous histiocytoma یا MFH) استخوان شناخته میشد.
- فیبروسارکوم استخوان (Fibrosarcoma of bone)
- چوردوما (Chordoma)
- تومور بدخیم سلول غول پیکر استخوان (Malignant giant cell tumor of bone)
برای اطلاعات بیشتر در مورد این سرطانها، سرطان استخوان در بزرگسالان را ببینید.
بسیاری از انواع سرطان که در سایر اندامهای بدن شروع میشوند، به ویژه سرطان در بزرگسالان، میتوانند به استخوانها سرایت کنند. گاهی اوقات به اینها سرطانهای متاستاتیک استخوان (metastatic bone cancers) گفته میشود اما سرطان استخوان واقعی نیستند. به عنوان مثال، سرطان پروستات که به استخوانها گسترش مییابد، همچنان سرطان پروستات است و مانند سرطان پروستات درمان میشود.
تومورهای خوش خیم (غیر سرطانی) استخوان
همه تومورهای استخوانی سرطانی نیستند. تومورهای خوش خیم استخوان به سایر قسمتهای بدن گسترش نمییابند. آنها معمولاً تهدید کننده زندگی نیستند و جراحی اغلب میتواند آنها را کاملاً از بین ببرد. انواع مختلفی از تومورهای خوش خیم استخوان وجود دارد، از جمله:
- استئوما (Osteoma)
- کندروما (Chondroma)
- استئوکندروما (Osteochondroma)
- گرانولوم ائوزینوفیلیک استخوان (Eosinophilic granuloma of bone)
- فیبروم غیر استخوانی (Non-ossifying fibroma)
- انکوندروما (Enchondroma)
- تومور خوش خیم سلول غول پیکر استخوان (Benign giant cell tumor of bone)
- لنفانژیوم (Lymphangioma)
آمار کلیدی برای استئوسارکوم
استئوسارکوم سرطان شایعی نیست. هر سال حدود 1000 مورد جدید استئوسارکوم در ایالات متحده تشخیص داده میشود. حدود نیمی از این موارد در کودکان و نوجوانان است.
بیشتر استئوسارکومها در کودکان، نوجوانان و جوانان بین 10 تا 30 سال رخ میدهد.
نوجوانان شایع ترین گروه سنی مبتلا هستند اما افراد در هر سنی ممکن است به استئوسارکوم مبتلا شوند. حدود 1 مورد از هر 10 مورد استئوسارکوم در افراد مسن تر از 60 سال رخ میدهد.
حدود 2 درصد از سرطانهای دوران کودکی، استئوسارکوم هستند اما درصد بسیار کمتری از سرطانهای بزرگسالان را تشکیل میدهند.
پیش آگهی (چشم انداز) برای افراد مبتلا به استئوسارکوم به عوامل بسیاری بستگی دارد، از جمله اینکه تومور کجاست، اگر سرطان قبلاً در ابتدا گسترش یافته باشد (متاستاز) و سن فرد. برای اطلاعات بیشتر در این مورد، به مبحث نرخ بقا برای استئوسارکوم مراجعه کنید.
علائم و نشانههای استئوسارکوم
استئوسارکوم معمولاً به دلیل علائمی که ایجاد میکند، پیدا میشود.
درد و تورم استخوان
درد در محل تومور در استخوان شایع ترین علامت استئوسارکوم است. شایع ترین محل برای این تومورها در افراد جوان تر در اطراف زانو یا در بالای بازو است اما میتواند در استخوانهای دیگر نیز رخ دهد. در ابتدا ممکن است درد ثابت نباشد و در شب بدتر شود. درد اغلب با فعالیت افزایش مییابد و اگر تومور در استخوان ساق پا باشد، ممکن است منجر به لنگی شود.
تورم در ناحیه یکی دیگر از علائم رایج است، اگرچه ممکن است تا بعدها رخ ندهد. بسته به محل تومور، ممکن است یک توده یا تورم احساس شود.
درد و تورم اندام در کودکان و نوجوانان عادی و فعال بسیار شایع است. اینها به احتمال زیاد ناشی از برآمدگیها و کبودیهای معمولی هستند، بنابراین ممکن است فوراً به پزشک مراجعه نکنند. این میتواند تشخیص را به تاخیر بیندازد. اگر کودک شما این علائم را دارد که در عرض چند هفته از بین نمیروند (یا بدتر میشوند)، به پزشک مراجعه کنید تا در صورت نیاز بتوان علت را پیدا کرده و آن را درمان کرد.
این علائم در بزرگسالان کمتر دیده میشود، بنابراین باید نشانه ای برای مراجعه زودتر به پزشک باشد.
شکستگی استخوان
اگرچه استئوسارکوم ممکن است استخوانی را که در آن رشد میکند ضعیف کند، شکستگی (شکستگی) شایع نیست. استثناها، استئوسارکومهای تلانژکتاتیک نادر هستند که بیشتر از سایر اشکال استئوسارکوم باعث ضعیف شدن استخوانها شده و به احتمال زیاد باعث شکستگی در محل تومور میشوند.
افراد مبتلا به شکستگی در کنار یا در ناحیه مبتلا به استئوسارکوم، اغلب اندامی را توصیف میکنند که برای چند ماه درد داشت و به طور ناگهانی هنگام شکستگی بسیار دردناک شد.
چه چیزی باعث استئوسارکوم میشود؟
محققان دریافته اند که استئوسارکوم با تعدادی از شرایط دیگر مرتبط است که در مبحث عوامل خطرزا استئوسارکوم توضیح داده شده است اما علت بیشتر استئوسارکومها در حال حاضر مشخص نیست.
دانشمندان دریافته اند که چگونه تغییرات خاصی در DNA سلولهای استخوانی میتواند باعث سرطانی شدن آنها شود. DNA ماده شیمیایی موجود در سلولهای ما است که ژنهای ما را میسازد که عملکرد سلولهای ما را کنترل میکند. ما معمولا شبیه والدین خود هستیم زیرا آنها منبع DNA ما هستند اما DNA بر چیزی بیشتر از ظاهر ما تأثیر میگذارد. این خطرات ما را برای ابتلا به برخی بیماریها، از جمله برخی از انواع سرطان، تحت تاثیر قرار میدهد.
برخی از ژنها زمان رشد سلولهای ما، تقسیم برای ساختن سلولهای جدید و مرگ را کنترل میکنند:
- ژنهایی که به رشد، تقسیم یا زنده ماندن سلولها کمک میکنند، انکوژن (oncogenes) نامیده میشوند.
- ژنهایی که به کنترل تقسیم سلولی، ترمیم اشتباهات در DNA یا مرگ سلولها در زمان مناسب کمک میکنند، ژنهای سرکوبگر تومور (tumor suppressor genes) نامیده میشوند.
سرطانها میتوانند ناشی از تغییرات ژنی باشند که انکوژنها را روشن نگه میدارد یا ژنهای سرکوب کننده تومور را خاموش میکند.
برخی از افراد جهشهای ژنی (تغییرات) را از والدین به ارث میبرند که خطر ابتلا به سرطان را در آنها افزایش میدهد. در این شرایط، همه سلولهای بدن حامل تغییرات ژنی یکسانی هستند. به اینها جهشهای ژرملاین (germline) یا ارثی (inherited) میگویند. اما اغلب، تغییرات ایجاد کننده سرطان در طول زندگی به دست میآیند تا قبل از تولد به ارث برسند. در این حالت، این تغییر تنها در سلولهایی رخ میدهد که به سرطان تبدیل میشوند. این تغییرات ژنی سوماتیک (somatic) یا اکتسابی (acquired) نامیده میشود.
تغییرات ژنی ارثی
برخی از جهشهای ارثی DNA منجر به سندرمهایی میشوند که با افزایش خطر استئوسارکوم مرتبط هستند. مثلا:
- سندرم Li-Fraumeni معمولاً توسط جهشهای ارثی ایجاد میشود که ژن سرکوبگر تومور TP53 را خاموش میکند. این جهشها خطر ابتلا به یک یا چند نوع سرطان از جمله سرطان سینه، تومورهای مغزی و استئوسارکوم را در فرد ایجاد میکند.
- تغییرات ارثی در ژن سرکوبگر تومور رتینوبلاستوما (RB1) خطر ابتلا به رتینوبلاستوما (retinoblastoma) را افزایش میدهد که نوعی سرطان چشم است که کودکان را تحت تاثیر قرار میدهد. کودکانی که این تغییر ژنی را دارند نیز خطر ابتلا به استئوسارکوم را افزایش میدهند، به خصوص اگر تحت درمان با پرتو درمانی قرار گیرند.

اگر نگران هستید که ممکن است شما یا فرزندتان تغییر ژنی ارثی داشته باشید، با پزشک خود در مورد اینکه آیا آزمایش ژنتیکی ممکن است مفید باشد، صحبت کنید.
تغییرات ژنی اکتسابی
بیشتر استئوسارکومها به دلیل جهشهای ژنی ارثی ایجاد نمیشوند، بلکه نتیجه تغییرات ژنی هستند که در طول زندگی فرد به دست میآیند.
گاهی اوقات این تغییرات ژنی ناشی از پرتو درمانی است که برای درمان شکل دیگری از سرطان استفاده میشود زیرا پرتو میتواند به DNA داخل سلولها آسیب برساند اما بسیاری از تغییرات ژنی احتمالاً فقط رویدادهای تصادفی هستند که گاهی اوقات در داخل سلول اتفاق میافتند، بدون اینکه علت خارجی داشته باشند.
سلولهایی که به سرعت تقسیم میشوند، با احتمال بیشتری سلولهای جدید با اشتباه در DNA خود ایجاد میکنند که خطر ابتلا به سرطانی مانند استئوسارکوم را افزایش میدهد. ممکن است به همین دلیل باشد که برخی از موقعیتهای طبیعی (مانند جهش رشد در نوجوانی) و برخی بیماریها (مانند بیماری پاژه استخوان) که باعث رشد سریع استخوان میشوند، خطر ابتلا به استئوسارکوم را افزایش میدهند.
به غیر از تشعشع یا پرتو درمانی، هیچ دلیل شناخته شده ای برای استئوسارکوم مرتبط با سبک زندگی یا محیطی وجود ندارد، بنابراین مهم است که به خاطر داشته باشید که در بیشتر موارد افراد مبتلا به این سرطانها نمیتوانستند کاری برای پیشگیری از آنها انجام دهند.
اکنون محققان برخی از تغییرات ژنی که در استئوسارکوم رخ میدهند را درک میکنند اما همیشه مشخص نیست که چه چیزی باعث این تغییرات میشود. همان طور که بیشتر در مورد علل استئوسارکوم یاد میگیریم، امیدواریم بتوانیم از این دانش برای ایجاد راههایی برای پیشگیری و درمان بهتر آن استفاده کنیم.
عوامل خطرزا استئوسارکوم
عامل خطرزا هر چیزی است که شانس ابتلا به بیماری مانند سرطان را افزایش دهد. سرطانهای مختلف عوامل خطرزا متفاوتی دارند.
عوامل خطرزا مرتبط با سبک زندگی مانند وزن بدن، فعالیت بدنی، رژیم غذایی و مصرف دخانیات نقش عمده ای در بسیاری از سرطانهای بزرگسالان دارند اما این عوامل معمولاً سالها طول میکشد تا بر خطر سرطان تأثیر بگذارند و تصور نمیشود که نقش زیادی در سرطانهایی که در کودکان شایع تر هستند، از جمله استئوسارکوم دوران کودکی ایفا کنند. تاکنون، عوامل مرتبط با سبک زندگی با استئوسارکوم در بزرگسالان نیز مرتبط نبوده است. با این حال، عواملی وجود دارند که بر خطر استئوسارکوم تأثیر میگذارند.
سن
خطر ابتلا به استئوسارکوم برای افراد بین 10 تا 30 سال، به ویژه در دوران جهش رشد نوجوانان، بالاترین میزان است. این نشان میدهد که ممکن است بین رشد سریع استخوان و خطر تشکیل تومور ارتباط وجود داشته باشد. این خطر در میانسالی کاهش مییابد اما در افراد مسن (معمولا بالای 60 سال) دوباره افزایش مییابد. استئوسارکوم در افراد مسن اغلب به علت دیگری مانند بیماری استخوانی طولانی مدت مرتبط است (به مباحث زیر مراجعه کنید).
قد
کودکان مبتلا به استئوسارکوم معمولاً نسبت به سن خود قد بلندی دارند. این همچنین نشان میدهد که استئوسارکوم ممکن است با رشد سریع استخوان مرتبط باشد.
جنسیت
استئوسارکوم در مردان بیشتر از زنان است. زنان تمایل دارند کمی زودتر به آن مبتلا شوند، احتمالاً به این دلیل که تمایل دارند رشدشان زودتر جهش کند.
نژاد یا قومیت
در ایالات متحده، استئوسارکوم در کودکان آفریقایی آمریکایی، اسپانیایی تبارها و لاتین تبارها کمی بیشتر از کودکان سفید پوست است.
تابش یا پرتو درمانی به استخوان
به نظر میرسد افرادی که برای سرطان دیگری تحت پرتو درمانی قرار گرفته اند، در معرض خطر بیشتری برای ابتلا به استئوسارکوم در ناحیه ای هستند که در معرض اشعه قرار گرفته است. درمان در سنین پایین تر و درمان با دوزهای بالاتر پرتو هر دو این خطر را افزایش میدهند.
مشخص نیست که آیا تستهای تصویر برداری که از پرتوها استفاده میکنند، مانند اشعه ایکس، سی تی اسکن و اسکن پزشکی هسته ای (مانند اسکن PET یا اسکن استخوان)، خطر ابتلا به استئوسارکوم را افزایش میدهند یا خیر. میزان پرتوهای مورد استفاده برای این آزمایشها چندین برابر کمتر از پرتو درمانی است. اگر خطر افزایشی وجود داشته باشد، احتمالاً بسیار ناچیز است اما پزشکان سعی میکنند تا حد امکان استفاده از این نوع آزمایشها را محدود کنند، مخصوصاً در کودکان.
برخی بیماریهای استخوانی
خطر ابتلا به استئوسارکوم در افراد مبتلا به برخی بیماریهای غیر سرطانی استخوان افزایش مییابد.
بیماری استخوان پاژه (Paget disease of the bone): در این وضعیت، بافت استخوانی غیر طبیعی در یک یا چند استخوان تشکیل میشود. این بیماری بیشتر افراد بالای 50 سال را مبتلا میکند. استخوانهای آسیب دیده سنگین و ضخیم هستند اما ضعیف تر از استخوانهای معمولی هستند و احتمال شکستگی آنها بیشتر است. معمولاً این وضعیت به خودی خود تهدید کننده زندگی نیست اما سارکومهای استخوانی (بیشتر استئوسارکومها) در حدود 1 درصد از افراد مبتلا به بیماری پاژه، معمولاً زمانی که بسیاری از استخوانها تحت تأثیر قرار میگیرند، ایجاد میشود.
استئوکندرومهای متعدد ارثی (Hereditary multiple osteochondromas): استئوکندرومها تومورهای خوش خیمی هستند که از استخوان و غضروف تشکیل شده اند. هر استئوکندروم خطر بسیار کمی برای تبدیل شدن به سارکوم استخوانی دارد (اغلب کندروسارکوم اما کمتر اوقات میتواند استئوسارکوم باشد).
اکثر استئوکندرومها را میتوان به طور کامل با جراحی از بین برد. با این حال، برخی از افراد تمایل به ایجاد بسیاری از استئوکندرومها را از زمان جوانی به ارث میبرند و ممکن است حذف همه آنها ممکن نباشد. هر چه فرد مبتلا به استئوکندروم بیشتری باشد، خطر ابتلا به سارکوم استخوان بیشتر میشود.
دیسپلازی فیبری (Fibrous dysplasia): این یک وضعیت غیر معمول است که در آن سلولها در قسمت خاصی از استخوان بافت فیبری (اسکار مانند) زیادی ایجاد میکنند که جایگزین استخوان طبیعی در آن ناحیه میشود. در برخی افراد این تنها در یک استخوان اتفاق میافتد، در حالی که در برخی دیگر بیش از یک استخوان را تحت تاثیر قرار میدهد. گاهی اوقات به عنوان بخشی از بیماری به نام سندرم مک کان-آلبرایت (McCune-Albright syndrome) دیده میشود. یک خطر کوچک وجود دارد که هر ناحیه از دیسپلازی فیبری به یک استئوسارکوم تبدیل شود.
سندرمهای سرطانی ارثی
افراد مبتلا به برخی از سندرمهای سرطانی نادر و ارثی، خطر ابتلا به استئوسارکوم را افزایش میدهند.
- رتینوبلاستوما (Retinoblastoma) یک سرطان نادر چشم در کودکان است.
برخی از کودکان دارای فرم ارثی رتینوبلاستوما (رتینوبلاستومای ارثی) هستند که در آن تمام سلولهای بدن دارای جهش (تغییر) در ژن RB1 هستند. این کودکان همچنین در معرض افزایش خطر ابتلا به سارکوم استخوان یا بافت نرم، از جمله استئوسارکوم هستند. اگر از پرتو درمانی برای درمان رتینوبلاستوما استفاده شود، خطر استئوسارکوم در استخوانهای اطراف چشم حتی بیشتر میشود.
- افراد مبتلا به سندرم Li-Fraumeni بسیار بیشتر در معرض ابتلا به انواع خاصی از سرطان از جمله سرطان سینه، تومورهای مغزی، استئوسارکوم و سایر انواع سارکوم هستند. این سندرم معمولاً در اثر جهش ژن TP53 ایجاد میشود.
- کودکان مبتلا به سندرم روتموند تامسون (Rothmund-Thomson syndrome) معمولاً کوتاه قد هستند و مشکلات پوستی و اسکلتی دارند. همچنین احتمال ابتلا به استئوسارکوم در آنها بیشتر است. این سندرم معمولاً به دلیل تغییرات غیر طبیعی در ژن REQL4 ایجاد میشود.
سایر شرایط ارثی نادر، از جمله سندرم بلوم (Bloom syndrome)، سندرم ورنر (Werner syndrome) و کم خونی دیاموند بلک فن (Diamond-Blackfan anemia) نیز با افزایش خطر ابتلا به استئوسارکوم مرتبط است.
روشی که تغییرات ژنی ارثی بواسطه آنها باعث میشوند برخی افراد بیشتر به استئوسارکوم مبتلا شوند، در مبحث چه چیزی باعث استئوسارکوم میشود، بحث شده است.
آیا میتوان استئوسارکوم را زود تشخیص داد؟
در حال حاضر، هیچ آزمایش غربالگری به طور گسترده برای استئوسارکوم در افرادی که مشخص نیست در معرض خطر هستند، وجود ندارد. (غربالگری آزمایش بررسی سرطان در افراد بدون هیچ علامتی است.)
با این حال، بیشتر استئوسارکومها در مراحل اولیه، قبل از اینکه به وضوح به سایر قسمتهای بدن گسترش یابند، پیدا میشوند. علائمی مانند درد استخوان یا تورم اغلب باعث مراجعه به پزشک میشود. (برای اطلاعات بیشتر در این مورد، به مبحث علائم و نشانههای استئوسارکوم مراجعه کنید.)
برای افرادی که در معرض خطر ابتلا به استئوسارکوم هستند
برای برخی از افرادی که به دلیل ابتلا به بیماریهای استخوانی خاص یا شرایط ارثی (موجود در فهرست عوامل خطرزا استئوسارکوم) در معرض خطر ابتلا به استئوسارکوم هستند، پزشکان ممکن است نظارت بیشتری را برای این بیماری توصیه کنند. این نوع سرطان معمولاً در خانوادهها دیده نمیشود اما برای درمان موفقیت آمیز، مراقبت از علائم و نشانههای اولیه مهم است.
آزمایشات استئوسارکوم
استئوسارکوم معمولاً به این دلیل است که فرد دارای نشانه یا علائمی است که باعث مراجعه به پزشک میشود. در صورت مشکوک بودن به تومور استخوانی، معاینات و آزمایشاتی برای تشخیص قطعی مورد نیاز است.
اگر استئوسارکوم پیدا شود، آزمایشهای دیگری برای کسب اطلاعات بیشتر در مورد آن انجام میشود.
سابقه پزشکی و معاینه فیزیکی
اگر فردی علائم یا نشانههایی داشته باشد که نشان میدهد ممکن است تومور در استخوان یا اطراف آن وجود داشته باشد، پزشک یک تاریخچه پزشکی کامل میگیرد تا در مورد علائم بیشتر بداند.
یک معاینه فیزیکی اغلب میتواند اطلاعاتی در مورد یک تومور احتمالی ارائه دهد. برای مثال، پزشک ممکن است بتواند یک توده یا تورم غیر طبیعی را ببیند یا احساس کند.
پزشک همچنین ممکن است به دنبال مشکلات در سایر قسمتهای بدن باشد. وقتی افراد (به ویژه بزرگسالان) در استخوانها سرطان دارند، اغلب نتیجه سرطانی است که از جای دیگری شروع شده و سپس به استخوانها سرایت میکند.
اگر پزشک مشکوک به استئوسارکوم (یا نوع دیگری از تومور استخوانی) باشد، آزمایشهای بیشتری انجام خواهد شد. اینها ممکن است شامل آزمایشهای تصویر برداری، بیوپسی و یا تستهای آزمایشگاهی باشد.
تستهای تصویر برداری
در آزمایشهای تصویر برداری از اشعه ایکس، میدانهای مغناطیسی یا مواد رادیواکتیو برای ایجاد تصاویری از داخل بدن استفاده میشود. آزمایشهای تصویر برداری ممکن است به دلایلی انجام شود، از جمله:
- برای کمک به یافتن اینکه آیا یک ناحیه مشکوک ممکن است سرطانی باشد یا خیر.
- برای کمک به تعیین اینکه آیا ممکن است سرطان در قسمت دیگری از بدن شروع شده باشد یا خیر.
- برای فهم میزان گسترش سرطان
- برای کمک به تعیین اینکه آیا روند درمان موثر است یا خیر.
- برای جستجوی علائمی مبنی بر بازگشت سرطان
افرادی که استئوسارکوم دارند یا ممکن است داشته باشند، یک یا چند مورد از این آزمایشها را انجام خواهند داد.
اشعه ایکس استخوان (Bone x-ray)
این اغلب اولین آزمایشی است که در صورت مشکوک بودن به تومور استخوانی انجام میشود. پزشکان اغلب میتوانند تومور استخوانی مانند استئوسارکوم را بر اساس عکس برداری ساده از استخوان تشخیص دهند اما ممکن است آزمایشهای تصویر برداری دیگری نیز مورد نیاز باشد.
حتی اگر نتایج عکس برداری با اشعه ایکس به شدت حاکی از ابتلای فرد به استئوسارکوم باشد، بیوپسی (که در زیر توضیح داده شده است) برای تأیید سرطان بودن آن به جای یک مشکل دیگر، مانند عفونت، مورد نیاز است.
اسکن تصویر برداری رزونانس مغناطیسی (MRI یا Magnetic resonance imaging)
MRI با استفاده از امواج رادیویی و آهنرباهای قوی به جای اشعه ایکس، تصاویر دقیقی از بافتهای نرم بدن ایجاد میکند، بنابراین هیچ تشعشعی در کار نیست. ماده حاجب به نام گادولینیوم (gadolinium) اغلب قبل از اسکن به داخل ورید تزریق میشود تا جزئیات را بهتر ببینند.
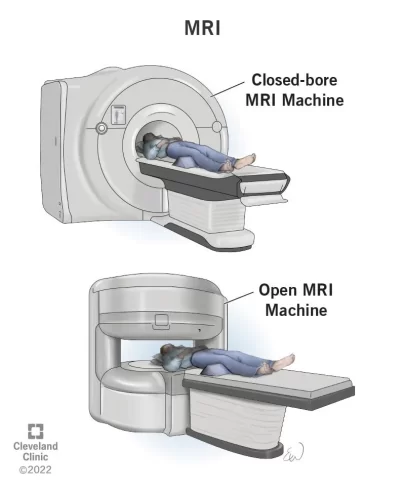
MRI اغلب برای مشاهده دقیق تر توده استخوانی که در عکس اشعه ایکس دیده میشود انجام میشود. MRI معمولاً میتواند نشان دهد که توده احتمالاً تومور، عفونت یا نوعی آسیب استخوانی ناشی از علت دیگری است.
MRI همچنین میتواند به تعیین وسعت دقیق تومور کمک کند زیرا میتواند مغز استخوان را در داخل استخوانها و بافتهای نرم اطراف تومور، از جمله رگهای خونی و اعصاب مجاور را نشان دهد.
MRI همچنین میتواند تومورهای استخوانی کوچک را در چند اینچ دورتر از تومور اصلی (به نام متاستاز پرشی یا skip metastases) نشان دهد. دانستن وسعت استئوسارکوم هنگام برنامه ریزی برای جراحی بسیار مهم است. اسکن MRI معمولا جزئیات بهتری را نسبت به سی تی اسکن نشان میدهد (در زیر توضیح داده شده است).
اسکن توموگرافی کامپیوتری (Computed tomography یا CT)
سی تی اسکن بسیاری از تصاویر اشعه ایکس را ترکیب میکند تا تصاویر مقطعی دقیقی از قسمتهایی از بدن ایجاد کند. اگر اشعه ایکس تومور استخوانی را نشان دهد، گاهی اوقات از سی تی اسکن برای مشاهده اینکه آیا تومور به عضله، چربی یا تاندون نزدیک رشد کرده است، استفاده میشود، اگرچه MRI اغلب برای این کار بهتر است.
سی تی اسکن از قفسه سینه اغلب برای بررسی گسترش سرطان به ریهها انجام میشود. سی تی اسکن همچنین ممکن است برای بررسی گسترش سرطان به سایر قسمتهای بدن انجام شود.
اشعه ایکس قفسه سینه (Chest x-ray)
این آزمایش گاهی اوقات برای بررسی اینکه آیا استئوسارکوم به ریهها گسترش یافته است، انجام میشود. میتواند تومورهای بزرگتر را پیدا کند اما به خوبی سی تی اسکن برای تشخیص تومورهای کوچکتر نیست. اگر سی تی اسکن از قفسه سینه انجام شود، احتمالاً نیازی به اشعه ایکس قفسه سینه نخواهد بود.
اسکن استخوان (Bone scan)
اسکن استخوان میتواند نشان دهد که آیا سرطان به استخوانهای دیگر گسترش یافته است یا خیر و اغلب بخشی از کار برای افراد مبتلا به استئوسارکوم است. این تست به این دلیل مفید است که میتواند کل اسکلت را به یکباره نشان دهد. (اسکن توموگرافی گسیل پوزیترون [PET] که در زیر توضیح داده شده است، اغلب میتواند اطلاعات مشابهی را ارائه دهد، بنابراین اگر اسکن PET انجام شود، ممکن است اسکن استخوان مورد نیاز نباشد.)
برای این آزمایش، مقدار کمی از مواد رادیواکتیو با سطح پایین به خون تزریق میشود و به استخوانها میرود. یک دوربین ویژه که میتواند رادیواکتیویته را تشخیص دهد، تصویری از اسکلت ایجاد میکند.
نواحی تغییرات استخوانی فعال، رادیواکتیویته را جذب کرده و به صورت “نقاط داغ یا hot spots” روی اسکلت ظاهر میشوند. نقاط داغ ممکن است مناطقی از سرطان را نشان دهند اما سایر بیماریهای استخوانی نیز میتوانند همین الگو را ایجاد کنند. برای تشخیص دقیق، آزمایشهای دیگری مانند عکس برداری با اشعه ایکس ساده، اسکن MRI یا حتی بیوپسی استخوان ممکن است مورد نیاز باشد.
اسکن توموگرافی گسیل پوزیترون (PET یا Positron emission tomography)
برای اسکن PET، نوعی قند رادیواکتیو (معروف به FDG) به خون تزریق میشود. از آن جایی که سلولهای سرطانی در بدن به سرعت در حال رشد هستند، مقادیر زیادی قند را جذب میکنند. سپس یک دوربین مخصوص میتواند تصویری از مناطق پرتوزا در بدن ایجاد کند. تصویر مانند سی تی اسکن یا ام آر آی جزئیات ندارد اما اطلاعات مفیدی در مورد کل بدن ارائه میدهد.
اسکن PET میتواند به نشان دادن گسترش استئوسارکوم به ریهها، استخوانهای دیگر یا سایر قسمتهای بدن کمک کند. همچنین میتوان از آنها برای مشاهده اینکه سرطان چقدر به درمان پاسخ میدهد نیز استفاده کرد.
بسیاری از ماشینها میتوانند همزمان PET و CT اسکن (PET/CT scan) انجام دهند. این به پزشک اجازه میدهد مناطق با رادیواکتیویته بالاتر در اسکن PET را با ظاهر دقیقتر آن ناحیه در سی تی اسکن مقایسه کند.
بیوپسی یا نمونه برداری (Biopsy)
نتایج آزمایشهای تصویر برداری ممکن است قویاً نشان دهد که فرد مبتلا به استئوسارکوم (یا نوع دیگری از سرطان استخوان) است اما بیوپسی (برداشتن مقداری از تومور برای مشاهده زیر میکروسکوپ و سایر تستهای آزمایشگاهی) تنها راه برای اطمینان است.
اگر تومور در استخوان باشد، بسیار مهم است که بیوپسی توسط پزشکان مجرب در درمان تومورهای استخوانی انجام شود. در صورت امکان، بیوپسی و درمان جراحی باید با هم برنامه ریزی شوند و همان پزشکان باید هر دو را انجام دهند. برنامه ریزی مناسب بیوپسی میتواند به جلوگیری از عوارض بعدی کمک کند و ممکن است میزان جراحی مورد نیاز را کاهش دهد.
دو نوع اصلی بیوپسی را میتوان برای تومورهای استخوانی استفاده کرد.
بیوپسی با سوزن مرکزی (Core needle biopsy)
برای این بیوپسیها، پزشک از یک سوزن توخالی برای برداشتن استوانه کوچکی از بافت از تومور استفاده میکند. نمونه برداری معمولاً با بی حسی موضعی انجام میشود، جایی که داروی بی حس کننده به پوست و سایر بافتها روی محل بیوپسی تزریق میشود. در برخی موارد ممکن است به آرام بخش یا بیهوشی عمومی (حالتی که بیمار در خواب است) نیاز باشد.
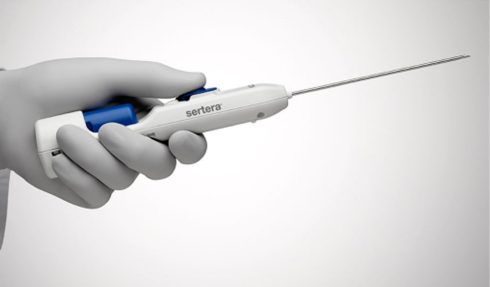
اغلب، پزشک میتواند سوزن را با لمس ناحیه مشکوک در صورتی که نزدیک سطح بدن باشد نشانه بگیرد. اگر تومور به دلیل عمیق بودن بیش از حد قابل لمس نباشد، پزشک میتواند با استفاده از یک آزمایش تصویر برداری مانند سی تی اسکن، سوزن را به داخل تومور هدایت کند. این بیوپسی سوزنی با هدایت CT معمولاً توسط پزشکی که یک رادیولوژیست نیز هست، انجام میشود.
بیوپسی جراحی یا باز (Surgical biopsy)
در یک بیوپسی باز، یک پزشک (معمولا یک جراح ارتوپد) پوست را برش داده، تومور را در معرض دید قرار داده و سپس تکه ای از آن را برش میدهد. این بیوپسیها معمولاً در اتاق عمل با بیماری که تحت بیهوشی عمومی (در خواب عمیق) است، انجام میشود. آنها همچنین میتوانند با استفاده از یک بلوک عصبی که ناحیه بزرگی از بدن را بی حس میکند، انجام شود.
باز هم، مهم است که بیوپسی توسط متخصص تومورهای استخوانی انجام شود، در غیر این صورت ممکن است بعداً به مشکلاتی منجر شود. به عنوان مثال، اگر تومور روی بازو یا پا باشد و بیوپسی به درستی انجام نشود، ممکن است شانس نجات اندام را کاهش دهد. در صورت امکان، برش برای بیوپسی باید از طول و در امتداد بازو یا پا باشد زیرا این روشی است که برش در طول عمل برای برداشتن سرطان ایجاد میشود.
کل اسکار بیوپسی اصلی نیز باید برداشته شود، بنابراین ایجاد برش بیوپسی به این روش، مقدار بافتی را که باید بعداً برداشته شود، کاهش میدهد.
تستهای آزمایشگاهی
آزمایش نمونههای بیوپسی
تمام نمونههای برداشته شده توسط بیوپسی به پاتولوژیست (پزشک متخصص در تستهای آزمایشگاهی) فرستاده میشود تا با میکروسکوپ بررسی شود. همچنین ممکن است آزمایشهایی برای یافتن تغییرات کروموزومی یا ژنی در سلولهای تومور انجام شود. این آزمایشها میتوانند به تشخیص استئوسارکوم از سایر سرطانهایی که در زیر میکروسکوپ شبیه آن هستند و گاهی اوقات میتوانند به پیش بینی احتمالی پاسخ استئوسارکوم به درمان کمک کنند.
اگر استئوسارکوم تشخیص داده شود، آسیب شناس به آن یک درجه میدهد که بر اساس ظاهر سلولهای تومور، اندازهگیری سرعت احتمالی رشد و گسترش سرطان است. سرطانهایی که تا حدودی شبیه بافت استخوانی طبیعی هستند با درجه پایین توصیف میشوند (و تمایل به رشد آهسته تری دارند)، در حالی که سرطانهایی که بسیار غیر طبیعی به نظر میرسند درجه بالا نامیده میشوند. برای اطلاعات بیشتر در مورد درجه بندی، مبحث مراحل استئوسارکوم را ببینید.
آزمایشات خون
آزمایش خون برای تشخیص استئوسارکوم لازم نیست اما ممکن است پس از تشخیص مفید باشد. به عنوان مثال، سطوح بالای مواد شیمیایی در خون مانند آلکالین فسفاتاز (alkaline phosphatase) و لاکتات دهیدروژناز (LDH یا lactate dehydrogenase) میتواند نشان دهد که استئوسارکوم ممکن است پیشرفته تر باشد.
آزمایشهای دیگری مانند شمارش سلولهای خون و آزمایشهای شیمیایی خون قبل از عمل جراحی و سایر درمانها انجام میشوند تا سلامت کلی فرد را به دست آورند. این آزمایشات همچنین برای نظارت بر سلامت افراد در حین شیمی درمانی استفاده میشوند.
مراحل استئوسارکوم
پس از اینکه فردی مبتلا به استئوسارکوم تشخیص داده شد، پزشکان سعی میکنند بفهمند که آیا بیماری گسترش یافته است یا خیر و اگر چنین است، این گسترش تا چه حد است. این فرآیند مرحله بندی (staging) نامیده میشود. مرحله توصیف میکند که چه مقدار سرطان در بدن وجود دارد. این به تعیین اینکه سرطان چقدر جدی است و بهترین روش درمان آن کمک میکند. پزشکان همچنین هنگام صحبت در مورد آمار بقا از مرحله سرطان استفاده میکنند.
مرحله استئوسارکوم بر اساس نتایج معاینات فیزیکی، آزمایشهای تصویر برداری و هر نمونه برداری انجام شده است که در تستهای استئوسارکوم توضیح داده شده است.
موضعی (Localized) در مقابل متاستاتیک (metastatic)
پزشکان از سیستمهای مرحله بندی رسمی استفاده میکنند (به مباحث زیر مراجعه کنید) تا میزان استئوسارکوم را با جزئیات توصیف کنند. (سیستم مرحله بندی روشی استاندارد برای توصیف وسعت سرطان است.) اما زمانی که سعی میشود تا بهترین درمان را کشف کنند، پزشکان اغلب از سیستم ساده تری استفاده میکنند که استئوسارکومها را به 2 گروه اصلی تقسیم میکند: موضعی و متاستاتیک.
استئوسارکوم موضعی (Localized osteosarcoma)
استئوسارکوم موضعی فقط در استخوانی که در آن شروع شده و احتمالاً بافتهای کنار استخوان مانند ماهیچه، تاندون یا چربی دیده میشود.
حدود 4 مورد از 5 مورد استئوسارکوم زمانی که برای اولین بار پیدا میشوند، موضعی به نظر میرسند اما حتی زمانی که آزمایشهای تصویر برداری نشان نمیدهند که سرطان به مناطق دور گسترش یافته است، احتمالاً مناطق بسیار کوچکی از گسترش سرطان وجود دارد که با آزمایشها قابل تشخیص نیستند. به همین دلیل است که شیمی درمانی بخش مهمی از درمان اکثر استئوسارکومها است. اگر این دارو داده نشود، احتمال عود سرطان پس از جراحی بیشتر است.
پزشکان بیشتر استئوسارکومهای موضعی را به 2 گروه تقسیم میکنند:
- استئوسارکومهای قابل برداشت (Resectable osteosarcomas) آنهایی هستند که در آنها میتوان تمام تومور قابل مشاهده را با جراحی برداشت (جدا کرد).
- استئوسارکومهای غیر قابل برداشت (unresectable یا Non-resectable) را نمیتوان به طور کامل با جراحی برداشت.
استئوسارکوم متاستاتیک (Metastatic osteosarcoma)
استئوسارکوم متاستاتیک به وضوح به سایر نقاط بدن گسترش یافته است. اغلب به ریهها سرایت میکند اما میتواند به استخوانهای دیگر، مغز یا سایر اندامها نیز سرایت کند.
از هر 5 استئوسارکوم، 1 مورد در اولین تشخیص گسترش یافته است. درمان این سرطانها سختتر است اما اگر متاستازها با جراحی برداشته شوند، میتوان برخی از آنها را درمان کرد. اگر شیمی درمانی نیز انجام شود، میزان درمان این سرطانها به طور قابل توجهی بهبود مییابد.
سیستم مرحله بندی انجمن تومور اسکلتی عضلانی (MSTS یا Musculoskeletal Tumor Society)
سیستمی که معمولا برای مرحله استئوسارکوم استفاده میشود، سیستم MSTS است که به نام سیستم Enneking نیز شناخته میشود. این بر اساس 3 اطلاعات کلیدی است:
- درجه (G) تومور که معیاری برای سنجش احتمال رشد و گسترش آن است، بر اساس اینکه چگونه زیر میکروسکوپ به نظر میرسد. تومورها یا درجه پایین (G1) یا درجه بالا (G2) هستند. سلولهای تومور درجه پایین بیشتر شبیه سلولهای طبیعی هستند و احتمال رشد و گسترش سریع کمتری دارند، در حالی که سلولهای تومور درجه بالا غیر طبیعی تر به نظر میرسند.
- وسعت تومور اولیه (T) که به عنوان intracompartmental (T1) طبقه بندی میشود، به این معنی که اساساً در داخل استخوان باقی مانده است یا extracompartmental (T2)، به این معنی که از استخوان به سایر ساختارهای مجاور گسترش یافته است.
- اگر تومور متاستاز داده باشد (M)، به این معنی که به نواحی دیگر یا به غدد لنفاوی مجاور (مجموعه سلولهای سیستم ایمنی به اندازه لوبیا) یا سایر اندامها گسترش یافته است. تومورهایی که به غدد لنفاوی یا سایر اندامها گسترش نیافته اند M0 در نظر گرفته میشوند، در حالی که آنهایی که گسترش یافته اند M1 هستند.
این عوامل با استفاده از اعداد رومی از I تا III برای ایجاد یک مرحله کلی ترکیب میشوند. مراحل I و II بیشتر به A برای تومورهای intracompartmental یا B برای تومورهای extracompartmental تقسیم میشوند.
به طور خلاصه:
- تومورهای با درجه پایین و موضعی مرحله I هستند.
- تومورهای با درجه بالا و موضعی مرحله II هستند.
- تومورهای متاستاتیک (صرف نظر از درجه) مرحله III هستند.
سیستم مرحله بندی TNM
سیستم دیگری که گاهی برای مرحله بندی سرطان استخوان (از جمله استئوسارکوم) استفاده میشود، سیستم TNM کمیسیون مشترک سرطان آمریکا (AJCC یا American Joint Commission on Cancer) است. این سیستم بر اساس 4 اطلاعات کلیدی است:
- T اندازه تومور اصلی (اولیه) و اگر در نواحی مختلف استخوان ظاهر شود را توصیف میکند.
- N میزان انتشار به غدد لنفاوی (منطقه ای) مجاور را توصیف میکند. تومورهای استخوانی به ندرت به غدد لنفاوی گسترش مییابند.
- M نشان میدهد که سرطان متاستاز (گسترش) به سایر اندامهای بدن دارد یا خیر. (شایع ترین محل انتشار به ریهها یا استخوانهای دیگر است.)
- G مخفف درجه تومور است که نحوه ظاهر سلولها را در زیر میکروسکوپ توصیف میکند. سلولهای تومور درجه پایین بیشتر شبیه سلولهای طبیعی هستند و احتمال رشد و گسترش سریع کمتری دارند، در حالی که سلولهای تومور درجه بالا غیر طبیعی تر به نظر میرسند.
اعداد بعد از T، N، M و G جزئیات بیشتری در مورد هر یک از این عوامل ارائه میدهند.
هنگامی که دستههای T، N و M و درجه سرطان استخوان مشخص شد، اطلاعات در یک مرحله کلی ترکیب میشوند. این مراحل (که با مراحل سیستم MSTS متفاوت است) با استفاده از اعداد رومی از I تا IV (1 تا 4) توصیف میشوند و گاهی اوقات بیشتر تقسیم میشوند. برای اطلاعات دقیق تر در مورد سیستم مرحله بندی AJCC TNM برای سرطان استخوان، به مبحث مراحل سرطان استخوان مراجعه کنید.
مرحله بندی استئوسارکوم میتواند گیج کننده باشد. اگر در مورد مرحله سرطان سوالی دارید، از یکی از اعضای تیم مراقبت از سرطان بخواهید تا آن را به روشی که شما درک میکنید، برایتان توضیح دهد.
میزان بقا برای استئوسارکوم
میزان بقا میتواند به شما ایده دهد که چند درصد از افراد مبتلا به همان نوع و مرحله سرطان، مدت معینی (معمولاً 5 سال) پس از تشخیص هنوز زنده هستند. آنها نمیتوانند به شما بگویند که یک فرد چقدر زنده خواهد ماند اما ممکن است به شما کمک کند تا درک بهتری از احتمال موفقیت روند درمانی خود داشته باشید.
به خاطر داشته باشید که میزان بقا عددی تخمینی است و اغلب بر اساس نتایج قبلی تعداد زیادی از افرادی است که سرطان خاصی داشتند اما آنها نمیتوانند پیش بینی کنند که در مورد فرد خاصی چه اتفاقی خواهد افتاد. این آمار میتواند گیج کننده باشد و ممکن است شما را به پرسیدن سوالات بیشتری سوق دهد. از پزشک خود بپرسید که چگونه این اعداد ممکن است برای شما (یا فرزندتان) اعمال شود.
نرخ بقای نسبی 5 ساله چیست؟
نرخ بقای نسبی افراد مبتلا به همان نوع و مرحله سرطان را با افراد موجود در کل جمعیت مقایسه میکند. به عنوان مثال، اگر نرخ بقای نسبی 5 ساله برای مرحله خاصی از استئوسارکوم 70 درصد باشد، به این معنی است که احتمال زنده ماندن افرادی که به آن سرطان مبتلا هستند نسبت به افرادی که آن سرطان را ندارند برای ۵ سال پس از تشخیص ابتلا، به طور متوسط حدود 70 درصد است.
این اعداد از کجا میآیند؟
انجمن سرطان آمریکا برای ارائه آمار بقای انواع مختلف سرطان به اطلاعات پایگاه داده نظارت، اپیدمیولوژی و نتایج نهایی (Surveillance, Epidemiology, and End Results یا SEER) که توسط موسسه ملی سرطان (NCI یا National Cancer Institute) نگهداری میشود، متکی است.
پایگاه داده SEER نرخ بقای نسبی 5 ساله استئوسارکوم در ایالات متحده را بر اساس میزان گسترش سرطان دنبال میکند. با این حال، پایگاه داده SEER سرطانها را بر اساس مراحل MSTS یا TNM (مرحله 1، مرحله 2، مرحله 3 و غیره) گروه بندی نمیکند. در عوض، سرطانها را به مراحل موضعی، منطقه ای و دور دسته بندی میکند:
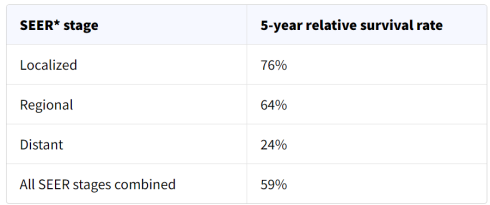
- موضعی (Localized): هیچ نشانه ای از گسترش سرطان به خارج از استخوان و جایی که شروع شده است، وجود ندارد.
- منطقه ای (Regional): سرطان در خارج از استخوان و به ساختارهای مجاور گسترش یافته یا به غدد لنفاوی مجاور رسیده است.
- دور (Distant): سرطان به قسمتهای دور بدن مانند ریهها یا استخوانهای سایر قسمتهای بدن گسترش یافته است.
نرخ بقای نسبی 5 ساله برای استئوسارکوم
این اعداد بر أساس اطلاعات افرادی است که بین سالهای 2012 تا 2018 مبتلا به استئوسارکوم تشخیص داده شده اند.
درک اعداد
- این اعداد فقط برای مرحله سرطان در هنگام اولین تشخیص صدق میکنند. اگر سرطان رشد کند، گسترش یابد یا پس از درمان عود کند، بعداً اعمال نمیشوند.
- این اعداد همه چیز را در نظر نمیگیرند. میزان بقا بر اساس میزان گسترش سرطان گروه بندی میشود اما عوامل دیگری مانند مواردی که در زیر ذکر شده است نیز میتوانند بر دیدگاه فرد تأثیر بگذارند.
- افرادی که اکنون مبتلا به استئوسارکوم تشخیص داده شده اند، ممکن است چشم انداز بهتری نسبت به این اعداد داشته باشند. درمانها با گذشت زمان بهبود مییابند و این اعداد بر اساس افرادی است که حداقل 5 سال زودتر تشخیص داده شده و درمان شده اند.
عوامل دیگری که میتوانند بر پیش آگهی فرد تأثیر بگذارند (چشم انداز)
عواملی غیر از مرحله سرطان نیز میتوانند بر میزان بقا تأثیر بگذارند. به عنوان مثال، عواملی که با پیش آگهی بهتر مرتبط هستند عبارتند از:
- کوچکتر بودن (کودک یا نوجوان، بر خلاف بزرگسالان)
- زن بودن
- قرار گرفتن تومور روی بازو یا پا (بر خلاف استخوان ران یا سایر استخوانها)
- تومور(ها) کاملا قابل برداشتن اند (با جراحی قابل برداشتن اند).
- سطح آلکالین فسفاتاز خون و LDH طبیعی است.
- تومور به خوبی به شیمی درمانی پاسخ میدهد.
درمان استئوسارکوم
اگر شما یا فرزندتان مبتلا به استئوسارکوم تشخیص داده شده باشد، تیم مراقبت از سرطان گزینههای درمانی را با شما در میان خواهند گذاشت. مهم است که مزایای هر گزینه را در مقابل خطرات و عوارض جانبی احتمالی سنجید.
استئوسارکوم چگونه درمان میشود؟
سه نوع روش درمانی اصلی برای استئوسارکوم استفاده میشود:
جراحی (Surgery) برای استئوسارکوم
جراحی بخش مهمی از روند درمان برای تقریباً همه استئوسارکومها است. این روش شامل:
- بیوپسی برای تشخیص سرطان
- برداشتن تومور(ها)
در صورت امکان، بسیار مهم است که بیوپسی و جراحی برای برداشتن تومور با هم برنامه ریزی شوند و یک جراح ارتوپد با تجربه هم بیوپسی و هم جراحی را همزمان برای برداشتن تومور انجام دهد. بیوپسی باید به روشی خاص انجام شود تا بهترین شانس را داشته باشد که بعداً به جراحی کمتر گسترده ای نیاز باشد.
هدف اصلی جراحی حذف تمام سرطان است. اگر حتی مقدار کمی از سرطان باقی بماند، ممکن است به رشد خود ادامه دهد و تومور جدیدی بسازد و حتی ممکن است به سایر قسمتهای بدن گسترش یابد. برای کاهش خطر این اتفاق، جراحان تومور را به اضافه مقداری از بافت طبیعی که آن را احاطه کرده است، برمیدارند. این به عنوان یک برداشت گسترده (wide excision) شناخته میشود.
دکتری به نام پاتولوژیست بافت برداشته شده را زیر میکروسکوپ بررسی میکند تا ببیند آیا سلولهای سرطانی در حاشیه (لبههای بیرونی) وجود دارند یا خیر.
- اگر سلولهای سرطانی در لبههای بافت دیده شوند، حاشیهها مثبت نامیده میشوند. حواشی مثبت (Positive margins) میتواند به این معنی باشد که برخی از سرطانها باقی مانده اند.
- هنگامی که هیچ سلول سرطانی در لبههای بافت دیده نمیشود، گفته میشود که حاشیهها منفی، تمیز یا شفاف هستند. یک برش گسترده با حاشیههای تمیز (clean margins) به محدود کردن خطر بازگشت سرطان در محلی که شروع شده است، کمک میکند.
نوع جراحی انجام شده عمدتاً به محل و اندازه تومور بستگی دارد. اگرچه تمام عملهای برداشتن استئوسارکوم پیچیده است، برداشتن تومورهای اندام (بازوها یا پاها) به طور کلی به سختی آنهایی که در استخوان فک، قاعده جمجمه، ستون فقرات یا لگن (لگن) هستند، نیست.
تومور در بازوها یا پاها
تومورهای بازوها یا پاها را میتوان با یکی از موارد زیر درمان کرد:
- جراحی نجات یا حفظ اندام (Limb-salvage surgery): برداشتن سرطان و برخی بافتهای طبیعی اطراف آن اما دستنخورده ماندن اندام
- قطع عضو (Amputation): برداشتن سرطان و تمام یا بخشی از یک دست یا پا
جراحی نجات اندام
اکثر بیماران مبتلا به تومور در بازوها یا پاها میتوانند جراحی حفظ اندام انجام دهند، اما این بستگی به این دارد که تومور کجاست، چقدر بزرگ است و اینکه آیا به ساختارهای مجاور رشد کرده است یا خیر.
جراحی نجات اندام یک عمل بسیار پیچیده است. جراحانی که این نوع عمل را انجام میدهند باید مهارت و تجربه خاصی داشته باشند. چالش این است که کل تومور را بردارید و در عین حال تاندونها، اعصاب و رگهای خونی نزدیک را حفظ کنید تا عملکرد و ظاهر اندام تا حد امکان حفظ شود. اگر سرطان به این ساختارها تبدیل شده باشد، باید همراه با تومور برداشته شوند. در چنین مواردی ممکن است گاهی اوقات قطع عضو بهترین گزینه باشد.
بخشی از استخوان که همراه با استئوسارکوم برداشته میشود با یک تکه استخوان از قسمت دیگری از بدن یا از شخص دیگری (پیوند استخوان) یا با یک وسیله مصنوعی ساخته شده از فلز و مواد دیگر جایگزین میشود. برخی از دستگاههای جدیدتر پیوند و پروتز را ترکیب میکنند.
عوارض جراحی نجات اندام میتواند شامل عفونتها و گرافتها یا میلههایی باشد که شل یا شکسته میشوند. بیمارانی که جراحی نجات اندام انجام میدهند ممکن است در سالهای بعد به جراحی بیشتری نیاز داشته باشند و برخی ممکن است در نهایت نیاز به قطع عضو داشته باشند.
استفاده از پروتز داخلی در کودکان در حال رشد به ویژه چالش برانگیز است. در گذشته، با رشد کودک، نیاز به عملهای گاه به گاه برای جایگزینی پروتز با پروتز طولانی تر بود. پروتزهای جدیدتر بسیار پیچیده شده اند و اغلب میتوانند بدون هیچ جراحی اضافی طولانیتر شوند. آنها دستگاههای کوچکی در خود دارند که میتوانند در صورت نیاز پروتز را بلند تر کنند تا فضایی برای رشد کودک ایجاد شود اما حتی این پروتزها نیز ممکن است نیاز به جایگزینی با پروتزهای قوی تری برای بزرگسالان داشته باشند، زمانی که رشد بدن کودک متوقف شود.
به طور متوسط حدود یک سال طول میکشد تا بیماران پس از جراحی نجات اندام روی پا، راه رفتن را یاد بگیرند. توانبخشی بدنی پس از جراحی نجات اندام شدیدتر از دوران پس از قطع عضو بوده و بسیار مهم است. اگر بیمار به طور فعال در برنامه توان بخشی شرکت نکند، دست یا پای نجات یافته ممکن است بی فایده شود.
قطع عضو
برای برخی از بیماران، قطع عضو ممکن است بهترین گزینه باشد. به عنوان مثال، اگر تومور بسیار بزرگ باشد یا به اعصاب و یا رگهای خونی گسترش یابد، ممکن است امکان نجات اندام وجود نداشته باشد.
جراح بر اساس نتایج اسکن MRI و بررسی بافت برداشته شده توسط پاتولوژیست در حین جراحی تعیین میکند که چه مقدار از دست یا پا باید قطع شود.
معمولاً جراحی به گونهای برنامه ریزی میشود که ماهیچهها و پوست یک کاف (cuff) در اطراف استخوان باقی مانده تشکیل دهند. این کاف در انتهای اندام مصنوعی (مصنوعی) قرار میگیرد. گزینه دیگر ممکن است کاشت پروتز در استخوان باقی مانده باشد و انتهای پروتز خارج از پوست باقی بماند. سپس میتوان آن را به یک پروتز خارجی متصل کرد.
جراحی ترمیمی میتواند به برخی از بیمارانی که عضوی از بدن خود را از دست میدهند کمک کند تا به بهترین شکل ممکن عمل کنند. به عنوان مثال، اگر پا باید از وسط ران (از جمله مفصل زانو) قطع شود، ساق پا و پا را میتوان چرخاند و به استخوان ران متصل کرد، به طوری که مچ پا به عنوان یک مفصل جدید زانو عمل میکند. به این جراحی روتیشن پلاستی (rotationplasty) میگویند. البته بیمار همچنان به یک اندام مصنوعی برای جایگزینی قسمت تحتانی پا نیاز دارد.
با فیزیوتراپی مناسب، فرد اغلب 3 تا 6 ماه پس از قطع پا میتواند به تنهایی راه برود.
اگر استئوسارکوم در شانه یا بازو باشد و نیاز به قطع عضو باشد، در برخی موارد میتوان ناحیه دارای تومور را برداشته و بازوی تحتانی را مجدداً وصل کرد تا بیمار دارای بازوی عملکردی اما بسیار کوتاهتر باشد.
توان بخشی بعد از جراحی
این ممکن است سخت ترین بخش درمان باشد و نمیتوان آن را در اینجا به طور کامل شرح داد. بیماران و والدین باید قبل از جراحی با یک متخصص توان بخشی ملاقات کنند تا در مورد گزینههای آنها و آنچه ممکن است بعد از جراحی مورد نیاز باشد، مطلع شوند.
اگر عضوی قطع شود، بیمار باید زندگی با اندام مصنوعی و استفاده از آن را بیاموزد. این امر به ویژه برای کودکان در حال رشد میتواند سخت باشد، اگر اندام مصنوعی نیاز به تغییر داشته باشد تا با رشد آنها هماهنگ باشد.
هنگامی که تنها تومور و بخشی از استخوان در یک عمل حفظ اندام برداشته میشود، گاهی اوقات وضعیت میتواند حتی پیچیدهتر شود، به خصوص در کودکان در حال رشد. ممکن است در آینده به جراحی بیشتری برای جایگزینی پروتز داخلی با پروتز متناسب با اندازه بدن در حال رشد آنها نیاز باشد.
هم قطع عضو و هم جراحی حفظ اندام میتوانند جوانب مثبت و منفی داشته باشند. به عنوان مثال، جراحی حفظ اندام، اگرچه اغلب قابل قبول تر از قطع عضو است اما به دلیل پیچیدگی آن، منجر به عوارض بیشتری میشود. کودکان در حال رشدی که تحت عمل جراحی حفظ اندام قرار میگیرند نیز احتمال بیشتری دارد که بعداً به جراحی بیشتری نیاز داشته باشند.
هنگامی که محققان به نتایج جراحیهای مختلف از نظر کیفیت زندگی نگاه کرده اند، تفاوت کمی بین آنها وجود داشته است. شاید بزرگترین مشکل برای نوجوانان باشد که ممکن است نگران اثرات اجتماعی عمل خود باشند. مسائل عاطفی میتوانند بسیار مهم باشند و حمایت و تشویق برای همه بیماران مورد نیاز است.
تومورهایی که در نواحی دیگر شروع میشوند
برداشتن کامل تومورهای استخوان لگن با عمل جراحی دشوار است اما اگر تومور ابتدا به خوبی به شیمی درمانی پاسخ دهد، جراحی (گاهی اوقات با پرتو درمانی به دنبال آن) ممکن است تمام سرطان را از بین ببرد. گاهی اوقات میتوان استخوانهای لگن را بعد از جراحی بازسازی کرد اما در برخی موارد ممکن است نیاز به برداشتن استخوانهای لگن و ساق پایی که به آن متصل شده است، باشد.
برای تومورهای استخوان فک پایین، تمام نیمه پایینی فک ممکن است برداشته شود و بعداً با استخوانهای سایر قسمتهای بدن جایگزین شود. اگر جراح نتواند تمام تومور را بردارد، ممکن است از پرتو درمانی نیز استفاده شود.
برای تومورهایی که در نواحی مانند ستون فقرات یا جمجمه قرار دارند، ممکن است حذف تمام تومور به طور ایمن امکان پذیر نباشد. سرطان در این استخوانها ممکن است به ترکیبی از درمانها مانند شیمی درمانی، جراحی و پرتو درمانی نیاز داشته باشد.
فیوژن مفصل (arthrodesis یا Joint fusion): گاهی اوقات، پس از برداشتن توموری که یک مفصل را درگیر میکند (ناحیه ای که دو استخوان به هم میرسند)، ممکن است بازسازی مفصل امکان پذیر نباشد. در این مورد، ممکن است عمل جراحی برای جوش دادن دو استخوان با هم انجام شود. این اغلب برای تومورهای ستون فقرات استفاده میشود اما ممکن است در سایر قسمتهای بدن مانند شانه یا لگن نیز استفاده شود. در حالی که میتواند به تثبیت مفصل کمک کند، فرد باید یاد بگیرد که از دست دادن حرکت ناشی از آن را جبران کند.
درمان جراحی متاستازها
اگر استئوسارکوم به سایر نقاط بدن گسترش یافته باشد، این تومورها باید برداشته شوند تا سرطان شانس درمان داشته باشند.
استئوسارکوم اغلب به ریهها گسترش مییابد. اگر میتوان برای حذف این متاستازها عمل جراحی انجام داد، باید بسیار دقیق برنامه ریزی شود. مواردی که قبل از عمل باید در نظر گرفته شوند، عبارتند از:
- تعداد تومورها
- محل تومور(ها) (یک ریه یا هر دو ریه)
- اندازه تومور(ها)
- تومور(ها) چقدر به شیمی درمانی پاسخ دادند.
- سلامت کلی فرد
از آن جایی که سی تی اسکن قفسه سینه انجام شده قبل از جراحی ممکن است تمام تومورهای ریه را نشان ندهد، در صورتی که تومورهای بیشتری در طول عمل پیدا شود، جراح برنامه درمانی خواهد داشت.
بیمارانی که در هر دو ریه تومور دارند و به شیمی درمانی پاسخ خوبی میدهند، میتوانند هر بار یک ریه را جراحی کنند.
برداشتن تومورها از هر دو ریه به طور همزمان ممکن است گزینه دیگری باشد.
برخی از متاستازهای ریه ممکن است نتوانند برداشته شوند زیرا خیلی بزرگ هستند یا خیلی نزدیک به ساختارهای مهم در قفسه سینه قرار دارند (مانند رگهای خونی بزرگ). بیمارانی که سلامت کلی آنها خوب نیست (مثلاً به دلیل مشکلات قلبی، کبدی یا کلیوی) ممکن است نتوانند استرس ناشی از بیهوشی و جراحی برای حذف متاستازها را تحمل کنند.
تعداد کمی از استئوسارکومها به سایر استخوانها یا اندامهایی مانند کلیهها، کبد یا مغز گسترش مییابند. اینکه آیا این تومورها را میتوان با جراحی برداشت، به اندازه، محل و سایر عوامل بستگی دارد.
عوارض جانبی جراحی
خطرات و عوارض جانبی کوتاه مدت: جراحی برای برداشتن استئوسارکوم اغلب یک عمل طولانی و پیچیده است. عوارض جانبی جدی کوتاه مدت رایج نیستند اما میتوانند شامل واکنش به بیهوشی، خونریزی بیش از حد، لخته شدن خون و عفونت باشند. درد بعد از عمل شایع است و ممکن است برای مدتی پس از جراحی با بهبودی محل نیاز به داروهای ضد درد قوی داشته باشد.
عوارض جانبی طولانی مدت: عوارض جانبی طولانی مدت جراحی عمدتاً به محل تومور و نوع عمل بستگی دارد. بیشتر استئوسارکومها در استخوانهای بازوها یا پاها رخ میدهند و برخی از مشکلات طولانی مدت جراحی روی این تومورها در بالا توضیح داده شده است.
عوارض جراحی حفظ اندام میتواند شامل پیوند استخوان یا پروتز باشد که ممکن است شل یا شکسته شود. این احتمال بیشتر از جراحی استخوان به دلایل دیگر است زیرا شیمی درمانی قبل و بعد از جراحی میتواند خطر عفونت را افزایش داده و بر بهبود زخم تأثیر بگذارد. عفونتها همچنین در افرادی که قطع عضو شده اند – به خصوص قسمتی از ساق پا – نگران کننده است زیرا فشار وارد شده به پوست در محل قطع عضو میتواند به مرور زمان باعث از بین رفتن پوست شود.
همان طور که قبلا ذکر شد، فیزیوتراپی و توان بخشی پس از جراحی برای استئوسارکوم بسیار مهم است. پیروی از برنامه توان بخشی توصیه شده بهترین شانس را برای عملکرد طولانی مدت اندام ارائه میدهد. حتی با توان بخشی، افراد همچنان ممکن است مجبور باشند خود را با مسائل طولانی مدتی مانند تغییر در نحوه راه رفتن یا انجام کارهای دیگر و تغییرات ظاهری وفق دهند. درمانهای فیزیکی، شغلی و دیگر درمانها اغلب میتوانند به افراد در سازگاری و مقابله با این چالشها کمک کنند.
شیمی درمانی (Chemotherapy) و سایر داروها برای استئوسارکوم
شیمی درمانی (chemo) استفاده از داروها برای درمان سرطان است. این داروها معمولاً به داخل ورید تزریق میشوند و میتوانند به سلولهای سرطانی در سراسر بدن برسند و آنها را از بین ببرند.
شیمی درمانی بخش مهمی از درمان برای اکثر افراد مبتلا به استئوسارکوم است (اگرچه برخی از بیماران مبتلا به استئوسارکوم درجه پایین ممکن است به آن نیاز نداشته باشند). به نظر نمیرسد اغلب استئوسارکومها در ابتدای پیدایش فراتر از تومور اصلی گسترش یافته باشند اما در گذشته، زمانی که این سرطانها تنها با جراحی درمان میشدند، سرطان اغلب در قسمتهای دیگر بدن بازمیگشت، حالتی که کنترل آن بسیار سخت بود. انجام شیمی درمانی همراه با جراحی به کاهش خطر بازگشت این سرطانها کمک میکند.
اکثر استئوسارکومها با شیمی درمانی قبل از جراحی (که به عنوان شیمی درمانی نئوادجوانت یا neoadjuvant chemotherapy شناخته میشود) برای حدود 10 هفته درمان میشوند. در برخی از افراد مبتلا به استئوسارکوم در استخوان بازو یا پا، این امر میتواند تومور را کوچک کند که ممکن است به آسانتر شدن جراحی کمک کند. سپس شیمی درمانی پس از جراحی (که به عنوان شیمی درمانی کمکی یا adjuvant chemotherapy شناخته میشود) تا یک سال دوباره تجویز میشود.
شیمی درمانی به صورت دورهای انجام میشود و هر دوره از درمان با یک دوره استراحت همراه است تا به بدن زمان لازم برای بهبودی داده شود. هر چرخه معمولاً چند هفته طول میکشد.
داروهای شیمی درمانی که برای درمان استئوسارکوم استفاده میشود
داروهایی که اغلب برای درمان استئوسارکوم استفاده میشوند، عبارتند از:
- متوترکسات یا Methotrexate (در دوزهای بالا، همراه با لوکوورین یا leucovorin برای کمک به کاهش عوارض جانبی داده میشود)
- دوکسوروبیسین (Adriamycin یا Doxorubicin)
- سیس پلاتین (Cisplatin) یا کربوپلاتین (carboplatin)
- ایفوسفامید (Ifosfamide)
- سیکلوفسفامید (Cyclophosphamide)
- اتوپوزید (Etoposide)
- جمسیتابین (Gemcitabine)
معمولا 2 یا چند دارو با هم تجویز میشود. برخی از ترکیبات رایج داروها عبارتند از:
- دوز بالا متوترکسات، دوکسوروبیسین و سیس پلاتین (معروف به رژیم MAP)، گاهی اوقات همراه با ایفوسفامید. این ترکیب بیشتر در کودکان، نوجوانان و بزرگسالان جوان استفاده میشود.
- دوکسوروبیسین و سیس پلاتین که بیشتر در افراد مسن استفاده میشود.
- ایفوسفامید و اتوپوزید
- ایفوسفامید، سیس پلاتین (یا کربوپلاتین) و اپی روبیسین
بسیاری از کارشناسان توصیه میکنند که داروها در صورت امکان در دوزهای بسیار بالا تجویز شوند.
قبل از شروع شیمی درمانی، پزشک ممکن است توصیه کند که یک کاتتر (catheter، یک لوله نازک و نرم) را در ورید بزرگ قفسه سینه قرار دهید. گاهی اوقات به این دستگاه دسترسی وریدی (venous access device یا VAD) یا کاتتر ورید مرکزی (CVC یا central venous catheter) میگویند. کاتتر در حالی که بیمار تحت مصرف آرام بخش است (خواب آلود) یا تحت بیهوشی عمومی (در خواب عمیق) است، در بدن قرار میگیرد.
یک انتهای کاتتر در ورید میماند، در حالی که انتهای دیگر درست در زیر یا بیرون پوست قرار دارد. این به تیم مراقبتهای بهداشتی اجازه میدهد تا داروهای شیمی درمانی و سایر داروها را تجویز کنند و بدون نیاز به چسباندن سوزن در رگها هر بار نمونه خون بگیرند. کاتتر معمولاً برای چندین ماه در جای خود باقی میماند و میتواند شیمی درمانی را کمتر دردناک کند.
در صورت استفاده از چنین وسیله ای، تیم مراقبتهای بهداشتی به شما نحوه مراقبت از آن را برای کاهش خطر مشکلاتی مانند عفونت آموزش میدهند.
عوارض جانبی شیمی درمانی
داروهای شیمی درمانی میتوانند عوارض جانبی ایجاد کنند. کودکان نسبت به بزرگسالان عوارض جانبی کمتری از شیمی درمانی دارند و اغلب سریعتر از عوارض جانبی بهبود مییابند. به همین دلیل، پزشکان میتوانند به آنها دوزهای بالاتری از شیمی درمانی بدهند تا تومور را بکشند.
عوارض جانبی داروهای شیمی درمانی به نوع، دوز و مدت زمان مصرف آنها بستگی دارد.
عوارض عمومی شیمی درمانی
- تهوع و استفراغ
- از دست دادن اشتها
- اسهال
- ریزش مو
- زخمهای دهانی
شیمی درمانی میتواند به مغز استخوان – جایی که سلولهای خونی جدید ساخته میشود – آسیب برساند. این میتواند منجر به کاهش تعداد سلولهای خونی شود که خود میتواند منجر به بروز موارد زیر شود:
- افزایش احتمال عفونت (به دلیل کمبود گلبولهای سفید خون)
- خونریزی یا کبودی پس از بریدگی یا جراحات جزئی (به دلیل کمبود پلاکت)
- خستگی یا تنگی نفس (از تعداد کم گلبولهای قرمز خون)
نگرانی اصلی در مورد شیمی درمانی مورد استفاده برای درمان استئوسارکوم این است که میتواند منجر به کاهش خطرناک سطح گلبولهای سفید خون و افزایش خطر عفونتهای جدی شود. به همین دلیل، داروهایی به نام فاکتورهای رشد (مانند فیلگراستیم یا filgrastim، همچنین به عنوان G-CSF) ممکن است همراه با شیمی درمانی داده شود تا به بدن در ساخت گلبولهای سفید جدید در سریع ترین زمان ممکن کمک کند.
بیشتر عوارض جانبی فوق پس از پایان دوره درمان از بین میروند. اغلب راههایی برای کاهش شدت این عوارض وجود دارد. برای مثال، داروهایی برای کمک به پیشگیری یا کاهش تهوع و استفراغ یا کمک به بازگرداندن شمارش خون به سطوح طبیعی میتواند تجویز شود. حتماً هر گونه سؤالی که در مورد عوارض جانبی دارید با تیم مراقبت از سرطان در میان بگذارید و در مورد عوارض جانبی به آنها بگویید تا بتوان آنها را کنترل کرد.
عوارض جانبی برخی داروهای شیمی درمانی
برخی از عوارض جانبی مختص داروهای خاصی است. بسیاری از این عوارض نادر هستند اما ممکن است که رخ دهند. قبل از درمان، از تیم مراقبت سرطان خود در مورد عوارض جانبی احتمالی داروهایی که شما یا فرزندتان دریافت خواهید کرد، سوال کنید.
- ایفوسفامید و سیکلوفسفامید میتوانند به پوشش مثانه آسیب برسانند که میتواند باعث ایجاد خون در ادرار شود. احتمال این اتفاق را میتوان با دادن دارویی به نام مسنا (mesna) در طول شیمی درمانی به همراه مایعات فراوان کاهش داد.
- سیس پلاتین و کربوپلاتین میتوانند باعث آسیب عصبی (به نام نوروپاتی یا neuropathy) شوند که منجر به بی حسی، سوزن سوزن شدن یا درد در دستها و پاها میشود. این اغلب پس از قطع درمان از بین میرود یا بهتر میشود اما ممکن است در برخی افراد مدت زیادی باقی بماند. این داروها گاهی اوقات میتوانند بر شنوایی، به ویژه صداهای با صدای بلند تأثیر بگذارند. آسیب کلیه نیز ممکن است پس از درمان رخ دهد. دادن مقدار زیادی مایعات قبل و بعد از تزریق دارو میتواند به جلوگیری از این امر کمک کند.
- اتوپوزید همچنین میتواند باعث آسیب عصبی شود. همچنین میتواند خطر ابتلا به لوسمی حاد میلوئیدی (acute myeloid leukemia یا AML)، سرطان گلبولهای سفید خون را افزایش دهد. خوشبختانه این امر رایج نیست.
- متوترکسات با دوز بالا میتواند به ماده سفید مغز (به نام لکوآنسفالوپاتی یا leukoencephalopathy) آسیب برساند و همچنین میتواند بر کبد و کلیهها تأثیر بگذارد. قبل از شروع دوز بالای متوترکسات، داروهایی برای کمک به محافظت از کلیهها تجویز میشود. ممکن است سطوح خونی متوترکسات بررسی شود تا ببینیم چه مقدار لوکوورین یا leucovorin (که اسید فولینیک نیز نامیده میشود) باید برای محدود کردن هرگونه آسیب به بافتهای طبیعی تجویز شود.
- دوکسوروبیسین (آدریامایسین) میتواند به عضله قلب آسیب برساند. خطر این امر با مقدار کل دارویی که داده میشود افزایش مییابد، بنابراین پزشکان مراقب هستند که دوز کل را محدود کنند. پزشک (کودک) شما ممکن است آزمایش عملکرد قلب (مانند اکوکاردیوگرام) را قبل و در طول درمان تجویز کند تا ببیند آیا این دارو بر قلب تأثیر میگذارد یا خیر. دارویی به نام دکسرازوکسان ممکن است همراه با شیمی درمانی برای کمک به کاهش آسیب احتمالی تجویز شود.
برخی از داروهای شیمی درمانی میتوانند بر توانایی (کودک) شما برای بچه دار شدن (باروری) در مراحل بعدی زندگی تأثیر بگذارند. از تیم مراقبت سرطان در مورد اثرات احتمالی درمان بر باروری بپرسید و بپرسید که آیا گزینههایی برای حفظ باروری وجود دارد، مانند بانک اسپرم یا حفظ تخمک.
پزشکان و پرستاران از نزدیک عوارض جانبی را زیر نظر خواهند داشت. از پرسیدن هرگونه سوال در مورد عوارض جانبی از تیم مراقبت سرطان دریغ نکنید.
آزمایشهایی برای بررسی عوارض جانبی شیمی درمانی: قبل از هر دوره درمانی، نتایج تستهای آزمایشگاهی بررسی میشود تا مطمئن شوید که کبد، کلیهها و مغز استخوان به خوبی کار میکنند. آزمایشهای دیگری نیز ممکن است در طول روند درمان و پس از آن انجام شود.
- شمارش کامل خون (complete blood count یا CBC) سطح گلبولهای سفید، گلبولهای قرمز و پلاکتهای خون را بررسی میکند. این موارد در طول و بعد از شیمی درمانی به دقت بررسی میشوند. گلبولهای سفید و پلاکتها معمولاً حدود 2 هفته پس از انجام شیمی درمانی به پایین ترین نقطه خود میرسند، اگرچه این امر میتواند در رژیمهای با دوز بالا زودتر رخ دهد.
- آزمایشات شیمی خون، برخی مواد شیمیایی خون را اندازه گیری میکند که به پزشکان میگوید کبد و کلیهها چقدر خوب کار میکنند. برخی از داروهای شیمی درمانی میتوانند به این اندامها آسیب برسانند.
- اودیوگرام (شنوایی سنجی) ممکن است برای بررسی شنوایی انجام شود که ممکن است تحت تأثیر داروهای شیمی درمانی خاص قرار گیرد.
- اگر قرار است دوکسوروبیسین داده شود، آزمایشاتی مانند اکوکاردیوگرام (سونوگرافی قلب) ممکن است قبل و در طول درمان برای بررسی عملکرد قلب انجام شود.
داروهای دیگر برای درمان استئوسارکوم
اگر داروهای شیمی درمانی دیگر مفید نباشند، انواع دیگر داروها ممکن است در برخی شرایط یک گزینه باشند.
داروهای درمان هدفمند (Targeted therapy drugs)
پزشکان اکنون در حال مطالعه داروهای جدیدتری هستند که بخشهای خاصی از سلولهای تومور (یا سلولهای مجاور) را به عنوان راهی برای درمان استئوسارکوم مورد هدف قرار میدهند. این داروهای هدفمند متفاوت از داروهای شیمی درمانی استاندارد عمل میکنند. ممکن است گاهی اوقات زمانی که داروهای شیمی درمانی دیگر کار نمیکنند، مفید باشند.
به عنوان مثال، regorafenib (Stivarga)، sorafenib (Nexavar) و cabozantinib (Cabometyx) داروهایی هستند که بر توانایی تومور برای ایجاد عروق خونی جدید که برای رشد به آن نیاز دارد، تأثیر میگذارند. در مطالعات اولیه نشان داده شده است که این داروها به برخی از افراد مبتلا به استئوسارکوم کمک میکنند. اگرچه این داروها هنوز توسط FDA برای درمان استئوسارکوم تایید نشده اند اما برای درمان سایر انواع سرطان تایید شده اند و اگر داروهای شیمی درمانی استاندارد دیگر مفید نباشند، ممکن است یکی از آنها را امتحان کنید.
عوارض جانبی رایج این داروها میتواند شامل خستگی، از دست دادن اشتها، سندرم دست و پا (hand-foot syndrome، قرمزی و تحریک دست و پا)، فشار خون بالا، کاهش وزن، اسهال و درد شکم (belly) باشد.
عوارض جانبی کمتر شایع اما جدیتر میتواند شامل مشکلات مربوط به جریان خون به قلب، خونریزی، نتایج غیر طبیعی آزمایش تیروئید و سوراخ شدن (perforations) معده یا روده باشد.
داروهای رادیواکتیو (رادیوداروها)
داروهایی که شامل یک عنصر رادیواکتیو هستند گاهی اوقات میتوانند در افراد مبتلا به استئوسارکوم پیشرفته مفید باشند. این داروها به خون تزریق میشوند و به استخوانها میروند و در آن جا مقادیر کمی پرتو میتابند که میتواند به کند کردن رشد تومور و درمان علائمی مانند درد کمک کند. برای اطلاعات بیشتر، مبحث پرتو درمانی برای استئوسارکوم را مطالعه کنید.
پرتو درمانی (Radiation Therapy) برای استئوسارکوم
پرتو درمانی از پرتوها یا ذرات پر انرژی برای از بین بردن سلولهای سرطانی استفاده میکند.
سلولهای استئوسارکوم به راحتی توسط اشعه از بین نمیروند، بنابراین پرتو درمانی نقش عمده ای در درمان این نوع سرطان بازی نمیکند اما گاهی اوقات اگر تومور را نتوان به طور کامل با جراحی برداشت، پرتو درمانی میتواند مفید باشد. به عنوان مثال، استئوسارکوم میتواند در استخوانهای لگن یا در استخوانهای صورت، به ویژه فک شروع شود. در این شرایط، اغلب حذف تمام سرطان ممکن نیست. پس از برداشتن هر چه بیشتر تومور، برای از بین بردن سلولهای سرطانی باقی مانده پرتو داده میشود. شیمی درمانی اغلب پس از پرتو درمانی انجام میشود.
در صورتی که جراحی امکان پذیر نباشد یا اگر سرطان عود کرده باشد، میتوان از پرتو درمانی برای کمک به کند کردن رشد تومور و کنترل علائمی مانند درد و تورم استفاده کرد.
پرتو درمانی خارجی (External beam radiation therapy)
این نوعی از پرتو درمانی است که اغلب برای درمان استئوسارکوم استفاده میشود. دستگاهی خارج از بدن پرتوهای پرانرژی را روی تومور متمرکز میکند تا سلولهای سرطانی را از بین ببرد.
قبل از شروع روند درمان، تیم پرتو درمانی با آزمایشهای تصویر برداری مانند اسکنهای MRI اندازه گیریهای دقیقی انجام میدهند تا زوایای صحیح برای نشانه گیری پرتوهای تابشی و دوز مناسب تابش را تعیین کند. این جلسه برنامه ریزی شبیه سازی (simulation) نامیده میشود.
اغلب، پرتو درمانی 5 روز در هفته به مدت چند هفته انجام میشود. هر جلسه درمانی بسیار شبیه به عکس گرفتن با اشعه ایکس است، اگرچه دوز تابش بسیار بالاتر است. روند درمان دردناک نیست. در هر جلسه، شما (یا فرزندتان) روی یک میز مخصوص دراز میکشید در حالی که دستگاه تابش را از زوایای دقیق ارسال میکند.
هر جلسه درمانی فقط چند دقیقه طول میکشد، اگرچه زمان تنظیم – قرار دادن شما در وضعیت مناسب برای شروع روند درمان – معمولاً بیشتر طول میکشد. ممکن است به کودکان خردسال دارو داده شود تا بخوابند تا در طول جلسه درمانی حرکت نکنند.
تکنیکهای جدیدتر، مانند پرتو درمانی تعدیل شده شدت (intensity modulated radiation therapy یا IMRT)، درمان پرتو پروتون منسجم (conformal proton beam therapy) و رادیوسرجری استریوتاکتیک (stereotactic radiosurgery یا SRS)، به پزشکان اجازه میدهد پرتو را با دقت بیشتری به سمت تومور هدف قرار دهند و در عین حال میزان دریافت بافتهای سالم مجاور را کاهش دهند. این ممکن است شانس بیشتری برای افزایش میزان موفقیت و کاهش عوارض جانبی ارائه دهد. بسیاری از پزشکان در حال حاضر استفاده از این روشها را در صورت در دسترس بودن توصیه میکنند.
عوارض جانبی احتمالی پرتو درمانی
عوارض جانبی پرتو درمانی خارجی بستگی به دوز پرتو و محل مصرف آن دارد.
مشکلات کوتاه مدت میتواند شامل اثراتی بر روی نواحی پوستی باشد که تابش دریافت میکنند که میتواند از تغییرات خفیف مانند آفتاب سوختگی و ریزش مو تا واکنشهای پوستی شدیدتر باشد. تابش اشعه به شکم یا لگن میتواند باعث تهوع، اسهال و مشکلات ادراری شود. با تیم مراقبتهای بهداشتی (کودک) خود در مورد عوارض جانبی احتمالی صحبت کنید زیرا ممکن است راههایی برای تسکین برخی از آنها وجود داشته باشد.
در کودکان، پرتو درمانی میتواند رشد استخوان را کند کند. برای مثال، تشعشع به استخوانهای یک پا ممکن است باعث کوتاهتر بودن آن از پای دیگر شود.
تابش به استخوانهای صورت ممکن است باعث رشد ناهموار شود که ممکن است بر ظاهر کودک تأثیر بگذارد اما اگر کودکی کاملاً یا تقریباً کامل رشد کرده باشد، احتمال کمتری وجود دارد که این مشکل ایجاد شود.
بسته به اینکه تابش در کجا هدف قرار میگیرد، میتواند به سایر اندامها نیز آسیب برساند:
- تابش به دیواره قفسه سینه یا ریهها میتواند بر عملکرد ریه و قلب تأثیر بگذارد.
- تابش به ناحیه فک ممکن است غدد بزاقی را تحت تأثیر قرار دهد که میتواند منجر به خشکی دهان و مشکلات دندان شود.
- پرتو درمانی به ستون فقرات یا جمجمه ممکن است بر اعصاب نخاع یا مغز تأثیر بگذارد. این میتواند منجر به آسیب عصبی، سردرد و مشکل در تفکر شود که معمولاً 1 یا 2 سال پس از درمان جدی تر میشود. تابش به ستون فقرات ممکن است باعث بی حسی یا ضعف در بخشی از بدن شود.
- تابش اشعه به لگن میتواند به مثانه یا روده آسیب برساند که میتواند منجر به مشکلاتی در دفع ادرار یا حرکات روده شود. همچنین میتواند به اندامهای تناسلی آسیب برساند که میتواند بر باروری کودک در مراحل بعدی زندگی تأثیر بگذارد، بنابراین پزشکان تمام تلاش خود را برای محافظت از این اندامها با محافظت از آنها در برابر تشعشعات یا خارج کردن آنها از مسیر در هر زمان که ممکن است انجام میدهند.
یکی دیگر از نگرانیهای اصلی پرتو درمانی این است که ممکن است باعث ایجاد سرطان جدیدی در بخشی از بدن شود که تحت درمان با پرتو درمانی قرار گرفته است. هر چه دوز تشعشع بالاتر باشد، احتمال وقوع آن بیشتر است اما خطر کلی آن اندک است و نباید کودکانی را که نیاز به اشعه دارند، از دریافت آن باز دارد.
برای کاهش خطر عوارض طولانی مدت پرتو، پزشکان سعی میکنند از کمترین دوز پرتو درمانی استفاده کنند که هنوز موثر است. با این وجود، مهم است که بازدیدهای بعدی را با پزشک (کودک) خود ادامه دهید تا در صورت بروز مشکل، بتوان هرچه زودتر آن را پیدا کرده و درمان کرد.
داروهای رادیواکتیو (رادیوداروها)
داروهای رادیواکتیو جستجوی استخوان، مانند ساماریوم-153-EDTMP (Quadramet) یا رادیوم-233 (Xofigo)، گاهی برای کاهش رشد تومور و درمان علائمی مانند درد در افراد مبتلا به استئوسارکوم پیشرفته استفاده میشوند. این داروها به داخل سیاهرگ تزریق شده و در استخوانها جمع میشوند. پس از رسیدن به آن جا، تشعشعاتی که منتشر میکنند، سلولهای سرطانی را میکشد.
این داروها به ویژه زمانی مفید هستند که سرطان به بسیاری از استخوانها گسترش یافته باشد زیرا پرتوهای خارجی باید به سمت هر استخوان آسیب دیده هدف گیری شود. در برخی موارد، این داروها همراه با پرتوهای خارجی با هدف دردناک ترین متاستازهای استخوانی استفاده میشوند.
عارضه جانبی اصلی این داروها کاهش تعداد سلولهای خونی است که میتواند خطر عفونت یا خونریزی را افزایش دهد، به خصوص اگر شمارش خون از قبل پایین باشد.
درمان بر اساس وسعت استئوسارکوم
درمان استئوسارکوم به عوامل مختلفی از جمله محل، وسعت و درجه سرطان بستگی دارد، اگر پزشکان فکر میکنند میتوان آن را به طور کامل برداشت (رزکسیون) کرد و به سن و سلامت کلی فرد بستگی دارد.
استئوسارکوم موضعی قابل برداشت
این سرطانها به سایر قسمتهای بدن گسترش پیدا نکرده اند و تمام تومور قابل مشاهده را میتوان با جراحی برداشت (رزکسیون) کرد.
درجه بالا: اکثر استئوسارکومها درجه بالایی دارند، به این معنی که اگر درمان نشوند احتمالاً به سرعت رشد کرده و گسترش مییابند. درمان معمول این سرطانها به شرح زیر است:
- بیوپسی برای تعیین تشخیص
- شیمی درمانی (chemo)، معمولاً حدود 10 هفته
- جراحی برای برداشتن تومور، ترجیحاً توسط همان جراحی که بیوپسی را انجام داده است، انجام میشود. اگر سرطان در لبه نمونه جراحی یافت شود (به این معنی که ممکن است مقداری سرطان باقی مانده باشد)، ممکن است جراحی دوم برای حذف سرطان باقی مانده انجام شود. رادیوتراپی ممکن است به این ناحیه نیز داده شود.
- شیمی درمانی بیشتر (تا یک سال): اگر شیمی درمانی اولیه بیشتر سلولهای سرطانی را از بین ببرد، همان داروها اغلب پس از جراحی دوباره تجویز میشوند. اگر شیمی درمانی اولیه به خوبی جواب نداد، ممکن است داروهای مختلف آزمایش شوند (اگرچه همه پزشکان موافق نیستند که داروها باید تعویض شوند).
شیمی درمانی بخش بسیار مهمی از درمان این سرطانها است. حتی زمانی که آزمایشهای تصویر برداری نشان نمیدهند که سرطان به قسمتهای دور دست بدن گسترش یافته است، همچنان احتمالاً مناطق بسیار کوچکی از گسترش سرطان وجود دارد که با آزمایشها قابل تشخیص نیستند. اگر شیمی درمانی داده نشود، احتمال بازگشت سرطان پس از جراحی بیشتر است.
در موارد نادر، جراحی ممکن است اولین روش درمانی (قبل از شیمی درمانی) باشد، به خصوص برای افراد مسن.
درجه پایین: تعداد کمی از استئوسارکومها درجه پایینی دارند، به این معنی که احتمالاً به کندی رشد میکنند. بیماران مبتلا به استئوسارکومهای با درجه پایین و قابل برداشت اغلب میتوانند تنها با جراحی (بدون شیمی درمانی) درمان شوند. با این حال، اگر در تستهای آزمایشگاهی مشخص شد که تومور برداشته شده با جراحی، درجه بالایی دارد، ممکن است شیمی درمانی توصیه شود.
استئوسارکوم موضعی و غیر قابل برداشت
این سرطانها به سایر قسمتهای بدن گسترش پیدا نکرده اند اما نمیتوان آنها را بهطور کامل با جراحی برداشت (رزکسیون) کرد. برای مثال، ممکن است خیلی بزرگ یا خیلی نزدیک به ساختارهای حیاتی بدن باشند که به طور کامل برداشته شوند.
مانند سایر استئوسارکومها، ابتدا بیوپسی برای ایجاد تشخیص لازم است.
شیمی درمانی معمولا اولین درمان برای این سرطانها است. اگر تومور به اندازه ای کوچک شود که قابل برداشت باشد، با جراحی برداشته میشود. پس از آن تا یک سال شیمی درمانی بیشتری انجام میشود.
اگر بعد از شیمی درمانی هنوز تومور به طور کامل حذف نشود، اغلب میتوان از پرتو درمانی برای کنترل تومور و کمک به تسکین علائم استفاده کرد. شیمی درمانی بیشتر ممکن است گزینه دیگری باشد، به جای پرتو درمانی یا بعد از آن. اگر اولین رژیم شیمی درمانی خیلی خوب کار نکند، ممکن است داروهای شیمی درمانی مختلف امتحان شوند.
از آن جایی که درمان این تومورها سخت است، آزمایش بالینی درمانهای جدیدتر ممکن است در بسیاری از موارد گزینه خوبی باشد.
استئوسارکوم متاستاتیک
این سرطانها در زمان تشخیص به نقاط دور دست بدن گسترش یافته اند. اغلب آنها به ریهها گسترش یافته اند. مانند سایر استئوسارکومها، ابتدا بیوپسی برای ایجاد تشخیص لازم است.
شیمی درمانی معمولا اولین روش درمانی برای این سرطانها است. اگر تصور شود که همه تومورها پس از شیمی درمانی قابل برداشتن هستند، با جراحی برداشته میشوند، گاهی اوقات در بیش از یک عمل جراحی. پس از آن تا یک سال شیمی درمانی بیشتری انجام میشود.
اگر برخی از تومورها پس از شیمی درمانی غیر قابل برداشت باقی بمانند، اغلب میتوان از پرتو درمانی برای کنترل آنها و کمک به کاهش علائم استفاده کرد. شیمی درمانی بیشتر ممکن است گزینه دیگری باشد، به جای پرتو درمانی یا بعد از آن. اگر اولین رژیم شیمی درمانی خیلی خوب کار نکند، ممکن است داروهای شیمی درمانی مختلف امتحان شوند.
داروهای درمانی هدفمند جدیدتر مانند regorafenib (Stivarga)، سورافنیب (Nexavar) یا Cabozantinib (Cabometyx) نیز ممکن است در برخی مواقع یک گزینه باشند، اگرچه تحقیقات بیشتری برای مشاهده میزان موثر بودن این داروها مورد نیاز است.
از آن جایی که درمان این تومورها سخت است، آزمایشات بالینی درمانهای جدیدتر ممکن است در بسیاری از موارد گزینه خوبی باشد.
استئوسارکوم عود کننده (Recurrent osteosarcoma)
سرطان عود کننده به این معنی است که سرطان پس از درمان بازگشته است. ممکن است به صورت موضعی (نزدیک جایی که اولین تومور بوده) یا در سایر نقاط بدن عود کند. اغلب اوقات، اگر استئوسارکوم عود کند، در ریهها خواهد بود.
در صورت امکان، جراحی برای برداشتن تومور(ها) بخش مهمی از روند درمان است زیرا بهترین شانس را برای بقای طولانی مدت ارائه میدهد. اگر سرطان در محل اصلی بازو یا پا پس از جراحی حفظ اندام عود کند، ممکن است قطع اندام توصیه شود.
شیمی درمانی اغلب بخشی از روند درمان سرطانهای عود کننده نیز میباشد. اگر سرطان قابل برداشتن نباشد، ممکن است از شیمی درمانی برای کوچک کردن تومور(ها) استفاده شود که ممکن است امکان انجام جراحی را فراهم کند. اگر سرطان قابل برداشتن باشد، ممکن است پس از جراحی شیمی درمانی داده شود. برای سرطانهای پیشرفته تر، ممکن است از شیمی درمانی برای کمک به کاهش علائم استفاده شود.
پرتو درمانی نیز ممکن است بخشی از درمان باشد. گاهی اوقات میتواند به کنترل رشد تومور و به تسکین علائم کمک کند.
اگر سرطان همچنان در حال رشد است، داروهای درمانی هدفمند جدیدتر مانند regorafenib (Stivarga)، sorafenib (Nexavar) یا cabozantinib (Cabometyx) نیز ممکن است در برخی مواقع یک گزینه باشند، اگرچه تحقیقات بیشتری برای مشاهده میزان موثر بودن این داروها مورد نیاز است.
از آن جایی که درمان این تومورها سخت است، شرکت در آزمایشات بالینی درمانهای جدیدتر ممکن است گزینه خوبی باشد.
همچنین بخوانید:
- مزوتلیومای بدخیم چیست؟ تعریف، علائم، پیشگیری و درمان
- تومورهای استرومال دستگاه گوارش چیست؟ علائم، تشخیص و درمان
- سرطان تیروئید (Thyroid Cancer) چیست؟ علائم، تشخیص و درمان
- سارکوم بافت نرم چیست؟ انواع، علائم، تشخیص و درمان
مترجم: فاطمه فریادرس




باسلام .من نمونه برداری باز از زانو انجام دادم .جواب پاتولوژی برام ارسال شده .استئوسارکوم پا روستئال. ارتباط بالینی پاتولوژیک و رادیولوژیک ضروری است .میخواستم بدونم منظور از این متن ها چیه .من تومور زانوم بدخیمه یا خوش خیم ؟؟
سلام به پزشک مراجعه کنید