الکتروفورز کپیلاری چیست؟
الکتروفورز روشی برای جداسازی است که در آن حرکت یونها تحت تأثیر الکتریسیته به جداسازی اجزا کمک میکند. انواع مختلفی از الکتروفورز وجود دارد. الکتروفورز ژل (Gel electrophoresis)، الکتروفورز استات سلولی (Cellular acetate electrophoresis) و الکتروفورز کپیلاری از انواع متداول الکتروفورز هستند.
اصول الکتروفورز کپیلاری
سرعت آنالیت (Analyte) هنگام جابجایی تحت تأثیر میدان الکتریکی با شدت “E” توسط تحرک الکتروفورتیک آنالیت (Analyte’s electrophoretic mobility) و تحرک الکترواسموتیک بافر (Buffer’s electroosmotic mobility) در داخل آن کپیلاری مشخص میشود.
تحرک الکتروفورتیک ماده حل شده به ویژگیهای مختلف آن ماده مانند بار الکتریکی، اندازه مولکولی، شکل و خواص بافر نظیر قدرت یونی الکترولیت، pH، ویسکوزیته و مواد افزودنی بستگی دارد. معادله زیر سرعت الکتروفورتیک (electrophoretic velocity (Vep)) محلول را نشان میدهد:
Vep= μepE = (q/6πηr) (V/L)
که در آن η ویسکوزیته محلول الکترولیت، V ولتاژ اعمال شده، L طول آن کپیلاری، r شعاع Stoke ماده حل شده، μep تحرک الکتروفورتیک ماده حل شده، و q بار موثر ماده حل شده است.
هنگامی که میدان الکتریکی از طریق کپیلاری در محیط پر از بافر اعمال میشود، جریان حلالی به نام جریان الکترواسموتیک در داخل کپیلاری ایجاد میکند که سرعت آن به تحرک الکتروفورتیک بستگی دارد. تحرک الکتروفورتیک به چگالی بار دیواره داخلی کپیلاری و خواص بافر بستگی دارد. معادله زیر سرعت الکترواسموتیک (Vlectroosmotic velocity (Veo)) را نشان میدهد:
Veo = μeoE = (ε𝜁/η) (V/L)
که در آن ε= ثابت دیالکتریک بافر، 𝜁= پتانسیل زتا سطح کپیلاری، η ویسکوزیته محلول الکترولیت، V ولتاژ اعمال شده، μeo تحرک الکتروفورتیک و L طول کپیلاری است.
سرعت ماده حل شده (Solute’s velocity (V)) با: V= Vep+Veo به دست میآید.
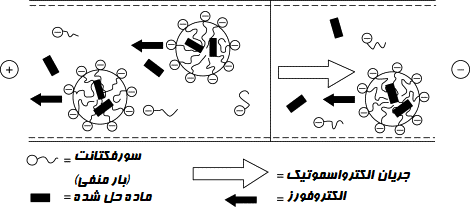
تحرک الکترواسموتیک و الکتروفورتیک آنالیت میتواند بر اساس بار ماده حل شده در جهت موافق یا مخالف عمل کند. در مورد الکتروفورز کپیلاری معمولی، آنیونها در خلاف جهت جریان الکترواسموتیک با سرعتهای کمتر از سرعت الکترواسموتیک حرکت میکنند. در مقابل کاتیونها در همان جهت جریان الکترواسموتیک با سرعتهای بالاتر از سرعت الکترواسموتیک جابجا خواهند شد.
در شرایطی با سرعت الکترواسموتیک سریع در مقایسه با سرعت الکتروفورتیک مواد حل شده، جداسازی کاتیونها و آنیونها در یک اجرا اتفاق میافتد. زمان (t) برای جابجایی ماده حل شده از انتهای کپیلاری به نقطه شناسایی (طول کپیلاری موثر) به صورت زیر محاسبه میشود:
t = l/ Vep+Veo = l(L)/ V( Vep+Veo)

به طور کلی کپیلاریهای سیلیس گداخته شده بدون پوشش در pH بالای سه که دارای بار منفی هستند، در جایی که جریان الکترواسموتیک از آند به کاتد رخ میدهد، استفاده میشوند. برای ایجاد تکرارپذیری خوب در سرعت جابجایی مواد حل شده، جریان الکترواسموتیک باید برای هر اجرا ثابت باشد. برای برخی آزمایشها، کاهش یا جلوگیری از تابش الکترواسموتیک با تغییر دیواره داخلی کپیلاری، غلظت، ترکیب یا pH محلول بافر ممکن است ضروری باشد.
پس از افزودن نمونه، یک ناحیه مستقل از هر یون آنالیت نمونه تشکیل میشود. تشکیل این ناحیه به دلیل جابجایی در الکترولیت زمینه میباشد. ایجاد هر باند از مواد حل شده در نتیجه پدیدههای مختلف رخ میدهد. در شرایط ایده آل، تنها پدیدهای که به بسط ناحیه کمک میکند، انتشار مولکولی ماده حل شده در داخل کپیلاری است. در اینجا، کارایی ناحیه به صورت تعداد سینیهای تئوری (Theoretical plate (N)) ارائه میشود که با را بطه زیر به دست میآید:
N= (μep+μeo) (Vl)/ 2DL
که در آن D ضریب انتشار مولکولی بافر ماده حل شده میباشد.
به طور کلی پدیدههای دیگری مانند طول پلاگین تزریق، اندازه سلول آشکارساز، مخازن بافر نا متوازن، رسانایی ناهماهنگ بین نمونه و بافر، جذب نمونه بر روی دیواره کپیلاری و اتلاف حرارت، نقش مهمی در توسعه باند دارند. جدایی بین دو باند با اصلاح تحرک الکتروفورتیک آنالیتها، تحرک الکترواسموتیک القا شده در کپیلاری و افزایش کارایی هر آنالیت برای آن باند به شرح زیر به دست میآید:
Rs= N(μepb-μepa)/ 4(μaep+μeo)
که در آن μepa و μepb برابر تحرک الکتروفورتیک دو آنالیت و μaep میانگین تحرک الکتروفورتیک دو آنالیت است که با فرمول زیر محاسبه میشود:
μaep= ½ ( μepb+μepa)
قطعات و ابزار الکتروفورز کپیلاری
- منبع تغذیه: الکتروفورز کپیلاری به یک منبع تغذیه جریان مستقیم قابل کنترل با ولتاژ بالا نیاز دارد.
- مخازن بافر: الکتروفورز کپیلاری نیاز به دو مخزن بافری دارد که در یک سطح نگه داشته میشوند و حاوی محلولهای آندی و کاتدی مشخصی هستند.
- الکترودها: CE به دو الکترود (کاتد و آند) غوطهور در مخازن بافر متصل به منبع تغذیه نیاز دارد.
- کپیلاری: یک کپیلاری متشکل از سیلیس گداخته شده، معمولاً با قطر کمتر از 100 میکرون میباشد.
- پنجره مشاهده: CE به یک پنجره مشاهده نوری نیاز دارد که با آشکارساز همتراز باشد.
- سیستم تزریق: CE به یک سیستم تزریق مناسب برای افزودن نمونه و بافر به داخل کپیلاری نیاز دارد. روش تزریق میتواند برای افزایش دقت خودکار باشد. روش رایج تزریق نمونهها شامل گرانش، فشار یا خلاء، یا الکتروکینتیک (Electrokinetic) میباشد.
- آشکارساز: CE به یک آشکارساز برای نظارت بر مقدار مادهای که در یک زمان معین از کپیلاری میگذرد، بر اساس تشخیص هدایت سنجی (Conductimetric)، فلورمتری (Fluorimetry)، اسپکتروفتومتری جذبی (Absorption spectrophotometry) (UV و مرئی)، آمپرومتریک (Amperometric) یا طیفسنجی جرمی (Mass spectrometric) نیاز دارد.
- سیستم ترموستاتیک (Thermostatic system): CE به یک سیستم ترموستاتیک برای حفظ دمای ثابت در داخل کپیلاری نیاز دارد.
- ضبط کننده: CE به یک ضبط کننده نیاز دارد که دادهها را پس از اتمام الکتروفورز ثبت میکند.
- یکپارچه ساز یا کامپیوتر مناسب: CE همچنین به یکپارچه ساز یا کامپیوتر مناسب برای تبدیل دادهها به صورت دیجیتالی نیاز دارد.
انواع روشهای الکتروفورز کپیلاری
شش نوع روش الکتروفورز کپیلاری که معمولاً استفاده میشوند، وجود دارد.
- CZE (الکتروفورز کپیلاری ناحیهای (Capillary zone electrophoresis))
- CGE (الکتروفورز ژل کپیلاری (Capillary gel electrophoresis))
- کروماتوگرافی کپیلاری الکترو کینتیک میسلی (Micellar electro kinetic capillary chromatography (MEKC))
- الکتروکروماتوگرافی کپیلاری (Capillary electrochromatography (CEC))
- تمرکز ایزوالکتریک کپیلاری (capillary isoelectric focusing (CIEF))
- ایزوتااکوفورز کپیلاری (Capillary isotachophoresis (CITP))
الکتروفورز کپیلاری ناحیهای
جداسازی در این نوع الکتروفورز به یک کپیلاری با تنها یک بافر بدون هیچ گونه محیط Anticonvective نیاز دارد. آنالیتها به باندهایی تقسیم میشوند که سرعت آنها به تحرک الکتروفورتیک و جریان الکترواسموتیک بستگی دارد.
جریان الکترواسموتیک به سمت کاتد حرکت میکند و هنگامی که قطبیت معکوس شد، آنالیتهایی با تحرک الکترواسموتیک بالاتر از نیروی الکترواسموتیک از خروجی عبور میکنند. کپیلاریهای پوشش داده شده به افزایش ظرفیت جداسازی موادی که به سطوح سیلیس گداخته شده میچسبند، کمک میکند. CZE در آنالیز کوچک به بزرگ (بیشتر از وزن ملکولی 2000 تا کمتر از وزن ملکولی 100.000) قابل استفاده است. این روش یک شکل بسیار کارآمد از الکتروفورز کپیلاری است.
الکتروفورز ژل کپیلاری (CGE)
جداسازی در الکتروفورز ژل کپیلاری در یک کپیلاری مملوء از ژل انجام میشود که به عنوان یک غربال مولکولی کاملاً شبیه به الکتروفورز ژل عمل میکند. مولکولها بر اساس اندازه مولکولی جدا میشوند. مولکولهای کوچکتر آزادانهتر از طریق شبکه ژل حرکت میکنند. از این رو این مولکولها سریعتر از مولکولهای بزرگتر جابجا میشوند. الکتروفورز ژل کپیلاری برای جداسازی پروتئینها، قطعات DNA و سایر ماکرومولکولهای بیولوژیکی با نسبتهای بار به جرم مشابه بر اساس اندازه مولکولی آنها، استفاده میشود.
کروماتوگرافی کپیلاری الکتروکینتیک میسلی (MEKC)
جداسازی در محلول الکترولیتی که از یک سورفکتانت (Surfactant) با غلظت بالاتر از غلظت بحرانی میسلی (Critical micellar concentration (CMC)) تشکیل شده است، رخ میدهد. این تکنیک ترکیبی از الکتروفورز و کروماتوگرافی است. این روش هم برای املاح خنثی و هم املاح باردار قابل استفاده است. مولکولهای ماده حل شده بین فاز شبه ایستا متشکل از میسلها و بافر آبی بر اساس ضریب تقسیم ماده حل شده، توزیع میشوند.
سورفکتانت متداول مورد استفاده در MKEC عبارت است از:
- سدیم دودسیل سولفات (Sodium dodecyl sulfate)
- ستیل تریمتیل (Cetyl trimethyl)
- نمکهای آمونیوم
در pH خنثی و قلیایی، جریان الکترواسموتیک قوی است و یونهای بافر جداسازی به سمت جهت کاتد حرکت میکنند. در صورتی که سدیم دودسیل سولفات (SDS) به عنوان سورفکتانت استفاده شود، جابجایی الکتروفورتیک میسل آنیونی به سمت آند است و سرعت کلی جابجایی میسل را در جریان حجمی محلول الکترولیتی کاهش میدهد.
فرض کنید املاح خنثی وجود دارد. در این صورت آنالیت بین بافر آبی و میسل تقسیم شده و فاقد تحرک الکتروفورتیک است. در چنین مواردی، سرعت مهاجرت آنالیت به ضریب تقسیم بین بافر آبی و میسل بستگی دارد. به همین دلیل، جداسازی در املاح خنثی و ضعیف یونیزه شده در MKEC به صورت کروماتوگرافی است. در مورد املاح باردار، سرعت مهاجرت به تحرک الکتروفورتیک ماده حل شده بدون میسل و ضریب تقسیم بین بافر آبی و میسل بستگی دارد.
الکتروکروماتوگرافی کپیلاری (CEC)
الکتروکروماتوگرافی کپیلاری یک تکنیک جداسازی ترکیبی است که هم از اصول الکتروفورز کپیلاری و هم از اصول کروماتوگرافی به ویژه کروماتوگرافی مایع با کارایی بالا (High-performance liquid chromatography (HPLC)) استفاده میکند. آنالیتها بر اساس تفاوت در نسبت تقسیم بین فاز متحرک و ساکن یا به دلیل تحرک الکتروفورتیک جدا میشوند.
فاز متحرک در سراسر بستر کروماتوگرافی با کمک نیروی الکترواسموتیک به جای فشار اجرا میشود. CEC مزیت بیشتری نسبت به HPLC و الکتروفورز کپیلاری دارد. این روش برای جداسازی انانتیومری (Enantiomeric)، جداسازی اسیدهای آمینه، پروتئینها، پپتیدها و کربوهیدراتها کاربرد دارد و عمدتاً در صنایع داروسازی برای شناسایی داروهای اسیدی و بازی و در بخش صنعتی جهت آنالیز پلیمرها استفاده میشود.
تمرکز ایزوالکتریک کپیلاری (CIEF)
مولکولهای باردار به خاطر میدان الکتریکی در تمرکز ایزوالکتریک در یک گرادیان pH حاصل از آمفولیتهای (Ampholyte) دارای محدوده وسیعی از مقدار pI (نقطه ایزوالکتریک (Isoelectric point)) که در بافر جداسازی حل شدهاند، جابجا میشوند.
سه مرحله در CIEF وجود دارد:
- بارگذاری
- تمرکز
- متحرکسازی
در مرحله بارگذاری، کپیلاری با آمفولیتها و بافر جداسازی پر میشود. در مرحله تمرکز، ولتاژی در کپیلاری اعمال میشود و باعث میگردد آمفولیتها بر اساس بارهای خالص خود به سمت الکترود مربوطه حرکت کنند و یک گرادیان pH ایجاد کنند که در آن مولکولها جابجا میشوند تا زمانی که به pH مربوط به pI (نقطه ایزوالکتریک) خود برسند. متحرکسازی میتواند برای تشخیص مورد نیاز باشد که بسته به جهت حرکت، با تمرکز تحت تأثیر جریان الکترواسموتیک، اعمال فشار مثبت پس از فوکوس، یا افزودن نمک به مخزن آند یا کاتد، به دست میآید.
ایزوتااکوفورزیس کپیلاری (CITP)
این تکنیک برای جداسازی لیپوپروتئینهای سرم توسعه داده شده است. در مقایسه با سایر فرآیندهای الکتروفورتیک، دارای اثرات غربال مولکولی ناچیز بوده، نیازی به ریختهگری ژلی (Gel casting) ندارد، برای کل سرم قابل استفاده است و میتواند به راحتی افتراق زیربخشهای لیپوپروتئین را انجام دهد.
در اینجا، کل لیپوپروتئینهای سرم در یک سیستم کپیلاری جریان آزاد (با قطر داخلی 0.5 میلیمتر) دارای یک سیستم بافر ناپیوسته به مدت 30 دقیقه در دمای 4 درجه سانتیگراد قبل از شروع فرآیند، از قبل رنگآمیزی میشوند. لیپوپروتئینها بر اساس تحرک الکتروفورتیک به HDL (لیپوپروتئینهای با چگالی بالا) و LDL (لیپوپروتئینهای با چگالی کم) تقسیم میشوند. این روش معمولاً در آزمایشگاههای بالینی برای تعیین سطح لیپوپروتئین در سرم انسان استفاده میشود.
کاربردهای الکتروفورز کپیلاری
الکتروفورز کپیلاری معمولاً در زمینههای مختلفی به کار میرود. آنالیز محتویات مواد غذای، افتراق ژنتیکی و تشخیص بالینی از کاربردهای معمول الکتروفورز کپیلاری هستند. در زیر توضیحات مفصلی در حوزه کاربردهای الکتروفورز کپیلاری ارائه شده است:
- فناوری مواد غذایی: الکتروفورز کپیلاری برای آنالیز مواد غذایی مختلف مانند نوشیدنیها و مواد غذایی تخمیر شده برای تشخیص فلاونوئیدها (Flavonoid)، ویتامینها، کربوهیدراتها، پروتئینها، رنگدانهها و رنگ استفاده میشود. CE همچنین برای شناسایی DNA و RNA از باکتریها و ویروسها که نشان دهنده آلودگی است، کاربرد دارد.
- آنالیز مولکولی: DNA، RNA و اسیدهای آمینه با استفاده از الکتروفورز کپیلاری، به ویژه در آزمایشگاههای میکروبیولوژی و علوم پزشکی قانونی شناسایی میشوند.
- تشخیص بیماری: آنالیز پانل لیپید (Lipid profile) با استفاده از CITP برای تشخیص سطح کلسترول در آزمایشگاههای بالینی حیاتی است. همچنین، آنالیز ویتامینها و مواد معدنی سرم انسان با استفاده از الکتروفورز کپیلاری انجام میشود.
- پایش محیطی: الکتروفورز کپیلاری برای ردیابی یونهای معدنی در رودخانهها و آب استفاده شده است. به علاوه، الکتروفورز نانو کپیلاری برای شناسایی آلایندههای محیطی در سطح نانو به کار میرود.
- آزمایشگاههای داروسازی: الکتروفورز کپیلاری در آنالیز مولکولهای کوچک در داروها هنگام انجام آمادهسازی مراحل و محلولهای استاندارد استفاده میشود.

مزایای الکتروفورز کپیلاری
الکتروفورز کپیلاری به دلیل استفاده از کپیلاریهای ریز برای جداسازی، مزایای زیادی نسبت به سایر روشهای الکتروفورز و کروماتوگرافی دارد. در زیر به طور کامل درباره مزایای الکتروفورز کپیلاری توضیح داده شده است:
- بسیار کارآمد: اتلاف گرما به دلیل استفاده از قطر کم کپیلاری به طور موثر رخ میدهد. برخی از مقالات ادعا میکنند که کارایی الکتروفورز کپیلاری کاملاً مشابه با کروماتوگرافی مایع است.
- زمانبری کمتر: اگر فرد با نرم افزارهای کامپیوتری آشنا باشد، خواندن نتیجه جداسازی زمانی نمیبرد. به همین ترتیب، کل فرآیند از راه اندازی تا جداسازی تنها یک ساعت طول میکشد. بنابراین الکتروفورز کپیلاری مزایای بیشتری در مقایسه با سایر تکنیکهای جداسازی دارد.
- حوزه کاربرد وسیع: الکتروفورز کپیلاری در آنالیز ماکرومولکولهایی مانند پروتئینها، DNA، داروهای مختلف و RNA استفاده میشود. بنابراین CE به طور گستردهای از نظارت دارویی گرفته تا نظارت بر محیط زیست به کار میرود.
- دارای امکان خودکارسازی: روش تزریق، آنالیز دادهها، بافر و مراحل بارگذاری نمونه را میتوان در الکتروفورز کپیلاری خودکار کرد.
معایب الکتروفورز کپیلاری
اگرچه الکتروفورز کپیلاری بسیار سودمند است، اما دارای معایبی نیز داردکه در زیر شرح داده شده است:
- عوض کردن کپیلاریها چالش برانگیز است: با توجه به اندازه کپیلاریها، برداشتن و جایگزینی آنها گاهی اوقات میتواند چالش برانگیز باشد. بنابراین برای عوض کردن کپیلاریها به تجربه و تخصص نیاز است.
- مقاومت کمتر: تغییرات کوچک مانند اندازه کپیلاریها و انتخاب آنالیتها میتوانند در الکتروفورز کپیلاری بسیار مهم باشند. بنابراین CE نسبت به سایر روشها از مقاومت کمتری در برابر تغییرات برخوردار است.
همچنین بخوانید:
- الکتروفورز مویرگی چیست؟
- الکتروفورز افقی-ژل آگارز
- الکتروفورز عمودی- اکریل آمید
- تفاوت بین ژل آگارز و پلی اکریل آمید چیست؟
مترجم: صادق حسینیکیا




