اطلاعات عمومی، ویکی ژن
انواع ساختار پروتئینها با شکل
مقدمهای بر انواع ساختار پروتئینها
پروتئینها مولکولهای بیولوژیکی پیچیدهای هستند که از اسیدهای آمینه تشکیل شدهاند. آنها ساختارهای پلی پپتیدی هستند که از زنجیرههای طولانی اسیدهای آمینه تشکیل شدهاند. پروتئینها یکی از فراوانترین مولکولهای آلی هستند که عملکردهای مختلفی را در موجودات زنده انجام میدهند.
آن ها به عنوان اجزای ساختاری، کاتالیزورها، هورمونها، آنزیمها و تنظیم کننده فرآیندهای سلولی عمل میکنند. پروتئینها همچنین در همانندسازی DNA، انتقال مولکولها، کاتالیز واکنشهای متابولیک و به عنوان یکی از اجزای ساختاری سلولها نقش دارند.
ساختار پروتئین آرایش سه بعدی اتمها در یک پروتئین است. هزاران پروتئین در هر سلول در یک سیستم زنده وجود دارد که هر کدام عملکرد و ساختار منحصر به فردی دارند. ساختار منحصر به فرد پروتئینها عملکرد آنها را تعیین میکند. درک ساختار پروتئینها مهم است زیرا مکانیسم درگیر در فرآیندهای سلولی مختلف را نشان میدهد.
مبانی ساختار پروتئین بلوکهای ساختمانی پروتئینها اسیدهای آمینه هستند. اینها مولکولهای آلی هستند که حاوی یک اتم کربن مرکزی، یک گروه آمینه، یک گروه کربوکسیل و یک زنجیره جانبی متمایز هستند.
این اسیدهای آمینه توسط پیوندهای پپتیدی به یکدیگر متصل شده و زنجیرههای پروتئینی طولانی را تشکیل میدهند. در این زنجیره، دو انتها وجود دارد:
نقطه شروع، پایانه آمین (N-terminus) و نقطه پایان، پایانه کربوکسیل (C-terminus) نامیده میشود.
پروتئینها تنها از بیست اسید آمینه ساخته میشوند که هر کدام دارای یک زنجیره جانبی مجزا هستند. هر زنجیره جانبی آمینواسید خواص متفاوتی دارد. خواص منحصر به فرد زنجیرههای جانبی نقش مهمی در شکل دادن به ویژگیهای پروتئین دارد. برخی از زنجیرههای جانبی اسیدی یا بازی هستند که به ترجیح پروتئین برای محیطهای اسیدی یا بازی کمک میکند. برخی دیگر قطبی هستند و پروتئین را محلول در آب میکنند، در حالی که زنجیرههای جانبی غیرقطبی پروتئین را در لیپیدها محلول میکنند.
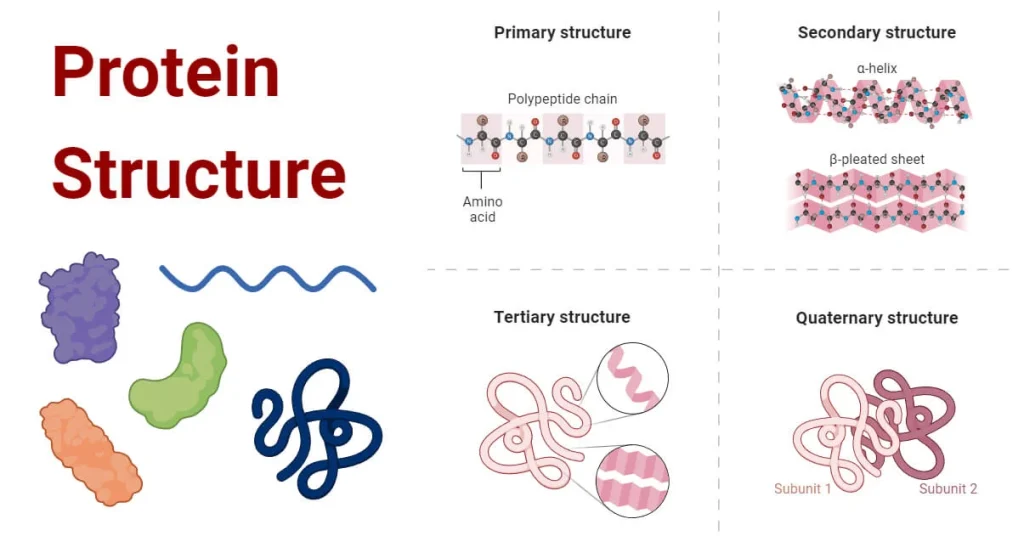
سطوح ساختار پروتئین بر اساس سطح ساختار، پروتئینها را میتوان به چهار سطح ساختاری طبقهبندی کرد:
- ساختارهای اولیه
- ثانویه
- سوم
- چهارم
-
ساختار اولیه پروتئین
اولین سطح ساختار پروتئین، ساختار اولیه است که به عنوان توالی خطی اسیدهای آمینه که توسط پیوندهای پپتیدی به یکدیگر متصل میشوند، تعریف میشود. ساختار اولیه توسط پیوندهای پپتیدی و دی سولفیدی حفظ میشود.
ساختار اولیه پروتئین با ترتیب خاصی که در آن کد ژنتیکی از ژن مربوطه خوانده شده تعیین میشود. این اطلاعات ژنتیکی از DNA به mRNA رونویسی میشود و سپس توسط ریبوزومها به دنبالهای از اسیدهای آمینه ترجمه شده و یک زنجیره پپتیدی تشکیل میدهد.
این زنجیرههای پلیپپتیدی، اگرچه در ابتدا خطی هستند، اما به شکلهای سهبعدی خاصی جمع میشوند و به پروتئینها ساختار فضایی منحصربهفرد و پایدار میدهند.
ویژگیهای آمینو اسیدهای خاص در ساختار اولیه بر نحوه تا شدن پروتئینها در سطوح ثانویه، سوم و چهارم تأثیر میگذارد.
حتی یک تغییر کوچک در یک اسید آمینه به دلیل یک جهش ژنتیکی میتواند منجر به تغییرات قابل توجهی در ساختار کل پروتئین شود. به عنوان مثال، در کم خونی داسی شکل، یک تغییر اسید آمینه میتواند بر عملکرد هموگلوبین تأثیر بگذارد.

-
ساختار ثانویه پروتئین
ساختار ثانویه یک پروتئین، آرایش فضایی خاص یک بخش پپتیدی خاص است. این به روش خاصی اشاره دارد که بقایای اسید آمینه نزدیک به هم در زنجیره پلی پپتیدی قرار میگیرند.
این آرایش در مناطق خاصی رخ میدهد که زنجیره به صورت محلی تا میشود و ساختار ثانویه پروتئین را تشکیل میدهد.
این سطح از ساختار شامل ترکیب چین خورده یا پیچ خورده پلی پپتیدهایی است که توسط پیوندهای هیدروژنی تثبیت میشوند.
دو ساختار ثانویه رایج پروتئینها عبارتند از ورقههای آلفاهلیکس و صفحات بتا.
- مارپیچ α: مارپیچ α ساختاری استوانهای است که زمانی ایجاد میشود که زنجیرهای از اسیدهای آمینه به دور خود بپیچد. مارپیچهای آلفا حاوی اسیدهای آمینه به صورت پیچشی یا مارپیچی هستند. در این مارپیچ، یک پیوند هیدروژنی هر چهارمین حلقه زنجیره آمینو اسید را به هم متصل میکند. این الگوی پیوند باعث ایجاد یک مارپیچ منظم میشود که هر 3.6 اسید آمینه یک چرخش کامل را تکمیل میکند. مارپیچ α در پروتئینهای موجود در غشای سلولی، مانند پروتئینهای انتقالی، رایج است.

- ورقه بتا شیت: ورقههای بتا یک عنصر ساختاری رایج در پروتئینهایی هستند که توسط رشتههای آمینواسیدهای مجاور تشکیل میشوند، جایی که زنجیرههای پلی پپتیدی همسایه در کنار هم قرار گرفته و با پیوندهای هیدروژنی به هم متصل میشوند. این ورقهها میتوانند به دو صورت تشکیل شوند: با زنجیرههای مجاور که در یک راستا قرار دارند (ورقههای بتای موازی) یا با زنجیرههایی که در جهت مخالف هم قرار دارند (ورقههای بتای غیر موازی). در هر دو نوع، الگوهای پیوند هیدروژنی متمایز رخ میدهد که باعث ایجاد ساختار خاص صفحات بتا میشود. صفحات بتا به ساختار پایدار و سفت و سخت پروتئینها کمک میکنند.
-
ساختار سوم پروتئین
ساختار سوم یک پروتئین به آرایش سه بعدی تمام اتمهای یک پروتئین اشاره دارد که پس از چین خوردگی و پیچش بیشتر زنجیره پلی پپتیدی تشکیل میشود.
این آرایش توسط فعل و انفعالات زنجیرههای جانبی ستون فقرات پلی پپتیدی تعیین میشود.
ساختار سوم پروتئین با پنج نوع برهمکنش تثبیت میشود: برهمکنش آبگریز، برهمکنش یونی، پیوند هیدروژنی، برهمکنش واندروال و پیوند دی سولفید.
ساختار سوم همچنین شامل تشکیل ساختارهای زنجیره جانبی بر اساس ساختار ستون فقرات پپتیدی است. این ترکیبات مناطق متمایزی را ایجاد میکنند که به عنوان دامنههای پروتئینی شناخته میشوند. این حوزهها ساختارهای کروی و محکمی در یک زیر واحد پروتئینی دارند.

یک پروتئین ممکن است حاوی یک یا چند دامنه منحصر به فرد باشد که توسط نواحی حلقه متصل شدهاند. این دامنهها معمولاً حاوی 100 تا 200 باقی مانده اسید آمینه هستند و به خواص عملکردی و ساختاری پروتئین کمک میکنند.
-
ساختار کواترنری پروتئین (ساختار چهارم)
پروتئینهای حاوی بیش از یک زنجیره پلی پپتیدی سطح چهارمی از سازماندهی ساختاری به نام ساختار چهارتایی را نشان میدهند. هر زنجیره پلی پپتیدی در چنین پروتئینهایی به عنوان یک زیرواحد شناخته میشود.
ساختار چهارم به عنوان آرایش فضایی این زیر واحدها و برهمکنشهای آنها تعریف میشود.
سادهترین نوع ساختار چهارم شامل دو زیر واحد یکسان است که یک دایمر را تشکیل میدهند. با این حال، ساختارهای چهارتایی پیچیدهتر نیز رایج هستند.

ساختار چهارم از فعل و انفعالات بین زنجیرههای جانبی دو یا چند پلی پپتید تشکیل میشود و بر شکل کلی پروتئین تأثیر میگذارد.
هر زیر واحد ساختارهای اولیه، ثانویه و سوم خود را دارد که توسط هیدروژن و نیروهای واندروالس در کنار هم نگه داشته میشوند.
زیر واحدها باید دقیقا سازماندهی شوند تا کل پروتئین به درستی کار کند. هر گونه تغییر در نحوه ساختار زیر واحدها میتواند به طور قابل توجهی بر عملکرد بیولوژیکی پروتئینها تأثیر بگذارد.
روشهای مطالعه ساختار پروتئین
تکنیکهای مختلفی برای تعیین ساختارهای پروتئینی مانند کریستالوگرافی اشعه ایکس، طیف سنجی NMR (رزونانس مغناطیسی هسته ای) و میکروسکوپ الکترونی استفاده میشود که هر کدام مزایا و معایب خود را دارند.
کریستالوگرافی اشعه ایکس یکی از روشهای رایج برای تعیین ساختار پروتئین است. این شامل متبلور کردن پروتئین و قرار دادن آن در معرض اشعه ایکس است. الگوی پراش اشعه ایکس برای ایجاد یک نقشه چگالی الکترون تجزیه و تحلیل میشود، که سپس برای تعیین مکان هر اتم در پروتئین تفسیر میشود. این روش اطلاعات اتمی دقیقی در مورد پروتئینها و سایر مولکولهای موجود در کریستال ارائه میدهد. با این حال، برای پروتئینهای سفت و سخت که کریستالهای منظمی را تشکیل میدهند، بهترین کار را دارد، در حالی که بررسی پروتئینهای انعطاف پذیر به دلیل نیاز به هم ترازی مولکولی دقیق، دشوارتر است.
طیف سنجی NMR روش مهم دیگری است که برای مطالعه ساختار پروتئین استفاده میشود. این شامل قرار دادن پروتئینهای خالص شده در یک میدان مغناطیسی و بررسی آنها با امواج رادیویی است. رزونانسهای حاصل اطلاعاتی در مورد ترکیب اتمها ارائه میدهند که برای ایجاد مدلی از ساختار پروتئین استفاده میشود. NMR برای مطالعه پروتئینهای انعطاف پذیر در محلول، بر خلاف روشهای دیگر که نیاز به کریستالیزاسیون دارند، ارزشمند است. پروتئینهای بزرگ میتوانند چالشهایی را به دلیل همپوشانی پیکها در طیفهای NMR ایجاد کنند.
میکروسکوپ الکترونی (3DEM) تکنیکی است که برای تعیین ساختارهای سه بعدی مولکولهای بزرگ استفاده میشود. این شامل تصویربرداری از مولکولهای زیستی با استفاده از پرتوهای الکترونی و عدسی است. Cryo-EM، یک روش متداول، ذرات منفرد را در یخ میگیرد و تصاویر دوبعدی ایجاد میکند. این تصاویر به صورت محاسباتی برای تولید نقشههای چگالی سه بعدی پردازش میشوند. این نقشهها با برازش مدلهای اتمی در آنها تفسیر میشوند. پیشرفتهای اخیر در آماده سازی نمونه، آشکارسازها و پردازش دادهها 3DEM را به طور قابل توجهی بهبود بخشیده است.
دادههای تجربی مانند الگوهای پراش اشعه ایکس، جزئیات اتمی NMR یا اشکال مولکولی کلی از میکروسکوپ الکترونی به تنهایی همیشه برای ایجاد یک مدل اتمی کامل کافی نیستند. ابزارهای محاسباتی نیز برای تجزیه و تحلیل توالی پروتئین و پیشبینی ساختارها پدید آمده اند.
هومولوژی مدلینگ یکی از این روشهای محاسباتی است که برای پیشبینی ساختار سهبعدی یک پروتئین استفاده میشود. این متکی بر ساختار پروتئین شناخته شده (الگو) است که ارتباط نزدیکی با پروتئین مورد مطالعه دارد. با مقایسه توالی اسید آمینه پروتئین هدف و الگو، محققان میتوانند مدلی از ساختار پروتئین هدف ایجاد کنند.
همچنین بخوانید:
- مولکول پروتئین چیست؟
- بیان پروتئین چیست؟
- هومولوژی مدلینگ (Homology Modeling) چیست؟
- آشنایی کامل با انواع میکروسکوپ
- طیف سنجی NMR: تعریف، اصول، مراحل، اجزا و موارد استفاده
مترجم: شقایق مرتاضی