اطلاعات عمومی
تاشدن پروتئین ها چیست؟
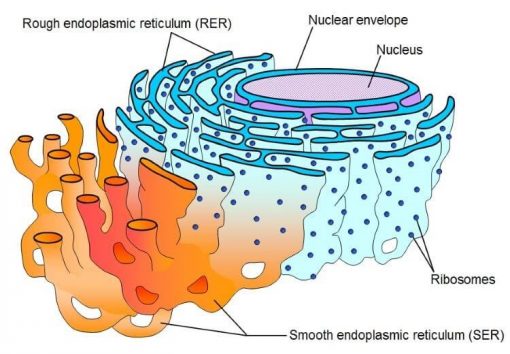
شبکه آندوپلاسمی (ER) محل مهمی برای تا شدن و بلوغ پروتئین در یوکاریوتها است. نیاز سلولی برای سنتز پروتئین در شبکه اندوپلاسمی با ظرفیت تا شدن آن مطابقت دارد. با این حال، خواستههای فیزیولوژیکی یا انحرافات در تا شدن ممکن است منجر به عدم تعادل شود که میتواند منجر به تجمع پروتئین تا نشده ، که به عنوان “استرس ER” نیز شناخته میشود، شود. واکنش پروتئینی باز شده (UPR) یک سیستم سیگنال دهی سلولی است که ظرفیت تا شدن ER را برای بازگرداندن هموستاز پروتئین تنظیم میکند. فعال کننده کلید سیگنال UPR ، IRE1 ، با انتشار سیگنال UPR از ER به سیتوزول به استرس پاسخ میدهد.
شبکه آندوپلاسمی محل اصلی برای تا شدن و بلوغ پروتئین در داخل سلول یوکاریوتی است. پروتئینهایی که در شبکه اندوپلاسمی قرار دارند، همراه با پروتئینهایی که برای گلژی، غشای پلاسمایی و فضای خارج سلولی در نظر گرفته شدهاند، در ریبوزومهایی که به غشای شبکه اندوپلاسمی متصل شدهاند، سنتز میشوند. پلی پپتید تازه ترجمه شده دارای یک دنباله سیگنال N ترمینال است که توسط ذره تشخیص سیگنال (SRP) تشخیص داده میشود، که باعث میشود از طریق کمپلکس transolocon وارد شبکه اندوپلاسمی شود. پس از ورود به سیستم ER ، توالی سیگنال توسط سیگنال پپتیداز شکافته میشود و پلی پپتید منتقل شده تحت اصلاح بعد از ترجمه و تا شدن با کمک چاپرون قرار میگیرد تا به شکل سه بعدی صحیح آن کمک کند. آنزیمها و چاپرونهای مقیم در شبکه اندوپلاسمی وجود دارد که کارایی تا شدن پروتئین پلی پپتید نوپا را افزایش میدهد. یکی از فراوانترین پروتئینها در شبکه اندوپلاسمی، چاپرون از نوع Hsp70 ، BiP است. BiP به زنجیرههای پلی پپتیدی تازه متصل میشود تا در ابتدا از تجمع آنها جلوگیری شود. و متعاقباً، تا شدن آنها را تسهیل میکند تا پلی پپتید به ترکیب اصلی خود برسد. اصلاحات پس از ترجمه نیز برای تا شدن صحیح پروتئین بسیار مهم است و یکی از این تغییرات ایجاد پیوند دی سولفیدی است.این پیوند برای حفظ ساختار پروتئین سوم و چهارم اهمیت دارد و توسط پروتئین دی سولفید ایزومراز (PDI) کاتالیز میشود. یکی دیگر از تغییرات اساسی، اتصال الیگوساکاریدهای متصل به N به زنجیره نوپا است که با ورود به شبکه اندوپلاسمی ایجاد میشود. هنگامی که وارد شبکه اندوپلاسمی میشوید، تعدادی آنزیم گلیکوزیله کننده وجود دارد که بسته به پیشرفت چین خوردگی پروتئین، یا برش میدهند و یا به الیگوساکارید مرتبط با هسته N اضافه میکنند.این تغییرات در زنجیره گلیکان به نظارت بر وضعیت تا شدن پلی پپتید نوپا کمک میکند و به عنوان یک معیار مهم کنترل کیفیت عمل میکند.
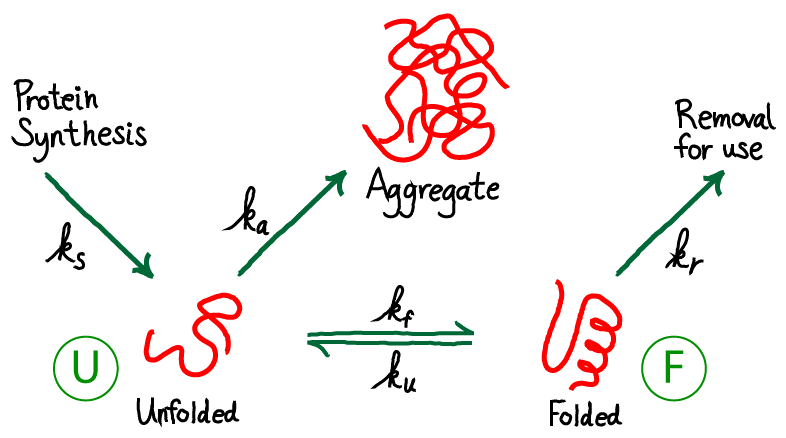
شکست در زنجیره پلی پپتیدی در اتخاذ ترکیب بومی خود ممکن است منجر به فعال شدن مسیرهای تخریب، از جمله تخریب مرتبط با ER (ERAD) شود. در این فرآیند، پروتئین تا شده اشتباه در سراسر غشای شبکه اندوپلاسمی به سیتوزول منتقل میشود، جایی که در همه جا وجود دارد و از طریق پروتئازوم 26S تجزیه میشود. با این حال، اگر پلی پپتید شکل صحیح خود را اتخاذ کند، میتواند به گلژی منتقل شده و از طریق مسیر ترشحی بیشتر پیشرفت کند.در واقع توضیح ساده شدهی این فرایند به این شکل است:
زمانی که پروتئین وارد شبکه اندوپلاسمی میشود توسط دو آنزیم گلیکوزیدآز1 و گلیکوزیدآز2 ، دو واحد از گلوکزها برداشته میشود.(همانطور که میدانیم 14 واحد قندی در شکلگیری گلیکوساکارید دخالت دارد: 2 N استیل گلوکز آمین / 9 مانوز / 3 گلوکز) در نتیجه یک واحد گلوکز باقی میماند. این واحد باقی مانده برای پروتيین های calnexin و calreticulin (2 پروتيین مهم خانواده چاپرونها) مثل نشانه عمل میکند.سپس calnexin و calreticulin این پروتئین را در برمیگیرند و هولدینگ مناسب را ایجاد میکنند. پس از ایجاد هولدینگ مناسب گلوکز باقی مانده هم حذف میشود.پروتئینی که تاخوردگی مناسب پیدا کرده از غشا شبکه اندوپلاسمی ریلیز میشود و به سمت دستگاه گلژی حرکت میکند اما اگر پروتئین تاخوردگی مناسب خودش را پیدا نکند( misfold) فرصت دوبارهای به پروتئین داده میشود تا به سمت calnexin و calreticulin حرکت کند و مجدد تاخورده شود.برای رفتن به سمت calnexin و calreticulin نیاز دارد که 1 گلوکز روی آن قرار بگیرد چون هر سه گلوکز خود را از دست داده، آنزیمی به نام گلیکوساکارید ترانسفرآز یک گلوکز روی آن قرار میدهد و به این ترتیب این پروتئین دوباره به سمت calnexin و calreticulin حرکت میکند تا تاخورده شود.اگر با این چرخش مجدد هم دوباره هولدینگ مناسب را پیدا نکرد، آنزیمهایی به نام مانوزیدآز مانوزهای پروتئین را حذف میکند.وقتی پروتئینی که مانوزهایش را از دست داده در لومن شبکه اندوپلاسمی پدیدار میشود، پروتئینی به نام OS9 که در لومن شبکه اندوپلاسمی وجود دارد این پروتئین را میشناسد و آن را به سمت ترانس لوکانها در غشا شبکه اندوپلاسمی هدایت میکند و کمک میکند این پروتئین از شبکه اندوپلاسمی به سمت سیتوپلاسم حرکت کند و در نهایت این پروتئین در سیتوپلاسم تجزیه و دگرده میشود.
محیط داخل شبکه اندوپلاسمی نسبت به سیتوزول اکسید کنندهتر است. این امر منجر به تشکیل پیوندهای دی سولفیدی میشود، که عمدتا در ER رخ میدهد. علاوه بر این، غلظت بالای کلسیم به جلوگیری از چین خوردن پروتئین کمک میکند ، به ویژه اینکه بسیاری از چاپرونهای ER برای عملکرد موثر به کلسیم به عنوان عامل مشترک نیاز دارند.
بسته به نوع سلول، الزامات تا شدن پروتئین در شبکه اندوپلاسمی متفاوت است. برای سلولهای ترشحی تخصصی مانند سلولهای پلاسما، سلولهای β تولید کننده انسولین یا سلولهای بدخیم بسیار تکثیر کننده، که میزان سنتز پروتئین افزایش یافته است، تقاضا برای تا شدن پروتئین مولد میتواند بسیار بیشتر از یک سلول معمولی باشد. جریان داخلی پلی پپتیدهای نوپا به ER میتواند ماشینهای تاشو پروتئین را تحت فشار قرار دهد، که منجر به عدم تعادل و تجمع پروتئینهای تا نشده میشود که برای سلول سمی است. این عدم تعادل به عنوان “استرس ER” شناخته میشود. در کنار افزایش سنتز پروتئین، عوامل متعددی وجود دارند که باعث ایجاد استرس ER میشوند. این عوامل عبارتند از: محرومیت از مواد مغذی-به ویژه اینکه تا شدن پروتئین یک فرآیند مصرف انرژی است. نقص در تغییرات پس از ترجمه ؛ انحراف در سطح کلسیم و هموستاز ردوکس ؛ ناکارآمدی در مسیرهای تخریب مانند ERAD و اتوفاژی ؛ استرس دو لایه چربی ؛ و سطح اکسیژن پایین که منجر به هیپوکسی میشود.
به منظور بازگرداندن ظرفیت تا شدن پروتئین با الزامات سنتز پروتئین، یک شبکه هماهنگ رونویسی و ترجمه ای به نام واکنش پروتئین باز نشده (UPR) آغاز می شود. UPR سطح تا شدن پروتئین را در ER کنترل میکند و ظرفیت تاشو را برای مطابقت با بار سنتز تنظیم میکند، بنابراین تعادل موفقیت آمیزی را برای هموستاز پروتئین تضمین میکند.
یک مرحله مهم در سیگنال دهی UPR ، تشخیص اولیه استرس ER است، فرآیندی که طی آن پروتئینهای باز شده و تا نشده به وسیله UPR تشخیص داده میشوند و منجر به فعال سازی و سیگنالینگ پایین دست میشوند.
هدف اصلی UPR بازگرداندن هموستاز پروتئین ER به منظور اطمینان از بقای سلول است. با این حال، فعال سازی مداوم، ناشی از استرس شدید ER ، منجر به یک سوئیچ سیگنال دهی میشود که از آپوپتوز و خروجی مرگ سلولی حمایت میکند.
مترجم: غزل زارعی
مطالعه صدها مطلب علمی در حوزه بیولوژی
آرشیو جدیدترین خبرهای روز دنیای بیولوژی