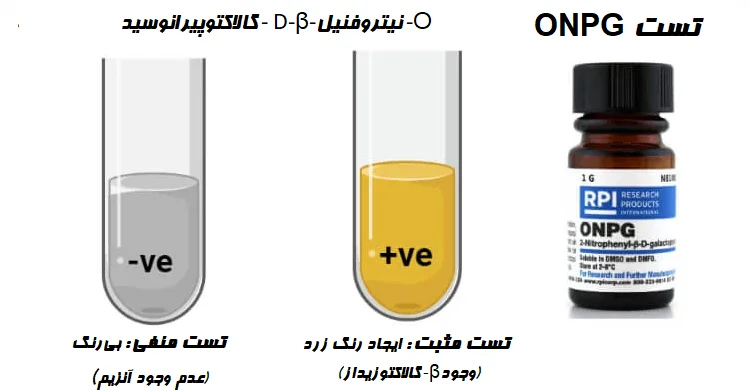
مقدمهای بر تست ONPG
لاکتوز (Lactose) یک مولکول قند دیساکارید (Disaccharide) است که از ترکیب گلوکز (Glucose) و گالاکتوز (Galactose) تشکیل شده است و عمدتاً در شیر و فرآوردههای آن وجود دارد. برخی از باکتریها میتوانند با تخمیر لاکتوز، آن را به گلوکز و گالاکتوز تبدیل کرده و انرژی خود را استخراج کنند.
تجزیه لاکتوز به دو آنزیم القایی به نام پرماز (Permease) و β-گالاکتوزیداز (β-galactosidase) بستگی دارد. در صورتی که محیط کشت حاوی لاکتوز فراوان ولی فاقد گلوکز باشد، تولید این آنزیمها القا میشود. اگر باکتریها آنزیم β-گالاکتوزیداز را تولید نکنند، به هیچ وجه نمیتوانند لاکتوز را تخمیر کنند. اما اگر باکتری تنها فاقد آنزیم پرماز باشد، ممکن است آن را تخمیر کند.
برخی از باکتریها هر دوی این آنزیمها را تولید میکنند. پرماز ورود لاکتات (Lactate) را به داخل سلول باکتری تسهیل میکند و β-گالاکتوزیداز، لاکتوز را به گلوکز و گالاکتوز تجزیه میکند. گلوکز و گالاکتوز حاصل میتوانند توسط باکتریها برای آزادسازی انرژی متابولیک استفاده شوند. چنین باکتریهایی که توانایی تولید هر دو آنزیم را دارند، تخمیرکننده سریع لاکتوز هستند.
با این حال برخی از باکتریها فاقد آنزیم پرماز و/یا هر دو آنزیم هستند. اگر باکتریها فاقد پرماز باشند، به عنوان تخمیرکننده لاکتوز دیررس یا غیر تخمیرکننده لاکتوز شناخته میشوند. بنابراین اگر باکتری فاقد آنزیم پرماز باشد، تفکیک باکتریهای تخمیرکننده لاکتوز، تخمیرکننده لاکتوز دیررس و غیر تخمیرکننده لاکتوز با استفاده از آزمایش سنتی تخمیر لاکتوز که از لاکتوز به عنوان سوبسترا استفاده میکنند، بسیار دشوار است.
به منظور حذف این مشکل، یک روش تست جدید با استفاده از “o -نیتروفنیل -β-D-گالاکتوپیرانوسید” (o-Nitrophenyl-β-D-galactopyranoside (ONPG)) به نام تست ONPG ابداع شد. ONPG یک ترکیب مصنوعی بیرنگ است که در ساختار شبیه لاکتوز بوده و در حضور آنزیم β-گالاکتوزیداز شکافته شده و باعث ایجاد رنگ میشود.

اهداف
- برای تأیید توانایی باکتری در تولید آنزیم β-گالاکتوزیداز.
- برای افتراق ارگانیسمهای تخمیرکننده لاکتوز و غیر تخمیرکننده لاکتوز.
اصول تست ONPG
دو آنزیم β-گالاکتوزیداز و آنزیم پرماز نقش مهمی در فرآیند تخمیر لاکتوز دارند. باکتریهای تخمیرکننده لاکتوز میتوانند فقط آنزیم β-گالاکتوزیداز یا هر دو آنزیم را سنتز کنند. اگر باکتریها هر دو آنزیم را سنتز کنند، آنگاه پرماز جذب سریع مولکولهای لاکتوز را تسهیل میکند تا باکتریها بتوانند به سرعت لاکتوز را تخمیر کنند. با این حال اگر باکتری تنها آنزیم β-گالاکتوزیداز را سنتز کند، در نتیجه لاکتوز را بسیار آهسته تخمیر میکند.
اگر ONPG به جای لاکتوز به عنوان سوبسترا به محیط کشت اضافه شود، آنزیم β-گالاکتوزیداز به روشی مشابه لاکتوز روی آن اثر میگذارد. ONPG از نظر ساختاری شبیه لاکتوز است و میتواند بدون آنزیم پرماز به سلول باکتری نفوذ کند. هنگامی که آنزیم β-گالاکتوزیداز در داخل سلول باکتری پیوند β-گالاکتوزید (β-Galactoside) را در ONPG میشکند، گالاکتوز و o-نیتروفنول (o-nitrophenol) آزاد میکند. رنگ o-نیتروفنول زرد است و از این رو باعث ایجاد رنگ زرد قابل مشاهده میشود که نشان میدهد باکتری یک ارگانیسم تخمیرکننده لاکتوز است.
از آنجایی که ONPG به آنزیم پرماز نیاز ندارد، حتی اگر باکتری آزمایشی فاقد پرماز بوده و فقط حاوی β-گالاکتوزیداز باشد، نتایج مشابهی را در مدت زمان بسیار کوتاهی به دست میدهد.
نیازمندیهای تست ONPG
الف) محیط کشت
- تست ONPG را میتوان با استفاده از براث ONPG یا دیسک ONPG انجام داد.
- ترکیب ONPG براث در هر 1000 میلی لیتر
- کازئین پپتون یا کازیتوز (Casein Peptone or casitose): 7.5 گرم
- o -نیتروفنیل -β-D-گالاکتوپیرانوسید: 1.5 گرم
- دی سدیم هیدروژن فسفات (Disodium hydrogen phosphate): 0.35 گرم
- کلرید سدیم – 3.75 گرم
- pH نهایی در دمای 25 درجه سانتیگراد: 0.2 ± 7.5
روش آمادهسازی براث ONPG
- مقدار مناسب از محیط کشت براث ONPG را طبق دستور شرکت سازنده اندازهگیری و آن را با آب استریل به حجم مورد نیاز در یک کونیکال فلاسک (یا بطری شیشهای) حل کنید.
- فلاسک را حرارت داده تا محیط حل شود. برای حرارت دادن، محیط را اتوکلاو نکنید. براث را میتوان در دمای منفی 10 درجه سانتیگراد و دور از نور نگهداری کرد.
- حدود 5 میلیلیتر (یا مقدار مورد نیاز) از براث را در لولههای آزمایش استریل بریزید.
در روش دیسک ONPG، باکتریها را میتوان در هر محیط کشت مناسب ایزوله کرد (رشد داد).
ب) شناساگرها
- دیسک ONPG برای انجام تست ONPG دیسک
- نرمال سالین (Normal Saline)
- استاندارد شماره 2 مکفارلند
ترکیبات
- محلول 1% کلرید باریم بیآب (Anhydrous barium chloride) (BaCl2).
- محلول 1% اسید سولفوریک (H2SO4).
روش آمادهسازی سوسپانسیون استاندارد مکفارلند شماره 2
در یک لوله آزمایش تمیز و شفاف، 9.8 میلیلیتر محلول 1 درصد H2SO4 و 0.2 میلیلیتر محلول 1 درصد BaCl2 اضافه کنید.
پ) تجهیزات مود نیاز
| لولههای آزمایش استریل
لوپ تلقیح |
ترازوی ماشینی
اتوکلاو و انکوباتور |
چراغ بونزن (Bunsen burner) | میکروپیپت
PPE سایر تجهیزات آزمایشگاهی |
ج) ارگانیسم آزمایشی (باکتریهای نمونه)
- کنترل مثبت: E. coli ATCC 25922 یا Neisseria lactamica ATCC 23971
- کنترل منفی: Proteus mirabilis ATCC 12453 یا Neissesria gonorrhoeae ATCC 43069
روش تست ONPG
الف) روش لوله (روش براث ONPG)
- سوسپانسیونی از باکتریهای نمونه خالص و تازه (18 تا 24 ساعته) با کدورت برابر استاندارد مکفارلند شماره 2 تهیه کنید.
- با استفاده از یک لوپ تلقیح استریل، لوله براث ONPG را با سوسپانسیون باکتریایی به شدت تلقیح کنید.
- لوله را در دمای 2±35 درجه سانتیگراد به صورت هوازی انکوبه کنید.
- پس از یک ساعت تغییر رنگ (تشکیل رنگ زرد) را بررسی کنید. اگر تغییر رنگی مشاهده نشد، انکوباسیون را تا 24 ساعت ادامه دهید و به دنبال تغییر رنگ باشید.
ب) روش دیسک
- در یک لوله آزمایش استریل، 0.5 میلیلیتر نمک استریل اضافه کنید و سوسپانسیون باکتریایی سنگین (کدورت برابر با استاندارد مکفارلند شماره 2) تهیه کنید.
- یک دیسک ONPG را در سوسپانسیون قرار دهید.
- محیط را به صورت هوازی در دمای 2±35 درجه سانتیگراد به مدت 4 تا 6 ساعت انکوبه کنید.
- تغییر رنگ (ایجاد رنگ زرد) را در دیسک ONPG بررسی کنید.
نتیجه و تفسیر تست ONPG
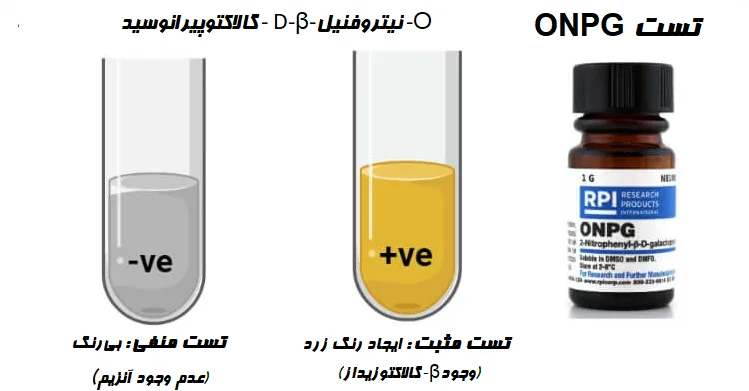
- تست ONPG مثبت (تولید β-گالاکتوزیداز) = ایجاد رنگ زرد
- تست ONPG منفی (عدم تولید β-گالاکتوزیداز) = عدم ایجاد (یا تغییر) رنگ
باکتریهای مثبت در تست ONPG
اشریشیا کلی (E. coli)، سیتروباکتر فروندی (Citrobacter freundii)، سالمونلا کلراسوئیس (Salmonella Choleraesuis)، شیگلا دیسانتریا (Shigella dysenteriae)، کلبسیلا پنومونیه (Klebsiella Pneumoniae) (و اکثر گونههای کلبسیلا)، ویبریو کلرا (Vibrio cholerae)، سراتیا مارسسنس (Serratia marcescens)، نایسریا لاکتامیکا (N. lactamica) و غیره.
باکتریهای منفی در تست ONPG
پروتئوس ولگاریس (Proteus vulgaris)، پروتئوس میرابیلیس (P. mirabilis)، سالمونلا تیفی موریوم (Salmonella Typhimurium)، ویبریو پاراهامولیتیکوس (Vibrio parahaemolyticus)، گونههای پروویدنسیا (Providencia)، سودوموناس آئروژینوزا (Pseudomonas aeruginosa)، نایسریا گونوره آ (N. gonorrhoeae) و غیره.
کنترل کیفیت
- coli ATCC 25922 یا Neisseria lactamica ATCC 23971، ONPG مثبت هستند و باعث ایجاد رنگ زرد در براث (و تغییر رنگ دیسک ONPG به زرد) میشوند.
Proteus mirabilis ATCC 12453 یا Neisseria gonorrhoeae ATCC 43069، ONPG منفی هستند و هیچ تغییر رنگی در براث وجود ندارد (و همچنین هیچ تغییر رنگی در دیسک ONPG وجود ندارد).
موارد احتیاط
- ONPG بسیار ناپایدار بوده و باید توسط پرسنل ماهر در یک محیط کنترل شده خریداری یا ساخته شود.
- براث و دیسک ONPG باید در یک جای تاریک ذخیره شوند، زیرا ONPG بسیار حساس به نور است.
- براث ONPG نباید اتوکلاو شود. از این رو هر کدام از تجهیزات و سالین مورد استفاده باید از قبل استریل شوند.
- برای تست از تلقیح سنگین استفاده کنید.
کاربردهای تست ONPG
- افتراق بین گونههای انتروباکتریاسه و نایسریا بر اساس توانایی سنتز β-گالاکتوزیداز.
- همراه با تست تخمیر لاکتوز، میتواند توانایی باکتریها در سنتز آنزیم پرماز را نیز تعیین کند.
- این تست در تعیین مشخصههای بیوشیمیایی و شناسایی باکتریهای گرم منفی استفاده میشود.
محدودیتهای تست ONPG
- باکتریهایی که به طور طبیعی رنگدانه زرد تولید میکنند برای تست ONPG مناسب نیستند.
- برای تست سریع ONPG، کلنیهای باکتریایی کشت شده روی محیط حاوی لاکتوز مورد نیاز است.
- کلنیهای باکتریایی از محیطهای حاوی گلوکز، فعالیت کمتری در برابر ONPG نشان میدهند.
- این تست برای شناسایی باکتری کافی نیست.
همچنین بخوانید:
- تست سولفید سرب (Lead Sulfide Test): تعریف، اصول، روش، نتیجه و موارد استفاده
- تست بارفود (Barfoed’s Test): تعریف، اصول، روش، نتیجه و موارد استفاده
- تست ایزاتین (Isatin Test): تعریف، اهداف، اصول، روش، نتیجه و موارد استفاده
- تست آگلوتیناسیون لاتکس: اهداف، اصول، کاربرد و تفسیر نتایج
مترجم: صادق حسینیکیا