اطلاعات عمومی, ویکی ژن
دیانای ژیراز (DNA Gyrase): تعریف، ساختار، واکنشها و مکانیسمها
مقدمهای بر دیانای ژیراز
توپوایزومراز پروکاریوتی II (Prokaryotic topoisomerase II) که همچنین به عنوان دیانای ژیراز شناخته میشود، تنها توپوایزومرازی است که تا کنون سوپرکویلهای (Supercoil) منفی را به دیانای وارد میکند.
توپوایزومرازهای دیانای دستهای از آنزیمها هستند که میتوانند وضعیت توپولوژیکی مولکولهای دیانای مدور بسته را تغییر دهند. دو دسته از آنزیمهای توپوایزومراز وجود دارند که در زیر آورده شده است:
- نوع I
- نوع II
توپوایزومرازهای دیانای از منابع ویروسی، پروکاریوتی و یوکاریوتی (Eukaryotic) ایزوله شدهاند.
باکتری ترموفیل سولفولوبوس (Thermophilic Sulfolobus) دیانای ژیراز تولید میکند، یعنی یک «ژیراز معکوس» که در حضور ATP، پیچهای فوق مارپیچی مثبت را به دیانای اضافه میکند. از آنجایی که فاقد یوکاریوتهای بالاتر و در عین حال برای همه باکتریها ضروری است، هدف مطلوبی برای آنتیبیوتیکها است.
کشف دیانای ژیراز
گلرت (Gellert) و همکارانش وقتی به دنبال شناسایی اجزای میزبان اشریشیا کلی (Escherichia coli) برای ادغام مکان محور باکتریوفاژ λ (Bacteriophage λ) بودند، نخستین کشف دیانای ژیراز را در سال 1976 انجام دادند.
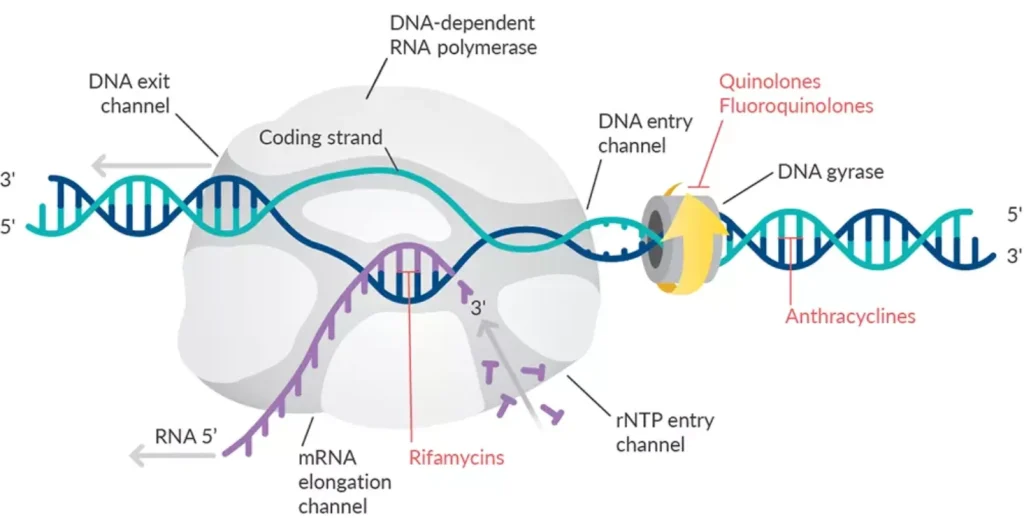
قبل از کشف ژیراز، بر روی دو نوع مهارکننده سنتز دیانای به نامهای کینولونها (Quinolone) (نالیدیکسیک اسید (Nalidixic acid)، اکسولینیک اسید (Oxolinic acid) و سیپروفلوکساسین (Ciprofloxacin)) و کومارینها (Coumarin) (نووبیوسین (Novobiocin)، کومرمایسین (Coumermycin) و کلروبیوسین (Chlorobiocin))، کار میشد. از آن زمان تا کنون، دیانای ژیراز هدف این دستههای ضد باکتری بوده است.
ساختار دیانای ژیراز
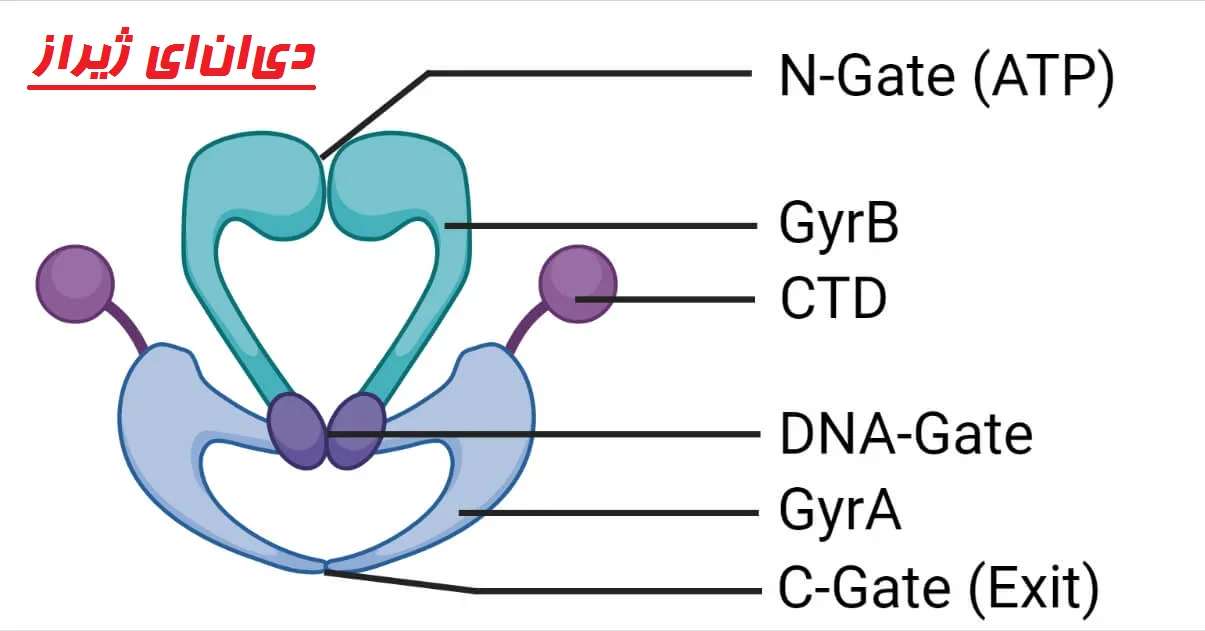
دیانای ژیراز از دو پروتئین متمایز تشکیل شده است که هر کدام توسط ژنهایی کدگذاری میشوند که قبلاً مشخص شده بود که مکانهای ژنتیکی تعیینکننده مقاومت اسید نالیدیکسیک یا کومرمایسین (nalA و cou) هستند.
با کشف ژیراز، این ژنها اکنون به عنوان gyrA و gyrB (به ترتیب با جرم مولکولی تقریبی 96 کیلو دالتون و 88 کیلو دالتون) شناخته میشوند و به عنوان یک تترامر A2B2 (A2B2 tetramer) مرتب میشوند.
تیروزین (Tyrosine) مورد استفاده در برش و بستن دیانای در gyrA یافت میشود.
محل اتصال ATP در gyrB یافت میشود.
واکنشهای دیانای ژیراز
تبدیلهای متقابل توپولوژیکی متعددی از مولکولهای دیانای توسط دیانای ژیراز انجام میشود. علاوه بر واکنش سوپرکویلسازی منفی، ژیراز ممکن است دو دایره دیانای دوتایی را به هم متصل و جدا کند و دیانای سوپرکویلشده منفی بدون ATP را ریلکس (دیانای که سوپرکویل نیست) کند.
سوپرکویلینگ و ریلکسیشن (Supercoiling and Relaxation)
واکنش سوپرکویل شدن دیانای توسط اسپرمیدین (Spermidine) ایجاد میشود و علاوه بر کاتیون دو ظرفیتی مانند Mg29+ به ATP نیز نیاز دارد. آنزیم دیانای ژیراز میتواند به صورت مارپیچی دیانای را جمع کند. در دمای 30 درجه سانتیگراد، تخمین زده شده است که یک مولکول باعث ایجاد اختلاف عدد پیوندی (Linking number) تقریباً 100 تا در دقیقه میشود.
دیانای سوپرکویل شده منفی در غیاب ATP توسط ژیراز ریلکس میشود. فرآیند سوپرکویل شدن به طور قابلتوجهی کارآمدتر از فعالیت ریلکسیشن ژیراز است و برای دستیابی به سرعت مشابه به 20 تا 40 برابر آنزیم نیاز دارد.
کاتناسیون (Catenation)، دکاتناسیون (Decatenation) و گره گشایی (Unknotting)
ژیراز میتواند دیانای گره خورده را باز کند و میتواند تولید و تجزیه کاتنانهای (Catenane) دیانای را کاتالیز کند. ژیراز از نظر تئوری باید بتواند حلقههای دیانای دو رشتهای را نیز گره بزند. با این حال این واکنش مشاهده نشده است. داروهای کومارین و کینولون این فرآیندهای وابسته به ATP را مسدود میکنند.
اسپرمیدین باعث تحریک کاتناسیون (اتصال) و دکاتناسیون (تجزیه) میشود. تحت شرایط غلظت دیانای مناسب، فرآیندهای کاتناسیون و دکاتناسیون نیازی به هیدرولیز ATP ندارند زیرا به شدت سودمند هستند. با این حال، مشاهده شده است که ATP برای هر دوی این فرآیندها مورد نیاز است.
مدلهای کمپلکس ژیراز- دیانای
Kirchhausen و Krueger پیچیدهترین مدلهای کمپلکس ژیراز- دیانای را بر اساس تفسیرهای خود از میکروسکوپ الکترونی و دادههای پرت پیشنهاد کردهاند. Kirchhausen پیشنهاد کرد که ساختار کمپلکس ژیراز مانند یک قلب با DNA پیچیده در اطراف پروتئین به طوری که مرکز آن در فضای بین لوبهای بالایی قلب قرار دارد، میباشد.
حدود 120 جفت باز دیانای به دور پروتئین در کمپلکس ژیراز- دیانای پیچیده شده است. تصور میشود که دم دیانای (DNA tail) در زاویه 120درجه قرار دارند و در نزدیکی نقاط ورود و خروج دیانای قرار میگیرند. اندازه ذره ژیراز 175 Å (آنگستروم) در 52 Å برآورد شده است.
مکانیسم سوپرکویل کردن دیانای توسط دیانای ژیراز
همه واکنشهای توپوایزومراز نیازمند اتصال پروتئین به دیانای، برش دیانای، گذر رشته، پیوند مجدد دیانای و در برخی موارد هیدرولیز ATP هستند و احتمالاً آنزیمها حالت عمل مشابه با ژیراز دارند. علیرغم پایبندی به مکانیسم عمومی توپوایزومراز، دیانای ژیراز همچنین به ویژگیهای مکانیکی خاصی نیاز دارد که بر ظرفیت آن برای سوپرکویل کردن دیانای، به طور فعال نظارت میکند.
واکنشهای مشاهده شده دیانای ژیراز در زیر آورده شده است:
- واکنش سوپرکویلسازی منفی وابسته به ATP در دیانای دو رشتهای مدور بسته
- ریلکسیشن مستقل از ATP در دیانای سوپرکویل شده منفی
- ریلکسیشن وابسته به نوکلئوتید (Nucleotide) در دیانای سوپرکویل شده مثبت
- تشکیل و تجزیه دیانای کاتناسیون شده
- تجزیه دیانای گره خورده
- شکستگی دو رشتهای دیانای ناشی از کینولون یا یون کلسیم
- هیدرولیز ATP وابسته به دیانای
هر کدام از واکنشهای فوق بخشی از یک مکانیسم واحد هستند که میتوانند با بسترهای مختلف یا تحت شرایط مختلف رخ دهند.
برهمکش ژیراز با آنتیبیوتیکها
ژیراز به دلیل اهمیت آن در سلولهای باکتریایی و عدم وجود فعالیت ژیراز در یوکاریوتها، یک هدف درمانی عالی است.
بیشتر اینها را میتوان به دو گروه کینولونها و کومارینها طبقهبندی کرد. با این وجود، سایر ترکیبات در هیچ یک از این دستهها قرار نمیگیرند.
داروهای کینولون
تکنیکهای متعددی از ظرفیت کینولونها برای شکستن دیانای توسط ژیراز استفاده کردهاند. واکنش برش دیانای ناشی از ژیراز میتواند اثربخشی یک داروی خاص را به عنوان یک مهارکننده ژیراز ارزیابی کند.
این واکنش بهعنوان اثباتی بر این که یک رخداد برش دو رشتهای به عنوان بخشی از مکانیسم عادی برای سوپرکویل شدن دیانای اتفاق افتاده، تفسیر شده است. این فرضیه وجود دارد که داروهای کینولون از فاز برش دیانای در فرآیند سوپرکویل شدن، جلوگیری میکنند.
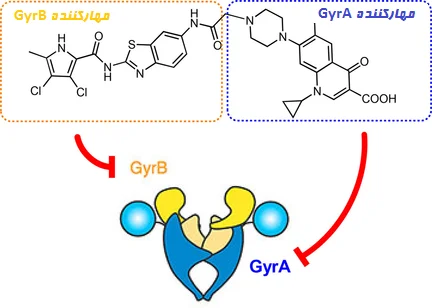
داروهای کومارین
آنزیم دیانای ژیراز به عنوان هدف اولیه داروهای کومارین شناخته میشود. مکانیسم دقیقی که توسط آن کومارینها فرآیند ژیراز ATPase را مهار میکنند، مشخص نشده است. طبق آزمایشهای سینتیکی (Kinetic) حالت پایدار، نووبیوسین و کومرمایسین احتمالاً مهارکنندههای رقابتی (Competitive inhibitor) هیدرولیز ATP توسط ژیراز و سوپرکویل شدن دیانای، هستند.
سایر داروها
غیر از خانواده کینولونها و کومارینها، تعداد بسیار کمی مهارکننده ژیراز وجود دارد. تحقیقات اخیر نشان داده است که دو آنتیبیوتیک غیر از کینولونها و کومارینها، ممکن است دیانای ژیراز را در داخل سلولها هدف قرار دهند.
سینودین (Cinodine) یک آنتیبیوتیک از کلاس گلیکوسیننامویلاسپرمیدین (Glycocinnamoylspermidine) است که توسط باکترهای گونه نوکاردیا (Nocardia) ساخته میشود. آزمایشات برونتنی (In vitro) با دیانای ژیراز مربوط به میکروکوکوس نشان داده است که این دارو به دیانای متصل شده و از سوپرکویل شدن دیانای جلوگیری میکند.
میکروسین B17 (Microcin B17) در برابر طیف وسیعی از انتروباکتریها (Enterobacteria) موثر است. ثابت شده است که این دارو یک مهارکننده تکثیر دیانای است که باعث توقف سریع سنتز دیانای ، تحریک پاسخ SOS، تجزیه دیانای و مرگ سلول میشود.
نقش درونتنی (In Vivo) ژیراز
ژیراز برای اولین بار به عنوان یک عامل میزبان ضروری برای ادغام مکان محور باکتریوفاژ λ شناسایی شد. با این حال، اکنون با رونویسی (Transcription) و تکثیر دیانای، مدولاسیون کشش کروموزومی فوق مارپیچی و تعداد زیادی از دیگر عملکردهای سلولی مرتبط است.
همانندسازی دیانای
برای همانندسازی دیانای به صورت درونتنی، دیانای ژیراز ضروری است. با توجه به واپیچیدگی رشته دیانای در چنگال همانندسازی (Replication fork)، انتظار میرود که سوپرکویلسازی منفی، همانندسازی را تسهیل کند.
همان آنتیبیوتیکهایی که همانندسازی دیانای را مهار میکنند، ژیراز را نیز مهار میکنند. علاوه بر این، جهشهای حساس به دمای ژنهای gyrA و gyrB در E. coli از همانندسازی دیانای هنگامی که دما خیلی بالا است، جلوگیری میکند.
به نظر میرسد جهشهای gyrA و gyrB اثرات متفاوتی بر تعدادی از فرآیندهای همانندسازی دارند. در حالی که یک جهش gyrA باعث توقف سریع طویل شدن زنجیره میشود، جهش gyrB از شروع همانندسازی جلوگیری میکند، اما افزایش طول زنجیره را مهار نمیکند.
رونویسی
داروهایی که فعالیت دیانای ژیراز را کاهش میدهند، میتوانند بر میزان بیان ژن (Gene expression) تأثیر بگذارند. مشخص شده است که سوپرکویلسازی منفی دیانای، ظرفیت رونویسی را در مقایسه با دیانای ریلکسشده، شکافدار یا خطی، بهبود بخشیده است.
سوپرکویلسازی منفی هم میتواند رونویسی را فعال و هم مهار کند. بنابراین پیشنهاد شده است که کارکرد ژیراز در طول رونویسی، ریلکس کردن سوپرکویلهای مثبت قبل از کمپلکس رونویسی است. در مقابل، توپوایزومراز I، سوپرکویلهای منفی از پشت را ریلکس میکند.
همچنین بخوانید:
- آموزش استخراج DNA به روش کیت
- DNA لدر چیست؟ انواع و موارد استفاده
- اشکال مختلف DNA: فرم A، فرم B، فرم Z
مترجم: صادق حسینیکیا




کاربرد دنای ژیراز برای انسان چیست
کاربرد DNA Gyrase برای انسان:
هدف دارویی در درمان عفونتهای باکتریایی:
از آنجا که DNA gyrase تنها در باکتریها یافت میشود و در سلولهای انسانی وجود ندارد، این آنزیم به عنوان یک هدف دارویی برای طراحی آنتیبیوتیکها مورد توجه قرار گرفته است. داروهایی مانند فلوروکینولونها، که شامل سیپروفلوکساسین و لووفلوکساسین میشوند، با مهار کردن فعالیت DNA gyrase، مانع از تکثیر DNA باکتریایی میشوند و به این ترتیب به کنترل عفونتهای باکتریایی کمک میکنند.
مطالعات تحقیقاتی:
DNA gyrase به عنوان مدل در مطالعات بیوشیمی و مکانیسمهای مولکولی تکثیر DNA باکتریایی استفاده میشود. این مطالعات میتوانند به درک بهتر مکانیسمهای بیماریزایی باکتریایی و توسعه روشهای درمانی جدید کمک کنند.
توسعه راهبردهای مقاومت به دارو:
با توجه به افزایش مقاومت به آنتیبیوتیکها، فهم نحوه عملکرد و مکانیسمهای مهار DNA gyrase میتواند در توسعه نسل جدیدی از آنتیبیوتیکها یا تقویت کنندههای اثر آنتیبیوتیکها مؤثر باشد.