سنجش غلظت و خلوص اسیدهای نوکلئیک
سنجش غلظت و خلوص اسیدهای نوکلئیک برای کاربردهای اساسی از جمله ترانسفکشن، کلونینگ، PCR و توالی یابی نسل بعدی (NGS) مهم است که اغلب دارای یک غلظت اسید نوکلئیک خاص برای عملکرد بهتر هستند. تعیین غلظت نادرست میتواند تنوع را در سنجشهای ساده افزایش دهد و کیفیت نتایج را تحت تاثیر قرار دهد. سنجش غلظت و خلوص DNA و RNA را می توان با استفاده از یکی از روش های زیر انجام داد:
- جذب UV (چگالی نوری)
- اندازه گیری فلورسانس با استفاده از رنگهای متصل شونده به اسید نوکلئیک
- الکتروفورز ژل آگارز
- qPCR
تعیین غلظت DNA با استفاده از جذب UV
رایجترین روشی که برای تعیین غلظت و خلوص اسید نوکلئیک استفاده میشود، جذب است. اندازه گیری جذب میتواند برای تخمین غلظت DNA یا RNA در نمونههای خالص شده استفاده شود. در این روش، نمونه اسید نوکلئیک در یک کووت کوارتز قرار داده میشود و سپس داخل اسپکتروفتومتر UV قرار میگیرد.

اسپکتروفتومترهای حجمی کوچک مانند ابزار NanoDrop™، اسپکتروفتومتر DeNovix DS-11، و طیف سنج Blue-Ray Bio EzDrop آنالیز حجم نمونه را تا 1 میکرولیتر ممکن میسازند. نور ماوراء بنفش در طول موج مشخصی از نمونه عبور میکند و غلظت اسیدهای نوکلئیک را میتوان با اندازهگیری مقادیر جذب در 260 نانومتر در برابر یک نمونه شاهد با استفاده از معادله بیر-لامبرت به طور مستقیم محاسبه کرد:
- A = εcl
- A = جذب UV
- ε = ضریب خاموشی وابسته به طول موج
- c = غلظت اسید نوکلئیک
- l = نور عبوری (سانتی متر)
ضرایب خاموشی*:
- dsDNA (خالص): 0.020 (μg/mL)-1cm-1
- ssDNA (خالص): 0.027 (μg/mL) – 1 cm-1
- ssRNA (خالص): 0.025 (μg/mL) -1 cm-1
این فرمول فقط برای مولکولهای اسید نوکلئیک بزرگ با ترکیبات متناسب نوکلئوتیدها مانند DNA ژنومی یا پلاسمیدها معتبر است. برای الیگونوکلئوتیدها و سایر مولکولهای اسید نوکلئیک کوتاه مانند miRNA ها، ضریب خاموشی باید بر اساس توالی الیگونوکلئوتید محاسبه شود.
برای بهبود دقت، اندازهگیری A260 اغلب برای آلودگی (اندازهگیری شده با جذب در 320 نانومتر) با استفاده از معادله زیر تصحیح میشود:
غلظت (µg/mL) = (اندازهگیری A260 – اندازهگیری A320) x ضریب تبدیل اسید نوکلئیک** x ضریب رقت
** ضریب تبدیل برای dsDNA: 50 میکروگرم در میلی لیتر
** ضریب تبدیل برای ssDNA: 37 میکروگرم در میلی لیتر
** ضریب تبدیل برای ssRNA: 40 میکروگرم در میلی لیتر
بازده کل را می توان با ضرب غلظت اسید نوکلئیک در حجم کل نمونه خالص نهایی بدست آورد.
بازده DNA (μg) = غلظت DNA × حجم نمونه کل (ml)
اندازه گیری جذب، آلودگی و خلوص اسید نوکلئیک
مولکولهایی غیر از DNA یا RNA میتوانند نور را در محدوده 260 نانومتر جذب کنند. اسیدهای آمینه با حلقههای اروماتیک موجود در پروتئینها نور را در طول موج 280 نانومتر جذب میکنند که میتواند بر اندازهگیری جذب در 260 نانومتر تأثیر بگذارد.
علاوه بر این، وجود گوانیدین و سایر نمکها یا حلالهای دترجنت که معمولاً در روشهای خالصسازی DNA و RNA مبتنی بر سیلیس برای اتصال استفاده میشوند، نور را در 230 نانومتر جذب میکنند و میتوانند به اندازهگیری جذب 260 نانومتری بالاتر منجر شوند. این نشان می دهد که اگر آلایندهها وجود داشته باشند و از عدد A260 برای محاسبه بازده استفاده شود، ممکن است مقدار DNA بیش از حد تخمین زده شود.
برای ارزیابی آلودگی پروتئین، نسبت جذب را در 260 نانومتر (جذب اسید نوکلئیک) و 280 نانومتر (جذب حلقههای اروماتیک در اسیدهای آمینه پروتئینی) تعیین کنید، اگرچه فنل نیز در 280 نانومتر جذب میشود. DNA با کیفیت بالا دارای نسبت A260/A280 1.7-2.0 خواهد بود. RNA با کیفیت بالا دارای نسبت A260/A280 ~ 2.0 خواهد بود.
خلوص DNA (آلودگی شیمیایی)= خواندن A260 ÷ خواندن A280
برای ارزیابی آلودگی شیمیایی میتوان از نسبت جذب در 260 نانومتر و 230 نانومتر استفاده کرد. نمکها و حلالهای آلی باقیمانده، که میتوانند PCR را مهار کنند، شناخته شدهاند که نور را در محدوده 230 نانومتر جذب میکنند. نسبت A260/A230 برای کاربردهایی که به تداخل شیمیایی حساس هستند، از جمله سنجشهای مبتنی بر آنزیم مانند qPCR و توالی یابی باید 1.5> باشد. هرچه این نسبت کمتر باشد، مقدار ترکیبات آلی یا دترجنتها در آماده سازی بیشتر است.
خلوص DNA (آلودگی شیمیایی) = خواندن A260 ÷ خواندن A230
روشهای فلورومتری برای تعیین غلظت DNA
روشهای فلورومتری به طور گسترده به عنوان برخی از حساسترین روشهای موجود برای تعیین غلظت اسید نوکلئیک در نظر گرفته میشوند. در این روشها از رنگهای فلورسنت استفاده میشود که شیارهای اسید نوکلئیک را به هم متصل میکنند، DNA یا RNA را بهطور غیر اختصاصی متصل میکنند، یا بهطور انتخابی به مواد نوکلئیک متصل میشوند. تفاوت در ویژگیهای طیفی فلوروفورهای متصل به اسید نوکلئیک اجازه میدهد تا غلظت نمونه مشخص شود.

هر رنگ اسید نوکلئیک دارای طول موج تحریک و انتشار خاصی است. نمونه DNA یا RNA با استفاده از فلورومتر اندازه گیری میشود و سپس غلظت اسید نوکلئیک با مقایسه انتشار فلورسانس نمونه با منحنی فلورسانس تولید شده با استفاده از استانداردهای غلظت اسید نوکلئیک شناخته شده محاسبه میشود. انواع مختلف نمونه (DNA ژنومی، DNA پلاسمید، و غیره) هر کدام به منحنیهای استاندارد خاص خود نیاز دارند. همانند روشهای جذب، غلظتهای محاسبهشده باید برای فاکتور رقتسازی در صورت نیاز اصلاح شوند.
ملاحظات هنگام انتخاب رنگ اسید نوکلئیک فلورسنت برای اندازه گیری:
- ویژگی: رنگهای مختلف برای اندازهگیری dsDNA، ssDNA، RNA یا RNAهای کوچک (مانند miRNA) بر اساس مکانیسم اتصال و ویژگیهای طیفی بهینه شدهاند – مطمئن شوید که رنگ فلورسنتی را انتخاب کردهاید که به هدف مورد نظر شما متصل میشود.
- حساسیت: رنگهای فلورسنت بسیار حساس به شما امکان میدهد از نمونه کمتری استفاده کنید یا غلظتهای بسیار پایین اسید نوکلئیک را اندازه گیری کنید.
- محدوده دینامیکی: برخی از معرفها را میتوان برای تشخیص اسید نوکلئیک در غلظتهای پایین استفاده کرد، اما ممکن است در غلظتهای بالاتر خطی بودن را از دست بدهند. معرف مورد استفاده باید برای محدوده غلظت مورد انتظار نمونههای شما مناسب باشد
- حجم نمونه: اگر حجم نمونه شما محدود است، به حجم نمونه مورد نیاز معرف یا کیت توجه کنید
- فرمت نمونه: برخی از معرفها و کیتها برای اندازه گیری در لولههای منفرد یا کووتها بهینه شدهاند، در حالی که برخی دیگر برای استفاده در میکروپلیتها برای توان عملیاتی بالاتر در نظر گرفته شدهاند.
- فیلترهای ابزار دقیق: بررسی کنید که آیا فلورومتر شما دارای فیلترهای تحریک و انتشار مناسب برای رنگ انتخابی است یا خیر
تعیین غلظت DNA و RNA با الکتروفورز ژل
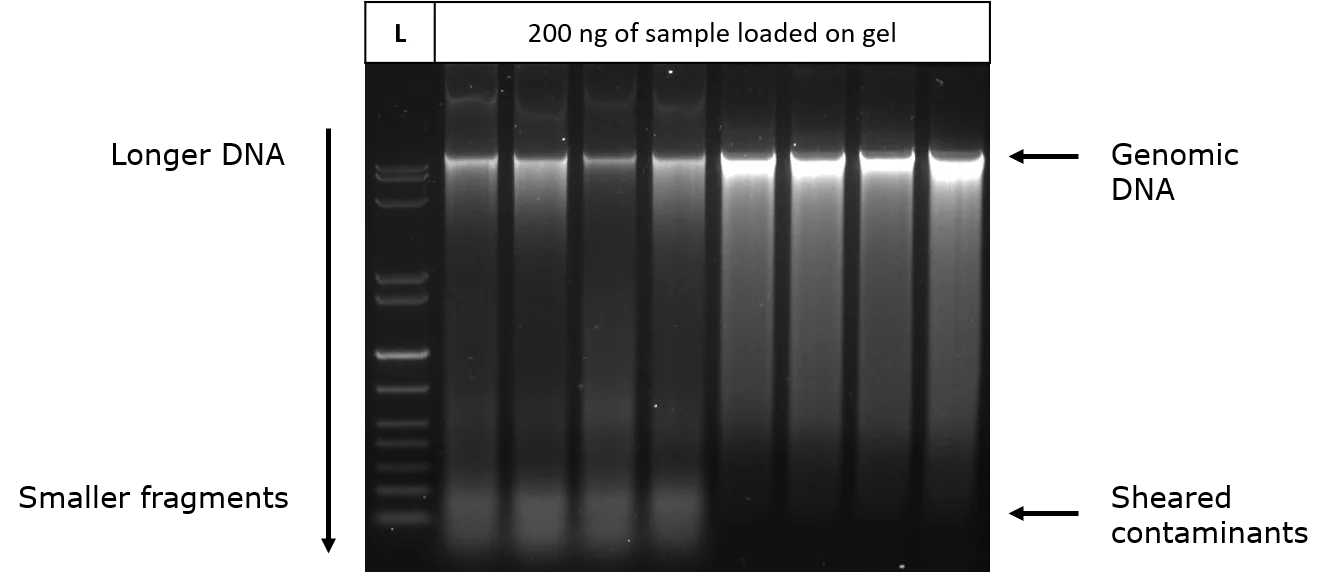
از آنجایی که الکتروفورز ژل آگارز DNA و RNA را از سایر ناخالصیها جدا میکند، این روش تعیین غلظت برخی از مسائل مربوط به محاسبات بر اساس اندازه گیری جذب را حذف میکند. در الکتروفورز ژل آگارز، نمونهای از DNA یا RNA جدا شده در چاهی از ژل آگارز بارگذاری میشود که در میدان الکتریکی قرار میگیرد.

اسید نوکلئیک با بار منفی به سمت آند مهاجرت میکند و قطعات DNA و RNA را بر اساس اندازه و شکل جدا میکند. الکتروفورز ژل آگارز دارای مزیت بیشتری است که امکان مشاهده نوارهای آلوده و ناخالصیهای بریده شده در نمونه را فراهم میکند. غلظت و بازده اسید نوکلئیک را میتوان با مقایسه شدت باندهای نمونه با استانداردهای مقادیر شناخته شده تعیین کرد.
از آنجایی که DNA و RNA نور را در طول موج 260 نانومتر جذب میکنند، میتوان شدت آن را با استفاده از یک transilluminator UV اندازهگیری کرد. حساسیت بالاتر را میتوان با برچسب زدن نمونهها و استانداردهای اسید نوکلئیک با رنگ اسید نوکلئیک مانند اتیدیوم بروماید یا SYBR Green و اندازه گیری شدت در طول موج مشخص شده برای آن رنگ به دست آورد.
اگر یک نمونه 2 میکرولیتری DNA رقیق نشده که روی ژل بارگذاری شده است، همان شدت استاندارد 100 نانوگرم را داشته باشد، غلظت نمونه 50 نانوگرم بر میکرولیتر (100 نانوگرم ÷ 2 میکرولیتر) است. استانداردهای مورد استفاده برای کمی سازی باید به اندازه اسید نوکلئیک نمونه در حال تجزیه و تحلیل باشد و به طور مشابه برچسب گذاری شود.
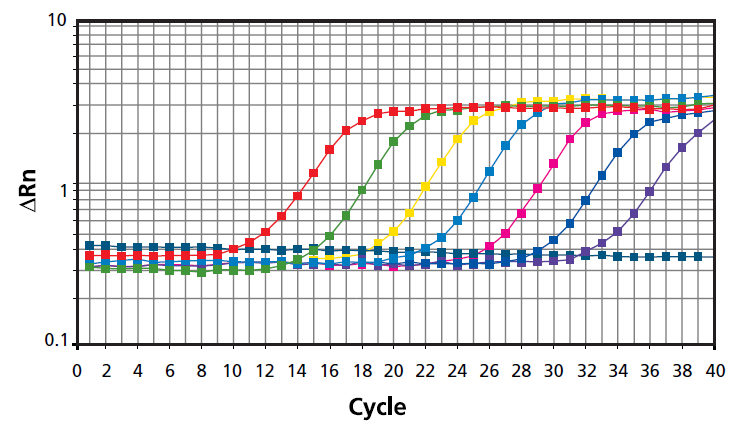
سنجش کمی توسط realtime PCR (qPCR)
Real-time PCR یا PCR کمی (qPCR)، از پروبهای فلورومتری استفاده میکند که DNA هدف را در مرحله اتصال PCR یا رنگهای فلورسنتی که به DNA دو رشتهای وصل میشوند، متصل میکند.
ترمال سایکلرهای تخصصی مجهز به ماژولهای تشخیص فلورسانس برای نظارت بر سیگنال فلورسانس هنگام amplification استفاده میشوند. فلورسانس اندازه گیری شده متناسب با مقدار کل DNA است. یک منحنی استاندارد برای تعیین مقادیر DNA هدف در نمونههای آزمایشی استفاده میشود. همچنین می توان از روشهای دیجیتال PCR برای تعیین کمیت DNA بدون منحنی استاندارد استفاده کرد.
در مورد کمی سازی RNA، الگوی PCR DNA مکمل (cDNA) است که با رونویسی معکوس RNA به دست می آید.
یکی از مزیتهای کلیدی ریل تایم PCR، توانایی تعیین کمیت توالیهای هدف خاص بر اساس مقدار اسید نوکلئیک قابل تکثیر است. این میتواند در تعیین کمیت DNA ژنومی مفید باشد، جایی که مقادیر DNA برش خورده و قطعات کوچکتر DNA و RNA موجود در نمونه در اندازه گیری نادیده گرفته میشوند. مزایای دیگر شامل تشخیص دترجنتها در مخلوط واکنش و ویژگی ذاتی پروب های فلورومتری است.
نتیجه گیری
روش سنجش غلظت مناسب DNA یا RNA باید بر اساس بسیاری از عوامل از جمله در دسترس بودن تجهیزات، کاربرد مورد نظر و توان انتخاب شود. برخی از روشهای کمیسازی دارای مزیت افزودهای هستند که امکان تعیین خلوص بیولوژیکی و شیمیایی یک نمونه را فراهم میکنند. هنگام مقایسه بازده بین روشها باید احتیاط کرد زیرا وجود آلودگی میتواند منجر به تداخل در اندازهگیریها شود که منجر به تخمین بیش از حد یا کمتر از میزان بازده میشود.
همچنین بخوانید:
مترجم: معصومه قریبی ششده




انواع سنجش ها در طول موج های مختلف را انجام داده و علاوه بر محاسبه خودکار میزان غلطت ترکیب مورد نظر، آلودگی های آن را در قالب یک فایل گزارش داده میشه
انواع سنجش ها در طول موج های مختلف را انجام داده میشه و مباحث قابل بحث و بررسین