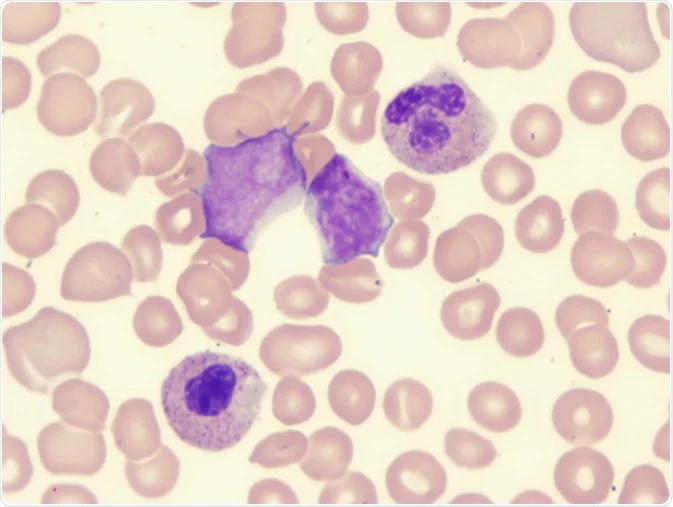
مقدمهای بر سندرمهای میلودیسپلاستیک
سندرمهای میلودیسپلاستیک (MDS) شرایط پزشکی هستند که زمانی رخ میدهند که سلولهای سازنده خون در مغز استخوان غیرطبیعی شوند. این منجر به تعداد کم یک یا چند نوع سلول خونی میشود. MDS نوعی سرطان در نظر گرفته میشود.
مغز استخوان طبیعی (Normal bone marrow)
مغز استخوان در وسط برخی از استخوانها یافت میشود. این بخش از سلولهای خون ساز، سلولهای چربی و بافتهای حمایت کننده تشکیل شده است. بخش کوچکی از سلولهای سازنده خون را سلولهای بنیادی خونی (blood stem cells) تشکیل میدهند. سلولهای بنیادی برای ساخت سلولهای خونی جدید مورد نیاز هستند.
3 نوع گلبول اصلی وجود دارد:
- گلبولهای قرمز (red blood cells)
- گلبولهای سفید (white blood cells)
- پلاکتها (platelets)
گلبولهای قرمز اکسیژن را از ریهها گرفته و به بقیه بدن میرسانند. این سلولها همچنین دی اکسید کربن را به ریهها برمیگرداند. داشتن گلبولهای قرمز خیلی کم را کم خونی (anemia) میگویند که باعث میشود فرد احساس خستگی و ضعف کند و رنگ پریده به نظر برسد. کم خونی شدید میتواند باعث تنگی نفس شود.
گلبولهای سفید (که همچنین به عنوان لکوسیت یا leukocytes شناخته میشوند) در دفاع از بدن در برابر عفونت مهم هستند. انواع مختلفی از گلبولهای سفید وجود دارد:
- گرانولوسیتها (Granulocytes) گلبولهای سفیدی هستند که دارای گرانولهایی هستند که در زیر میکروسکوپ دیده میشوند. در مغز استخوان، گرانولوسیتها از سلولهای جوانی به نام میلوبلاست رشد میکنند. رایج ترین نوع گرانولوسیت نوتروفیل (neutrophil) است. زمانی که تعداد نوتروفیلها در خون کم باشد، این بیماری نوتروپنی (neutrophils) نامیده میشود. این میتواند منجر به عفونتهای شدید شود.
- مونوسیتها (neutrophils) در محافظت از بدن در برابر میکروبها نیز مهم هستند. سلولهای موجود در مغز استخوان که به مونوسیت تبدیل میشوند، مونوبلاست (monoblasts) نامیده میشوند.
- لنفوسیتها پروتئینهایی به نام آنتی بادی میسازند که به بدن در مبارزه با میکروبها کمک میکند. آنها همچنین میتوانند به طور مستقیم میکروبهای مهاجم را از بین ببرند. لنفوسیتها معمولا در MDS غیر طبیعی نیستند.
پلاکتها به عنوان یک نوع سلول خونی در نظر گرفته میشوند، اما در واقع قطعات کوچکی از یک سلول هستند. آنها به عنوان یک سلول بزرگ در مغز استخوان به نام مگاکاریوسیت (megakaryocyte) شروع میشوند. تکههای این سلول جدا شده و به صورت پلاکت وارد جریان خون میشوند. برای لخته شدن خون به پلاکت نیاز دارید. آنها قسمتهای آسیب دیده رگهای خونی ناشی از بریدگی یا کبودی را مسدود میکنند. کمبود پلاکت که ترومبوسیتوپنی (thrombocytopenia) نامیده میشود، میتواند منجر به خونریزی یا کبودی غیرطبیعی شود.
سندرمهای میلودیسپلاستیک (Myelodysplastic syndromes)
در MDS، برخی از سلولهای مغز استخوان غیرطبیعی (دیسپلاستیک یا dysplastic) هستند و در ساخت سلولهای خونی جدید مشکل دارند. بسیاری از سلولهای خونی که توسط این سلولهای مغز استخوان تشکیل میشوند، معیوب هستند. سلولهای معیوب اغلب زودتر از سلولهای طبیعی میمیرند و بدن برخی از سلولهای خونی غیرطبیعی را نیز از بین میبرد و فرد را فاقد سلولهای خونی طبیعی کافی باقی میگذارد. انواع مختلف سلول ممکن است تحت تأثیر قرار گیرند، اگرچه شایع ترین یافته در MDS کمبود گلبولهای قرمز خون (کم خونی) است.
انواع مختلفی از MDS وجود دارد که بر اساس تعداد سلولهای خونی تحت تاثیر قرار گرفته و سایر عوامل است.
در حدود 1 مورد از هر 3 بیمار، MDS میتواند به سرطان سلولهای مغز استخوان در حال رشد سریع به نام لوسمی میلوئید حاد (acute myeloid leukemia یا AML) پیشرفت کند. در گذشته، MDS را گاهی اوقات به عنوان پیش لوسمی (pre-leukemia) یا لوسمی اسمولدرینگ (smoldering leukemia) مینامیدند. از آن جایی که اکثر بیماران به لوسمی مبتلا نمیشوند، MDS در گذشته به عنوان یک بیماری با پتانسیل بدخیم پایین طبقه بندی میشد. اکنون که پزشکان بیشتر در مورد MDS آموخته اند، آن را نوعی سرطان میدانند.
انواع سندرمهای میلودیسپلاستیک (MDS)
سندرمهای میلودیسپلاستیک (MDS) با استفاده از سیستم طبقهبندی سازمان بهداشت جهانی (WHO) طبقهبندی میشوند که اخیراً در سال 2016 بهروزرسانی شده است. این سندرم MDS را به انواعی تقسیم میکند که عمدتاً بر اساس این است که چگونه سلولهای مغز استخوان در زیر میکروسکوپ به نظر میرسند و همچنین برخی از عوامل دیگر مانند موارد زیر:
- چه تعداد از اشکال اولیه انواع سلول در مغز استخوان (گلبولهای قرمز، گلبولهای سفید یا پلاکتها) دیسپلازی را نشان میدهند (در زیر میکروسکوپ غیر طبیعی به نظر میرسند).
- یک فرد چند نوع تعداد کم سلولی (سیتوپنی) دارد.
- چه بخشی از گلبولهای قرمز اولیه، سیدروبلاستهای حلقه ای (sideroblasts) هستند (سلولهایی که حاوی حلقههایی از رسوبات آهن در اطراف هسته هستند).
- نسبت بلاستها (شکلهای بسیار اولیه سلولهای خونی یا blasts) در مغز استخوان یا خون.
- تغییرات کروموزومی خاصی در سلولهای مغز استخوان
بر اساس این عوامل، سیستمWHO ۶ نوع اصلی MDS را تشخیص میدهد:
- MDS با دیسپلازی چند خطی (MDS with multilineage dysplasia یا MDS-MLD)
- MDS با دیسپلازی تک خطی (MDS with single lineage dysplasia یا MDS-SLD)
- MDS با سیدروبلاست حلقه ای (MDS with ring sideroblasts یا MDS-RS)
- MDS با بلاستهای اضافی (MDS with excess blasts یا MDS-EB)
- MDS با del (5q) ایزوله
- MDS، غیر قابل طبقه بندی (MDS-U)
از آن جایی که تفاوتهای کوچک در ظاهر سلولها میتواند تشخیص را تغییر دهد، پزشکان ممکن است گاهی اوقات در مورد نوع دقیق MDS بیمار اختلاف نظر داشته باشند.
MDS با دیسپلازی چند خطی (MDS-MLD)

در MDS-MLD:
- دیسپلازی حداقل در 10 درصد از سلولهای اولیه 2 یا 3 نوع سلولی (گلبولهای قرمز، گلبولهای سفید و یا مگاکاریوسیتها [سلولهای سازنده پلاکتها]) در مغز استخوان دیده میشود.
- فرد دارای تعداد کم حداقل 1 نوع سلول خونی است.
- تعداد طبیعی (کمتر از 5 درصد) سلولهای خیلی اولیه به نام بلاست در مغز استخوان وجود دارد و بلاستها در خون نادر هستند (یا وجود ندارند).
این رایج ترین نوع MDS است.
در گذشته به آن سیتوپنی مقاوم با دیسپلازی چند خطی (refractory cytopenia with multilineage dysplasia یا RCMD) میگفتند.
MDS با دیسپلازی تک خطی (MDS-SLD)

در MDS-SLD:
- دیسپلازی حداقل در 10 درصد از سلولهای اولیه یک نوع سلولی (یا گلبولهای قرمز، گلبولهای سفید یا مگاکاریوسیتها [سلولهای سازنده پلاکتها]) در مغز استخوان دیده میشود.
- تعداد سلولهای خونی فرد کم است اما تعداد سلولهای خونی آنها طبیعی است.
- تعداد طبیعی (کمتر از 5 درصد) سلولهای خیلی اولیه به نام بلاست در مغز استخوان وجود دارد و بلاستها در خون نادر هستند (یا وجود ندارند).
این نوع MDS رایج نیست. به ندرت و یا هرگز، به لوسمی میلوئید حاد (AML) پیشرفت نمیکند. بیماران مبتلا به این نوع MDS اغلب میتوانند برای مدت طولانی حتی بدون درمان زندگی کنند.
در سیستم طبقه بندی قبلی به این سیتوپنی مقاوم با دیسپلازی تک خطی (refractory cytopenia with unilineage dysplasia یا RCUD) اشاره میشد. این شامل کم خونی مقاوم (RA)، نوتروپنی مقاوم (RN) و ترومبوسیتوپنی مقاوم (RT)، بسته به نوع سلولی است که تحت تأثیر قرار گرفته است.
MDS با سیدروبلاست حلقه ای (MDS-RS)

در این نوع MDS، بسیاری از گلبولهای قرمز اولیه، سیدروبلاست حلقه ای هستند. برای این تشخیص، حداقل 15 درصد از گلبولهای قرمز اولیه باید سیدروبلاست حلقه باشند (یا حداقل 5 درصد اگر سلولها دارای جهش در ژن SF3B1 باشند).
این وضعیت بر اساس اینکه چه تعداد از انواع سلولهای مغز استخوان تحت تأثیر دیسپلازی قرار میگیرند، به 2 نوع تقسیم میشود:
- MDS-RS با دیسپلازی تک خطی (MDS-RS-SLD): دیسپلازی تنها در یک نوع سلول
- MDS-RS با دیسپلازی چند خطی (MDS-RS-MLD): دیسپلازی در بیش از یک نوع سلول
این نوع MDS رایج نیست. به ندرت به AML تبدیل میشود و نتیجه برای افراد مبتلا به این نوع عموماً بهتر از سایر انواع MDS است. قبلاً به این کم خونی مقاوم با سیدروبلاست حلقه (refractory anemia with ring sideroblasts یا RARS) گفته میشد.
MDS با بلاست اضافی (MDS-EB)

در این نوع MDS، بلاستهای بیش از حد طبیعی در مغز استخوان و یا خون وجود دارد. این فرد همچنین دارای تعداد کم حداقل یک نوع سلول خونی است. ممکن است دیسپلازی شدید در مغز استخوان وجود داشته باشد یا نباشد.
این وضعیت بر اساس تعداد سلولهای مغز استخوان یا خون به 2 نوع تقسیم میشود:
- MDS-EB1: بلاستها 5 تا 9 درصد سلولهای مغز استخوان یا 2 تا 4 درصد سلولهای خون را تشکیل میدهند.
- MDS-EB2: بلاستها 10 تا 19 درصد سلولهای مغز استخوان یا 5 تا 19 درصد سلولهای خون را تشکیل میدهند.
این نوع حدود 1 مورد از هر 4 مورد MDS را تشکیل میدهد. این یکی از انواعی است که به احتمال زیاد به AML تبدیل میشود و خطر آن برای MDS-EB2 بیشتر از MDS-EB1 است. قبلاً به این کم خونی مقاوم با بلاستهای اضافی (refractory anemia with excess blasts یا RAEB) گفته میشد.
MDS با del (5q) ایزوله
در این نوع MDS، کروموزومهای سلولهای مغز استخوان بخشی از کروموزوم شماره 5 را ندارند. همچنین تعداد کمی از 1 یا 2 نوع سلول خونی (معمولاً گلبولهای قرمز) در فرد وجود دارد و حداقل در 1 نوع سلول در مغز استخوان دیسپلازی وجود دارد.
این نوع MDS رایج نیست. اغلب در زنان مسن رخ میدهد. به دلایلی که مشخص نیست، بیماران مبتلا به این نوع MDS پیش آگهی (چشم انداز) خوبی دارند. آنها اغلب برای مدت طولانی زندگی میکنند و به ندرت به AML مبتلا میشوند.
MDS غیر قابل طبقه بندی (MDS-U)

این نوع MDS غیر معمول است. برای MDS-U، یافتههای موجود در خون و مغز استخوان با هیچ نوع MDS دیگری مطابقت ندارد. به عنوان مثال، تعداد هر یک از انواع سلولی ممکن است در خون کم باشد اما کمتر از 10 درصد از آن نوع سلول در مغز استخوان غیر طبیعی به نظر میرسد. یا سلولهای مغز استخوان حداقل یک ناهنجاری کروموزومی خاص دارند که فقط در MDS یا لوسمی دیده میشود.
این نوع نادر است، بنابراین به اندازه کافی برای پیش بینی پیش آگهی (چشم انداز) مطالعه نشده است.
طبقه بندی بالینی MDS
همراه با طبقه بندی WHO، MDS را میتوان بر اساس علت زمینه ای نیز طبقه بندی کرد. این به عنوان یک طبقه بندی بالینی (clinical classification) شناخته میشود.
- اگر هیچ علتی قابل شناسایی نباشد، به آن MDS اولیه (primary MDS) میگویند. (این نوع بیشتر رایج است.)
- زمانی که علت بیماری مشخص شود به آن MDS ثانویه (secondary MDS) میگویند.
MDS ثانویه اغلب به درمان قبلی سرطان مربوط میشود یا در فردی که قبلاً بیماری مغز استخوان متفاوتی داشته است، ایجاد میشود.
شناسایی MDS به عنوان اولیه یا ثانویه مهم است زیرا نوع ثانویه احتمال بسیار کمتری برای پاسخ به درمان دارد.
آمار کلیدی برای سندرمهای میلودیسپلاستیک
تعداد افرادی که هر ساله با سندرم میلودیسپلاستیک (MDS) در ایالات متحده تشخیص داده میشوند، به طور قطعی مشخص نیست. برخی برآوردها این تعداد را حدود 10000 نفر اعلام کرده اند، در حالی که برآوردهای دیگر بسیار بیشتر بوده است.
MDS قبل از 50 سالگی غیرمعمول است و با افزایش سن این خطر افزایش مییابد. این بیماری بیشتر در افراد 70 ساله تشخیص داده میشود. با افزایش میانگین سنی جمعیت ایالات متحده، تعداد موارد جدید تشخیص داده شده هر ساله احتمالاً افزایش مییابد.
علائم و نشانههای سندرم میلودیسپلاستیک
یکی از ویژگیهای اصلی سندرمهای میلودیسپلاستیک (MDS) این است که باعث کاهش تعداد سلولهای خونی میشوند. گاهی اوقات این در آزمایش خون، حتی قبل از ظاهر شدن علائم، دیده میشود. در موارد دیگر، علائم مربوط به کمبود یک یا چند نوع سلول خونی (سیتوپنی) اولین علامت MDS است:
- داشتن گلبولهای قرمز بسیار کم (کم خونی) میتواند منجر به احساس خستگی، سرگیجه یا ضعف و همچنین تنگی نفس و رنگ پریدگی پوست شود.
- نداشتن گلبولهای سفید طبیعی به اندازه کافی (لکوپنی)، به ویژه سلولهایی به نام نوتروفیل (نوتروپنی)، میتواند منجر به عفونتهای مکرر یا شدید شود.
- داشتن تعداد بسیار کم پلاکت خون (ترومبوسیتوپنی) میتواند منجر به کبودی و خونریزی آسان شود. برخی از افراد خونریزیهای مکرر یا شدید بینی یا خونریزی از لثه دارند.
علائم دیگر میتواند شامل موارد زیر باشد:
- کاهش وزن
- تب
- استخوان درد
- از دست دادن اشتها
این علائم بیشتر به دلیل چیزی غیر از MDS ایجاد میشوند. با این حال، اگر هر یک از این علائم را دارید، به خصوص اگر با گذشت زمان از بین نرفتند یا بدتر شدند، به پزشک خود مراجعه کنید تا در صورت نیاز بتوان علت را پیدا کرده و آن را درمان کرد.
چه چیزی باعث سندرم میلودیسپلاستیک میشود؟
برخی از موارد سندرم میلودیسپلاستیک (MDS) با عوامل خطرزا شناخته شده مرتبط هستند اما اغلب، علت ناشناخته است.
دانشمندان در درک اینکه چگونه تغییرات خاصی در DNA در سلولهای مغز استخوان ممکن است باعث ایجاد MDS شوند، پیشرفت زیادی کرده اند. DNA ماده شیمیایی است که ژنهای ما را میسازد که عملکرد سلولهای ما را کنترل میکند. ما معمولا شبیه والدین خود هستیم زیرا آنها منبع DNA ما هستند اما DNA بر چیزی بیشتر از ظاهر ما تأثیر میگذارد.
برخی از ژنها زمان رشد سلولهای ما، تقسیم به سلولهای جدید و مرگ را کنترل میکنند:
- ژنهای خاصی که به رشد، تقسیم و زنده ماندن سلولها کمک میکنند، انکوژن (oncogenes) نامیده میشوند.
- ژنهایی که به کنترل تقسیم سلولی کمک میکنند یا باعث مرگ سلولها در زمان مناسب میشوند، ژنهای سرکوب کننده تومور (tumor suppressor genes) نامیده میشوند.
سرطانها میتوانند به دلیل جهشهای ژنی (نقص) ایجاد شوند که انکوژنها را فعال میکنند یا ژنهای سرکوب کننده تومور را خاموش میکنند.
معمولاً قبل از اینکه فرد مبتلا به MDS شود، جهش در چندین ژن مختلف در داخل سلولهای مغز استخوان مورد نیاز است. برخی از جهشهایی که اغلب در سلولهای MDS دیده میشوند شامل جهشهایی در ژنهای DNMT3A، TET2، ASXL1، TP53، RUNX1، SRSF2 و SF3B1 میشوند. برخی از این تغییرات ژنی را میتوان از والدین به ارث برد اما اغلب در طول زندگی فرد اتفاق میافتد.
تغییرات ژنی ارثی (Inherited gene changes)
محققان دریافته اند که تغییرات ژنی که باعث برخی از سندرمهای ارثی نادر (مانند اختلال پلاکتی خانوادگی با تمایل به بدخیمی میلوئید) میشوند، با افزایش خطر ابتلا به MDS مرتبط اند. این سندرم به دلیل تغییرات ارثی در ژن RUNX1 ایجاد میشود. به طور معمول، این ژن به کنترل رشد سلولهای خونی کمک میکند. تغییرات در این ژن میتواند منجر به بلوغ سلولهای خونی مانند سلولهای معمولی نشود که میتواند خطر ابتلا به MDS را افزایش دهد.
تغییرات ژنی که در طول زندگی فرد به دست میآید
اغلب، مشخص نیست که چرا افراد بدون سندرم ارثی به MDS مبتلا میشوند.
برخی از مواجهههای بیرونی میتواند با آسیب رساندن به DNA داخل سلولهای مغز استخوان منجر به MDS شود. به عنوان مثال، دود تنباکو حاوی مواد شیمیایی است که میتواند به ژنها آسیب برساند. قرار گرفتن در معرض پرتو درمانی یا برخی مواد شیمیایی مانند بنزن یا برخی داروهای شیمی درمانی نیز میتواند باعث جهش شود که منجر به MDS میشود.
اما گاهی اوقات به نظر میرسد تغییرات ژنی که منجر به MDS میشوند، بدون دلیل ظاهری رخ میدهند. بسیاری از این تغییرات ژنی احتمالاً فقط رویدادهای تصادفی هستند که گاهی در داخل سلول اتفاق میافتند، بدون اینکه علت خارجی داشته باشند.
تغییرات ژنی در داخل سلولها میتوانند در طول زندگی فرد ایجاد شوند که ممکن است توضیح دهد که چرا MDS تا حد زیادی افراد مسن را تحت تاثیر قرار میدهد.
عوامل خطرزا برای سندرمهای میلودیسپلاستیک
عامل خطرزا هر چیزی است که شانس ابتلا به بیماری مانند سرطان را تغییر دهد. سرطانهای مختلف عوامل خطرزا متفاوتی دارند. برخی از عوامل خطرزا، مانند سیگار کشیدن را شما میتوانید تغییر دهید. موارد دیگر، مانند سن یا سابقه خانوادگی شما، قابل تغییر نیستند.
اما داشتن یک عامل خطرزا یا حتی چندین مورد از این عوامل، همیشه به این معنی نیست که یک فرد به این بیماری مبتلا میشود و بسیاری از افراد بدون داشتن هیچ عامل خطرزا شناخته شده ای به سرطان مبتلا میشوند.
چندین عامل خطرزا شناخته شده برای سندرمهای میلودیسپلاستیک (MDS) وجود دارد.
سن بالاتر
سن بالا یکی از مهم ترین عوامل خطرزا برای MDS است. MDS در افراد کمتر از 50 سال ناشایع است و بیشتر موارد در افراد 70 یا 80 ساله دیده میشود.
جنسیت
MDS در مردان شایع تر از زنان است. دلیل این امر مشخص نیست، اگرچه ممکن است مربوط به این باشد که مردان در گذشته بیشتر در معرض سیگار کشیدن یا قرار گرفتن در معرض مواد شیمیایی خاص در محل کار بوده اند.
درمان سرطان
شیمی درمانی (chemo) یکی دیگر از عوامل خطرزا مهم برای MDS است. بیمارانی که با داروهای شیمی درمانی خاصی برای سرطان درمان شده اند، احتمال بیشتری دارد که بعداً به MDS مبتلا شوند. هنگامی که MDS در اثر درمان سرطان ایجاد میشود، MDS ثانویه یا MDS مرتبط با درمان (treatment-related MDS) نامیده میشود.
برخی از داروهایی که میتوانند منجر به MDS شوند، عبارتند از:
- مکلورتامین (نیتروژن خردل یا Mechlorethamine)
- پروکاربازین (Procarbazine)
- کلرامبوسیل (Chlorambucil)
- سیکلوفسفامید (Cyclophosphamide)
- ایفوسفامید (Ifosfamide)
- اتوپوزید (Etoposide)
- تنیپوزید (Teniposide)
- دوکسوروبیسین (Doxorubicin)
خطر MDS ثانویه بر اساس نوع و دوز داروها متفاوت است. همچنین ممکن است تحت تأثیر نوع سرطانی باشد که شیمی درمانی آن را درمان میکند. ترکیب این داروها با پرتو درمانی خطر را بیشتر افزایش میدهد. افرادی که پیوند سلولهای بنیادی (پیوند مغز استخوان) داشته اند نیز به دلیل دوزهای بسیار بالای شیمی درمانی که دریافت کرده اند، میتوانند به MDS مبتلا شوند. با این حال، تنها درصد کمی از افرادی که با این داروها درمان شده اند، در نهایت به MDS مبتلا میشوند.
سندرمهای ژنتیکی (Genetic syndromes)
افراد مبتلا به سندرمهای ارثی خاص بیشتر در معرض ابتلا به MDS هستند. این سندرمها توسط ژنهای غیر طبیعی (جهش یافته) ایجاد میشوند که از یک یا هر دو والدین منتقل شده اند. مثالها عبارتند از:
- کم خونی فانکونی (Fanconi anemia)
- سندرم شواچمن-دیاموند (Shwachman-Diamond syndrome)
- کم خونی دیاموند بلک فن (Diamond Blackfan anemia)
- اختلال پلاکتی خانوادگی با تمایل به بدخیمی میلوئید (Familial platelet disorder with a propensity to myeloid malignancy)
- نوتروپنی مادرزادی شدید (Severe congenital neutropenia)
- دیسکراتوز مادرزادی (Dyskeratosis congenita)
MDS خانوادگی (Familial MDS)
در برخی خانوادهها، MDS بیشتر از حد انتظار رخ میدهد. گاهی اوقات این به دلیل یک جهش ژنی شناخته شده است که در خانواده وجود دارد اما در موارد دیگر علت آن مشخص نیست.
سیگار کشیدن
سیگار خطر ابتلا به MDS را افزایش میدهد. بسیاری از مردم میدانند که سیگار میتواند باعث سرطان ریه شود اما همچنین میتواند باعث سرطان در سایر قسمتهای بدن شود که در تماس مستقیم با دود نیستند. مواد سرطانزای موجود در دود تنباکو هنگام عبور از ریهها جذب خون میشوند. هنگامی که این مواد وارد جریان خون میشوند، به بسیاری از قسمتهای بدن پخش میشوند.
مواجهههای زیست محیطی
برخی از موارد قرار گرفتن در معرض مواد محیطی با MDS مرتبط است:
- قرار گرفتن در معرض تابش پرتوها با دوز بالا (مانند زنده ماندن پس از انفجار بمب اتمی یا حادثه راکتور هسته ای) خطر ابتلا به MDS را افزایش میدهد.
- قرار گرفتن طولانی مدت در محل کار در معرض بنزن و مواد شیمیایی خاص مورد استفاده در صنایع نفت و لاستیک نیز میتواند خطر ابتلا به MDS را افزایش دهد.
آیا میتوان از سندرمهای میلودیسپلاستیک پیشگیری کرد؟
هیچ راه مطمئنی برای پیشگیری از سندرمهای میلودیسپلاستیک (MDS) وجود ندارد اما کارهایی وجود دارد که میتوانید انجام دهید که ممکن است خطر شما را کاهش دهد.
سیگار نکشیدن
از آن جایی که سیگار با افزایش خطر ابتلا به MDS مرتبط است، سیگار نکشیدن میتواند این خطر را کاهش دهد. البته افرادی که سیگار نمیکشند نیز کمتر از افرادی که سیگار میکشند به بسیاری از انواع دیگر سرطانها و همچنین بیماریهای قلبی، سکته مغزی و سایر بیماریها مبتلا میشوند.
اجتناب از قرار گرفتن در معرض تشعشعات یا مواد شیمیایی خاص
اجتناب از مواد شیمیایی صنعتی سرطان زا مانند بنزن، ممکن است خطر ابتلا به MDS را کاهش دهد.
درمان سرطان با پرتو درمانی و داروهای شیمی درمانی خاص میتواند خطر ابتلا به MDS را افزایش دهد. پزشکان در حال مطالعه راههایی برای محدود کردن خطر ابتلا به MDS در بیمارانی هستند که این درمانها را دریافت میکنند.
برای برخی از سرطانها، پزشکان ممکن است سعی کنند از استفاده از داروهای شیمی درمانی که احتمال بیشتری برای ایجاد MDS دارند، اجتناب کنند. با این حال، برخی از افراد ممکن است به این داروهای خاص نیاز داشته باشند. اغلب، فواید آشکار درمان سرطانهای تهدید کننده زندگی با شیمی درمانی و پرتو درمانی باید در مقابل احتمال ناچیز ابتلا به MDS چندین سال بعد متعادل شود.
آیا سندرمهای میلودیسپلاستیک زود هنگام قابل تشخیص هستند؟
در حال حاضر هیچ آزمایش توصیه شده ای برای غربالگری سندرمهای میلودیسپلاستیک (MDS) وجود ندارد. (غربالگری، آزمایش بررسی وجود سرطان در افراد بدون هیچ علامتی است.)
گاهی اوقات MDS زمانی که یک فرد به دلیل نشانه یا علائمی که دارد به پزشک مراجعه میکند، پیدا میشود. این علائم و نشانهها اغلب در مراحل اولیه MDS ظاهر نمیشوند اما گاهی اوقات MDS قبل از ایجاد علائم به دلیل یک نتیجه غیرطبیعی در آزمایش خون که به عنوان بخشی از یک معاینه معمولی یا به دلایل پزشکی دیگر انجام شده است، پیدا میشود. MDS که زود هنگام پیدا میشود همیشه نیازی به درمان فوری ندارد اما باید به دقت تحت نظر بود تا نشانههایی که مبنی بر پیشرفت آن وجود داشته باشد را بررسی کرد.
برای برخی از افرادی که در معرض خطر بیشتری هستند، مانند افراد مبتلا به سندرمهای ارثی خاص یا افرادی که داروهای شیمی درمانی خاصی دریافت کرده اند، پزشکان ممکن است پیگیری دقیق با آزمایش خون یا سایر معاینات یا آزمایشات را برای جستجوی علائم اولیه احتمالی MDS توصیه کنند.
آزمایشات برای سندرمهای میلودیسپلاستیک
برخی از افراد علائم یا نشانههایی دارند که نشان میدهد ممکن است سندرم میلودیسپلاستیک (MDS) داشته باشند. اگر علائمی دارید، ارائهدهنده مراقبتهای بهداشتی شما یک تاریخچه پزشکی کامل با تمرکز بر علائم شما و زمان شروع آنها دریافت میکند. همچنین برای علل احتمالی علائم خود معاینه خواهید شد.
در افراد دیگر، بر اساس نتایج آزمایشهای خونی که به دلیل دیگری انجام شده اند، ممکن است به MDS مشکوک شوند.
در هر صورت، اگر به MDS مشکوک باشید، احتمالاً به آزمایشاتی نیاز خواهید داشت تا سلولهای خون و مغز استخوان خود را بررسی کنید تا ببینید آیا MDS دارید یا به بیماری دیگری مبتلا شده اید.
شمارش سلولهای خونی و آزمایش سلولهای خونی
شمارش کامل خون (Blood cell counts یا CBC) آزمایشی است که سطح گلبولهای قرمز، گلبولهای سفید و پلاکتها را در خون شما اندازه گیری میکند. CBC اغلب با یک شمارش افتراقی (یا “تفاوت”) انجام میشود، که شمارش انواع مختلف گلبولهای سفید خون در نمونه خون است. در یک اسمیر خون، مقداری از خون روی یک اسلاید قرار میگیرد تا ببینند سلولها در زیر میکروسکوپ چگونه به نظر میرسند.
بیماران مبتلا به MDS اغلب گلبولهای قرمز بسیار کمی دارند (کم خونی). ممکن است کمبود گلبولهای سفید و پلاکت خون نیز داشته باشند. بیماران مبتلا به برخی از انواع MDS ممکن است میلوبلاست (“بلاست”) در خون نیز داشته باشند.
اینها اشکال بسیار اولیه سلولهای خونی هستند که به طور معمول فقط در مغز استخوان یافت میشوند. بلاست در خون طبیعی نیست و اغلب نشانه ای از مشکل مغز استخوان است. سلولهای خونی بیماران MDS نیز ممکن است دارای ناهنجاریهای خاصی در اندازه، شکل یا سایر ویژگیهایی باشند که در زیر میکروسکوپ قابل مشاهده است.
ناهنجاریهای خونی ممکن است نشان دهنده MDS باشد اما پزشک نمیتواند بدون بررسی نمونه ای از سلولهای مغز استخوان، تشخیص دقیقی بدهد.
سایر آزمایشات خون
همچنین ممکن است پزشک آزمایشهایی را برای بررسی سایر علل احتمالی شمارش خون پایین تجویز کند. به عنوان مثال، سطوح پایین آهن، ویتامین B12 یا فولات میتواند باعث کم خونی شود. اگر یکی از این موارد غیر طبیعی باشد، تشخیص MDS بسیار کمتر است.
آزمایشات مغز استخوان
نمونههای مغز استخوان از آسپیراسیون و بیوپسی مغز استخوان گرفته میشوند، آزمایشهایی که معمولاً همزمان انجام میشوند. نمونهها معمولاً از پشت استخوان لگن (hip) گرفته میشود. این آزمایشها ابتدا برای تشخیص و طبقهبندی استفاده میشوند و ممکن است بعداً تکرار شوند تا مشخص شود آیا MDS به درمان پاسخ میدهد یا در حال تبدیل شدن به یک لوسمی حاد است.
در آسپیراسیون مغز استخوان (bone marrow aspiration)، پوست روی لگن و سطح استخوان با بی حس کننده موضعی بی حس میشود که ممکن است باعث سوزش یا درد مختصری شود. سپس یک سوزن نازک و توخالی به استخوان وارد میشود و از یک سرنگ برای مکیدن مقدار کمی از مغز استخوان مایع استفاده میشود. حتی با استفاده از داروی بیهوشی، اغلب بیماران هنگام برداشتن مغز استخوان درد مختصری دارند.
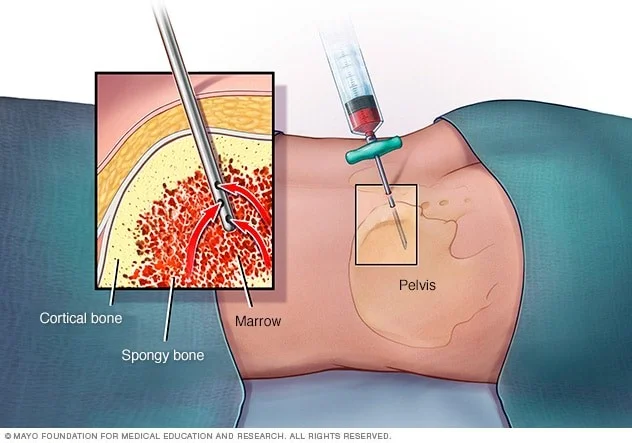
بیوپسی مغز استخوان معمولاً درست بعد از آسپیراسیون انجام میشود. یک تکه کوچک از استخوان و مغز را با یک سوزن کمی بزرگتر که داخل استخوان گذاشته میشود، خارج میکنند. بیوپسی ممکن است کمی درد نیز ایجاد کند. پس از انجام بیوپسی، برای کمک به جلوگیری از خونریزی، به محل فشار وارد میشود.
تستهای آزمایشگاهی مغز استخوان یا نمونه خون
یک پاتولوژیست (پزشک متخصص در تشخیص بیماریها با استفاده از تستهای آزمایشگاهی) نمونههای مغز استخوان و خون را زیر میکروسکوپ بررسی میکند. پزشکان دیگر، مانند هماتولوژیستها (پزشک متخصص در درمان پزشکی بیماریهای خون و بافتهای خون ساز)، ممکن است این موارد را نیز بررسی کنند.
پزشکان به اندازه، شکل و سایر ویژگیهای سلولها نگاه خواهند کرد. درصد سلولهای موجود در مغز استخوان یا خون که به صورت بلاست هستند (اشکال بسیار اولیه سلولهای خونی) اهمیت ویژهای دارند. در MDS، بلاستها به درستی بالغ نمیشوند، بنابراین ممکن است تعداد بلاستها زیاد باشد و سلولهای بالغ کافی نباشند.
برای تشخیص MDS، بیمار باید کمتر از 20 درصد در مغز استخوان و خون دچار بلاست باشد. بیماری که بیش از 20 درصد بلاست دارد به لوسمی میلوئید حاد (AML) مبتلا است.
انواع دیگر تستهای آزمایشگاهی نیز میتواند بر روی نمونههای مغز استخوان یا خون برای کمک به تشخیص MDS انجام شود:
فلوسایتومتری (Flow cytometry) و ایمونوسیتوشیمی

هم در فلوسایتومتری و هم در ایمونوسیتوشیمی، نمونههای سلولی با آنتیبادیهایی درمان میشوند که پروتئینهایی هستند که فقط به برخی پروتئینهای دیگر روی سلولها میچسبند. در ایمونوسیتوشیمی، سلولها را زیر میکروسکوپ بررسی میکنند تا ببینند آیا آنتیبادیها به آنها چسبیده اند یا نه (یعنی این پروتئینها را دارند)، در حالی که برای فلوسایتومتری از دستگاه خاصی استفاده میشود.
این آزمایشها میتوانند در تشخیص انواع مختلف MDS یا لوسمی از یکدیگر و سایر بیماریها مفید باشند.
آزمایشات کروموزومی
این آزمایشها کروموزومها (رشتههای بلند DNA) درون سلولها را بررسی میکنند. هر سلول باید 46 کروموزوم (23 جفت) داشته باشد. کروموزومهای غیر طبیعی در MDS رایج هستند.
سیتوژنتیک (Cytogenetics): در این آزمایش، سلولها زیر میکروسکوپ بررسی میشوند تا ببینند کروموزومها دارای ناهنجاری هستند یا خیر. یک اشکال این آزمایش این است که معمولاً 2 تا 3 هفته طول میکشد زیرا سلولها باید برای چند هفته در ظروف آزمایشگاهی رشد کنند تا کروموزومهای آنها قابل مشاهده باشد.

نتایج آزمایش سیتوژنتیک به صورت مختصر نوشته شده است که توضیح میدهد کدام تغییرات کروموزومی وجود دارند. مثلا:
- علامت منها (-) یا مخفف “del” به معنای حذف استفاده میشود. به عنوان مثال، اگر یک نسخه از کروموزوم 7 وجود نداشته باشد، میتوان آن را به صورت 7- یا (۷)del نوشت. اغلب، تنها بخشی از کروموزوم از بین میرود. کروموزوم 2 قسمت دارد که p و q نامیده میشوند. از دست دادن قسمت q کروموزوم 5، -q۵ یا del(5q) نوشته میشود.
- علامت مثبت زمانی استفاده میشود که اضافه ای وجود داشته باشد (کپی اضافی از تمام یا بخشی از کروموزوم). برای مثال 8+ به این معنی است که کروموزوم 8 تکرار شده است و کپیهای زیادی از آن در سلول وجود دارد.
- حرف t برای نشان دادن جابجایی استفاده میشود که در آن قسمتهایی از دو کروموزوم با یکدیگر جابه جا شده اند. به عنوان مثال، اگر کروموزومهای 8 و 21 با هم عوض شده باشند، به صورت (۲۱;۸) t نوشته میشود.
برخی تغییرات کروموزومی در سلولهای MDS میتواند به پیش بینی دوره احتمالی MDS کمک کند.
برای مثال، حذف بخشی از کروموزوم 5 یا del(5q)، معمولاً نتیجه بهتری را پیشبینی میکند (تا زمانی که بیش از یک تغییر کروموزومی دیگر وجود نداشته باشد و بخشی از کروموزوم 7 از بین نرود). تغییر در 3 کروموزوم یا تعداد بیشتری از آنها یا حذف کروموزوم 7 چشم انداز ضعیف تری دارد.
هیبریداسیون درجا فلورسنت (Fluorescent in situ hybridization یا FISH): این آزمایش با استفاده از رنگهای فلورسنت که فقط به تغییرات ژنی یا کروموزوم خاصی متصل میشوند، با دقت بیشتری به DNA سلول میپردازد. مزیت FISH این است که نیازی به تقسیم فعال سلولها ندارد، بنابراین معمولاً میتواند در عرض چند روز نتایج را ارائه دهد. FISH برای یافتن جابهجاییها بسیار خوب است – حتی میتواند برخی از آنها را پیدا کند که ممکن است آن قدر کوچک باشند که با آزمایشهای سیتوژنتیک معمول دیده شوند.

واکنش زنجیرهای پلیمراز (Polymerase chain reaction یا PCR): این یک آزمایش DNA بسیار حساس است که میتواند برخی از تغییرات کروموزومی بسیار کوچک را نیز تشخیص دهد که در زیر میکروسکوپ دیده نمیشوند، حتی اگر سلولهای غیر طبیعی بسیار کمی در نمونه وجود داشته باشد.

آمار پیش آگهی سندرم میلودیسپلاستیک
برای اکثر انواع سرطان، مرحله سرطان – معیاری برای میزان گسترش آن – یکی از مهم ترین عوامل در انتخاب گزینههای درمانی و در تعیین چشم انداز (پیش آگهی) فرد است.
اما سندرمهای میلودیسپلاستیک (MDS) بیماریهای مغز استخوان هستند. چشم انداز این سرطانها بر اساس اندازه تومور یا گسترش سرطان نیست. به همین دلیل، پزشکان از عوامل دیگری برای پیش بینی چشم انداز و تصمیم گیری در مورد زمان درمان استفاده میکنند. برخی از این عوامل برای توسعه سیستمهای امتیازدهی با یکدیگر ترکیب شده اند.
سیستم Revised International Prognostic Scoring (IPSS-R)
سیستم Revised International Prognostic Scoring (IPSS-R) بر اساس 5 عامل است:
- درصد بلاستها (شکلهای بسیار اولیه سلولهای خونی) در مغز استخوان
- نوع و تعداد ناهنجاریهای کروموزومی در سلولها
- سطح گلبولهای قرمز خون (که به صورت هموگلوبین اندازه گیری میشوند) در خون بیمار
- سطح پلاکت در خون بیمار
- سطح نوتروفیلها (نوعی گلبول سفید) در خون بیمار
به هر عامل یک امتیاز داده میشود که کمترین امتیاز بهترین چشم انداز را دارد. سپس امتیازات عوامل با هم جمع میشوند تا افراد مبتلا به MDS را در 5 گروه خطری قرار دهند:
- خطر بسیار کم
- ریسک کم
- ریسک متوسط
- ریسک بالا
- ریسک بسیار بالا
این گروههای خطر را میتوان برای کمک به پیش بینی چشم انداز یک فرد مورد استفاده قرار داد. این میتواند هنگام تلاش برای تعیین بهترین گزینههای درمانی مفید باشد.
این سیستم محدودیتهای مهمی دارد. به عنوان مثال، قبل از اینکه بسیاری از درمانهای کنونی برای MDS در دسترس باشند، توسعه یافته بود، بنابراین فقط افرادی را که برای MDS خود تحت درمان قرار نگرفته بودند، در نظر گرفت. همچنین شامل افرادی که در نتیجه شیمی درمانی (MDS ثانویه) به MDS مبتلا هستند، نمیشود اما این سیستم هنوز هم میتواند مفید باشد و هنوز هم به طور گسترده مورد استفاده قرار میگیرد.
سیستم امتیازدهی پیش آگهی سازمان جهانی بهداشت (WPSS یا WHO Prognostic Scoring System)
سیستم امتیازدهی سازمان جهانی بهداشت (WHO) بر اساس 3 عامل است:
- نوع MDS بر اساس طبقه بندی WHO (به عنوان مثال، انواع خاصی از MDS-SLD و MDS-del(5q) بهترین چشم انداز را دارند، در حالی که MDS-EB بدترین را دارد.)
- ناهنجاریهای کروموزومی (گروه بندی شده به عنوان خوب، متوسط یا ضعیف)
- آیا بیمار نیاز به تزریق خون منظم دارد یا خیر.
به هر عامل یک امتیاز داده میشود که کمترین امتیاز بهترین چشم انداز را دارد. سپس امتیازها جمع میشوند تا افراد مبتلا به MDS را در 5 گروه خطر قرار دهند:
- خطر بسیار کم
- ریسک کم
- ریسک متوسط
- ریسک بالا
- ریسک بسیار بالا
این گروههای خطر را میتوان برای کمک به پیشبینی چشم انداز فرد و همچنین میزان احتمال تبدیل MDS به لوسمی میلوئید حاد (AML) مورد استفاده قرار داد. این امر میتواند هنگام تلاش برای تعیین بهترین گزینههای درمانی مفید باشد اما مانند IPSS-R، این سیستم دارای محدودیتهای مهمی است. به عنوان مثال، افرادی که در نتیجه شیمی درمانی (معروف به MDS ثانویه) به MDS مبتلا هستند را شامل نمیشود.
هر دو IPSS-R و WPSS میتوانند پیچیده باشند و پزشکان مختلف ممکن است از سیستمهای متفاوتی استفاده کنند. اگر مبتلا به MDS هستید، با پزشک خود در مورد اینکه از کدام سیستم استفاده میکند، در کدام گروه خطر قرار دارید و اینکه ممکن است برای درمان و چشمانداز شما معنی داشته باشد، صحبت کنید.
سایر عوامل پیش آگهی
در کنار عواملی که در این سیستمهای امتیازدهی استفاده میشوند، پزشکان فاکتورهای دیگری را نیز پیدا کرده اند که میتواند به پیش بینی چشم انداز افراد نیز کمک کند. این موارد شامل:
- سن فرد
- وضعیت عملکرد یک فرد (چقدر میتواند فعالیتهای عادی روزانه را انجام دهد)
- شدت تعداد کم سلولهای خونی
- نتایج برخی از آزمایشات خونی، مانند سطح فریتین سرم (serum ferritin)
- تغییرات ژنی یا کروموزومی خاصی که در سیستمهای امتیاز دهی به حساب آورده نمیشوند
آمار بقا برای سندرمهای میلودیسپلاستیک
آمار بقا راهی برای پزشکان و بیماران است تا یک ایده کلی از چشم انداز (پیش آگهی) افراد مبتلا به نوع خاصی از سرطان به دست آورند. آنها نمیتوانند به شما بگویند که چقدر زنده خواهید ماند اما ممکن است به شما کمک کنند تا درک بهتری در مورد احتمال موفقیت روند درمانی خود داشته باشید. برخی از مردم میخواهند آمار بقای سرطان خود را بدانند و برخی دیگر نمیخواهند. اگر نمیخواهید بدانید، مجبور نیستید.
بقای متوسط (Median survival) یکی از راههای بررسی نتایج است. این دوره زمانی پس از تشخیص است که نیمی از بیماران در یک گروه خاص هنوز زنده هستند و نیمی از آنها فوت کرده اند. این یک مقدار متوسط است – نیمی از بیماران بیشتر از این عمر میکنند و نیمی دیگر این مدت هم عمر نمیکنند.
آمار بقا همه چیز را بیان نمیکند
آمار بقا اغلب بر اساس نتایج قبلی تعداد زیادی از افراد مبتلا به این بیماری است اما آنها نمیتوانند پیش بینی کنند که در مورد هر فرد خاصی چه اتفاقی خواهد افتاد. محدودیتهایی وجود دارد که باید به خاطر بسپارید:
- اعداد زیر بر اساس اطلاعات بیمارانی است که مدتی پیش مبتلا به سندرم میلودیسپلاستیک (MDS) تشخیص داده شده اند. بهبود در روند درمان از زمان جمع آوری این اعداد ممکن است منجر به چشم انداز بهتری برای افرادی شود که اکنون مبتلا به MDS هستند.
- این اعداد بر اساس نمرات پیش آگهی است که فاکتورهای خاصی مانند نوع MDS، نتایج برخی از آزمایشات خون و این که آیا سلولهای غیرطبیعی دارای تغییرات کروموزوم خاصی هستند یا خیر را در نظر میگیرد اما عوامل دیگری نیز ممکن است بر روی دیدگاه فرد تأثیر بگذارند، مانند سن و سلامت بیمار و اینکه بیماری چگونه به درمان پاسخ میدهد.
پزشک شما میتواند به شما بگوید که چگونه اعداد زیر برای شما اعمال میشود.
آمار بقا برای MDS
آمار بقای زیر بر اساس گروههای خطر بازنگری شده سیستم امتیازدهی پیش آگهی بینالمللی (IPSS-R) است. توجه به این نکته مهم است که این سیستم عمدتاً بر روی افرادی است که سالها پیش تشخیص داده شده اند و درمانهایی مانند شیمی درمانی را برای MDS خود دریافت نکرده اند.

گروههای خطرزای سیستم امتیازدهی پیش آگهی سازمان جهانی بهداشت (WPSS) همچنین میتوانند برای پیش بینی نتیجه مورد استفاده قرار گیرند – هم میانگین بقا و هم احتمال تبدیل MDS به لوسمی میلوئید حاد (AML) در عرض 5 سال. این آمار در سال 2007 بر اساس اطلاعات بیمارانی که بین سالهای 1982 تا 2004 تشخیص داده شده بودند، منتشر شد.

به یاد داشته باشید، این آمارهای بقا فقط تخمینی هستند - آنها نمیتوانند پیش بینی کنند که برای هر فرد چه اتفاقی میافتد. بسیاری از عوامل دیگر نیز میتوانند بر روی دیدگاه افراد تأثیر بگذارند. ما درک میکنیم که این آمار میتوانند گیج کننده باشند و ممکن است شما را به پرسیدن سوالات بیشتری سوق دهند. برای درک بهتر وضعیت خاص خود با پزشک خود صحبت کنید.
درمان سندرمهای میلودیسپلاستیک
اگر سندرم میلودیسپلاستیک (MDS) برای شما تشخیص داده شده است، تیم درمانی شما گزینههایتان را با شما در میان میگذارند. مهم است که مزایای هر گزینه درمانی را در مقابل خطرات و عوارض جانبی احتمالی سنجید.
چه درمانهایی برای MDS استفاده میشوند؟
انواع اصلی درمان MDS عبارتند از:
درمان حمایتی (Supportive Therapy) برای سندرمهای میلودیسپلاستیک
درمانهای حمایتی، درمانهایی هستند که به درمان (یا پیشگیری) از علائم یا عوارض سندرمهای میلودیسپلاستیک (MDS) کمک میکنند، برخلاف درمان مستقیم MDS. درمان حمایتی ممکن است به تنهایی یا همراه با سایر درمانها برای MDS استفاده شود. هدف اصلی این نوع درمان، بهبود آسایش و کیفیت زندگی برای فردی است که مبتلا به سرطان تشخیص داده شده است، صرف نظر از اینکه سرطان در چه مرحله یا هدف درمانی ممکن است باشد. همچنین ممکن است مراقبتهای حمایتی را بشنوید که تحت عنوان مراقبت تسکینی (palliative care)، مدیریت علائم (symptom management) یا مراقبت راحتی (comfort care) شناخته میشود.
به عنوان مثال، برای بسیاری از بیماران مبتلا به MDS، یکی از اهداف اصلی درمان، پیشگیری از مشکلات ناشی از کاهش تعداد سلولهای خونی است.
درمان تعداد کم گلبولهای قرمز خون (کم خونی)
تعداد کم گلبولهای قرمز خون (کم خونی یا anemia) میتواند باعث خستگی شدید و سایر علائم شود. بیماران مبتلا به MDS و کم خونی که باعث علائم میشود ممکن است از تزریق نسخه دست ساز فاکتور رشد اریتروپویتین (erythropoietin) سود ببرند که گاهی اوقات میتواند به مغز استخوان کمک کند تا گلبولهای قرمز خون جدید بسازد.
اگر این مفید نباشد، ممکن است نیاز به تزریق گلبول قرمز باشد. برخی از افراد نگران خطر جزئی عفونتها (مانند هپاتیت یا HIV) هستند که از طریق انتقال خون منتشر میشود اما این احتمال بسیار بعید است و مزایای سلولهای تزریق شده بسیار بیشتر از این خطر است.
برای افراد مبتلا به برخی از انواع MDS که فاکتورهای رشد اریتروپویتین به آنها کمک نکرده است و نیاز به تزریق خون منظم دارند، درمان با دارویی به نام عامل بلوغ گلبول قرمز، مانند لوسپاترسپت (luspatercept)، ممکن است یک گزینه باشد. این نوع دارو گاهی اوقات میتواند به کاهش تعداد تزریقات مورد نیاز فرد کمک کند.
درمان آهن انباشته شده از تزریق خون
انتقال خون میتواند باعث تجمع آهن اضافی در بدن شود. آهن میتواند در طول زمان در کبد، قلب و سایر اندامها تجمع پیدا کند و بر عملکرد آنها تأثیر بگذارد. این معمولاً فقط در افرادی دیده میشود که در طی چندین سال تزریق خون زیادی دریافت میکنند. به بیمارانی که در معرض خطر اضافه بار آهن هستند اغلب توصیه میشود از مصرف مکملهای آهن یا مولتی ویتامینهای حاوی آهن خودداری کنند.
داروهایی به نام عوامل شلاته کننده (chelating agents) که با آهن متصل میشوند تا بدن بتواند از شر آن خلاص شود، میتوانند در بیمارانی که به دلیل انتقال گلبولهای قرمز دچار اضافه بار آهن میشوند (مگر اینکه عملکرد کلیهشان ضعیف باشد) استفاده شوند.
- دفروکسامین (دسفرال یا Deferoxamine) معمولاً به صورت دم کرده زیر پوست و با استفاده از یک پمپ کوچک و قابل حمل تزریق میشود. این میتواند ناخوشایند باشد زیرا انفوزیون باید به آرامی (حداقل بیش از 8 ساعت) هر روز یا در بیشتر روزهای هفته انجام شود.
- دفراسیروکس (Exjade، Jadenu) یک داروی جدیدتر است که یک بار در روز از راه خوراکی (به صورت قرص، حل شده در آب یا آب میوه یا پاشیدن آن روی غذا) مصرف میشود.
درمان تعداد کم پلاکتها
بیماران MDS با تعداد پلاکت پایین ممکن است به راحتی دچار مشکل خونریزی یا کبودی شوند. گزینههای درمان کمبود پلاکت ممکن است شامل تزریق پلاکت یا درمان با داروهای خاص فاکتور رشد باشد. اگر این درمانها به خونریزی کمک نکردند، گزینه دیگر ممکن است درمان با دارویی به نام یک عامل آنتی فیبرینولیتیک (antifibrinolytic agent)، مانند اسید آمینوکاپروئیک (aminocaproic acid یا Amicar) باشد.
درمان تعداد کم گلبولهای سفید خون
بیمارانی که تعداد گلبولهای سفید خون پایینی دارند بیشتر در معرض عفونت هستند و عفونتها بیشتر احتمال دارد که جدی باشند. مهم است که از بریدگی و خراش اجتناب کنید و در صورت وقوع فورا از آنها مراقبت کنید. بیماران باید فوراً در مورد علائم احتمالی عفونت مانند تب، علائم ذات الریه (سرفه، تنگی نفس) یا عفونت دستگاه ادراری (سوزش هنگام ادرار) به پزشک خود اطلاع دهند.
پزشکان معمولاً عفونتهای باکتریایی شناخته شده یا مشکوک را با آنتی بیوتیک درمان میکنند. برای عفونتهای جدی، ممکن است از فاکتور رشد گلبولهای سفید خون نیز استفاده شود. این دارو میتواند تعداد گلبولهای سفید خون را افزایش دهد تا به مبارزه با عفونت کمک کند.
عوامل رشد و داروهای مشابه برای سندرمهای میلودیسپلاستیک
کمبود سلولهای خونی (گلبولهای قرمز، گلبولهای سفید یا پلاکتها) بیشتر علائم را در افراد مبتلا به سندرم میلودیسپلاستیک (MDS) ایجاد میکند. فاکتورهای رشد خونساز اغلب میتوانند به نزدیک شدن شمارش خون به حد طبیعی کمک کنند.
فاکتورهای رشد خونساز موادی شبیه هورمون هستند که به مغز استخوان کمک میکنند تا سلولهای خونی جدید بسازد. این مواد به طور طبیعی در بدن وجود دارند، اما دانشمندان راههایی برای ساخت مقادیر زیادی از آنها در آزمایشگاه پیدا کرده اند. بیماران میتوانند این فاکتورها را در دوزهای بزرگتر از آنچه توسط بدن خودشان ساخته میشود، دریافت کنند.
داروهای دیگری که تعداد سلولهای خونی را به روشهای مختلف افزایش میدهند نیز ممکن است برای برخی افراد مفید باشد.
بیماران معمولاً فاکتورهای رشد و داروهای مشابه را از طریق تزریق زیر جلدی (زیر پوستی) دریافت میکنند. تیم مراقبتهای بهداشتی شما میتوانند تزریقات را انجام دهند یا ممکن است شما یا اعضای خانوادهتان بتوانید تزریق آنها در خانه را یاد بگیرید.
فاکتورهای رشد گلبول قرمز (Red blood cell growth factors)
- Epoetin (Epogen یا Procrit) یک نسخه مصنوعی از فاکتور رشد اریتروپویتین است که باعث تولید گلبولهای قرمز خون میشود. این میتواند به برخی از بیماران کمک کند تا از انتقال گلبول قرمز اجتناب کنند. دادن هر دو epoetin و G-CSF به برخی از بیماران (به مبحث “فاکتورهای رشد گلبولهای سفید خون” مراجعه کنید) میتواند پاسخ آنها به اپوئتین را بهبود بخشد.
- Darbepoetin alfa (Aranesp) شکل طولانی اثر epoetin است. به همان روش کار میکند اما طوری طراحی شده است که به مقدار کمتری داده شود.
- لوسپاترسپت (Reblozyl) نسخه مصنوعی یک فاکتور رشد طبیعی نیست اما داروی دیگری است که میتواند به بدن در ساخت گلبولهای قرمز سالم بیشتر کمک کند. این دارو که به عنوان عامل بلوغ گلبولهای قرمز شناخته میشود، بر پروتئینهای TGF-β در مغز استخوان تأثیر میگذارد. پروتئینهای TGF-β معمولاً به کنترل سرعت بلوغ سلولهای جدید در مغز استخوان به گلبولهای قرمز خون کمک میکنند، به طوری که تعداد آنها در بدن زیاد یا خیلی کم نباشد. لوسپاترسپت با اثر بر روی پروتئینهای خاص TGF-β به مغز استخوان کمک میکند تا سلولهای قرمز خون سالمتر و کاملتری بسازد.
فاکتورهای رشد گلبول سفید (White blood cell growth factors)
- فاکتور محرک کلنی گرانولوسیت (G-CSF، filgrastim یا Neupogen) و فاکتور تحریک کننده کلنی ماکروفاژ گرانولوسیت (GM-CSF، sargramostim یا Leukine) میتوانند تولید گلبولهای سفید را بهبود بخشند. اینها به طور معمول برای جلوگیری از عفونت استفاده نمیشوند اما میتوانند به برخی از بیماران MDS که مشکل اصلی آنها کمبود گلبولهای سفید است و عفونتهای مکرر دارند، کمک کنند.
- Pegfilgrastim (Neulasta) فرم طولانی اثر G-CSF است. به همان روش کار میکند اما میتوان آن را به میزان کمتری تجویز کرد.
فاکتورهای رشد پلاکتی (Platelet growth factors)
- داروهایی به نام آگونیستهای گیرنده ترومبوپوئیتین (thrombopoietin-receptor agonists)، مانند رومیپلوستیم (Nplate) و eltrombopag (Promacta) ممکن است به برخی از افراد مبتلا به MDS که سطح پلاکت بسیار پایینی دارند، کمک کند، اگرچه این موضوع هنوز در حال مطالعه است.
- دارویی به نام oprelvekin (اینترلوکین-11، IL-11، یا Neumega) میتواند برای افزایش تعداد پلاکتها پس از شیمی درمانی و در برخی بیماریهای دیگر استفاده شود اما برای اکثر بیماران MDS، این دارو چندان مفید نبوده است.
مطالعاتی برای یافتن بهترین راه برای پیش بینی این که کدام بیماران از فاکتورهای رشد و داروهای مشابه کمک میگیرند و همچنین بهترین راه برای ترکیب فاکتورهای رشد با یکدیگر و با درمانهای دیگر، مانند شیمیدرمانی، در حال انجام است.
شیمی درمانی (Chemotherapy) برای سندرمهای میلودیسپلاستیک
شیمی درمانی استفاده از داروها برای درمان بیماریهایی مانند سرطان است.
برخی از داروهای شیمی درمانی را میتوان به صورت قرص بلعید، در حالی که برخی دیگر با سوزن در ورید یا عضله تزریق میشوند. این داروها درمان سیستمیک محسوب میشوند زیرا وارد جریان خون میشوند و به اکثر نواحی بدن میرسند. این نوع درمان برای بیماریهایی مانند سندرم میلودیسپلاستیک (MDS) که فقط در یک قسمت از بدن نیست، مفید است. هدف از شیمی درمانی این است که سلولهای بنیادی غیر طبیعی در مغز استخوان را از بین ببرد و اجازه دهد سلولهای طبیعی دوباره رشد کنند.
عوامل هیپومتیل کننده (Hypomethylating agents)

این نوع از داروهای شیمی درمانی بر نحوه کنترل ژنهای خاص در داخل سلول تأثیر میگذارند و برخی از ژنها را فعال میکنند که به بلوغ سلولها کمک میکنند. آنها همچنین سلولهایی را که به سرعت در حال تقسیم هستند، میکشند. نمونههایی از این نوع دارو عبارتند از:
- آزاسیتیدین (Vidaza)
- دسیتابین (Dacogen)
در برخی از بیماران MDS، استفاده از یکی از این داروها میتواند شمارش خون را بهبود بخشد (گاهی به اندازهای است که نیازی به تزریق خون نباشد)، کیفیت زندگی را افزایش دهد، شانس ابتلا به سرطان خون را کاهش دهد و حتی به فرد کمک کند تا عمر طولانیتری داشته باشد.
آزاسیتیدین را میتوان در زیر پوست یا ورید (IV)، اغلب به مدت 7 روز متوالی، یک بار در ماه تزریق کرد.
دسیتابین اغلب به مدت 3 ساعت هر 8 ساعت به مدت 3 روز به داخل ورید (IV) تزریق میشود. این کار هر 6 هفته تکرار میشود. دسیتابین را نیز میتوان به صورت وریدی در طی یک ساعت، هر روز به مدت 5 روز متوالی، و هر 4 هفته یکبار تجویز کرد.
شکل جدیدتر این دارو که به نام Inqovi شناخته میشود، دسیتابین را با سدازوریدین ترکیب میکند که به جلوگیری از تجزیه دسیتابین در دستگاه گوارش کمک میکند. این اجازه میدهد تا دارو به صورت خوراکی و به صورت قرص مصرف شود و معمولاً یک بار در روز به مدت 5 روز متوالی، که هر 4 هفته تکرار میشود.
عوامل هیپومتیل کننده میتوانند برخی از عوارض جانبی مشابه داروهای شیمی درمانی استاندارد را داشته باشند (به مباحث زیر مراجعه کنید) اما این عوارض معمولاً خفیف تر هستند.
یک عارضه جانبی اصلی این داروها معمولاً کاهش زود هنگام تعداد سلولهای خونی است که با شروع اثر دارو بهتر میشود. سایر عوارض جانبی میتواند شامل موارد زیر باشد:
- تب
- تهوع یا استفراغ
- اسهال یا یبوست
- خستگی و ضعف
داروهای شیمی درمانی استاندارد
داروهای شیمی درمانی استاندارد نسبت به عوامل هیپومتیل کننده برای MDS کمتر مفید هستند، بنابراین اغلب استفاده نمیشوند اما MDS پرخطر بیشتر احتمال دارد به لوسمی حاد میلوئیدی (AML) پیشرفت کند، بنابراین برخی از بیماران مبتلا به این نوع MDS ممکن است همان شیمی درمانی را که بیماران AML دریافت میکنند، دریافت کنند.
داروی شیمی درمانی که اغلب برای MDS استفاده میشود، سیتارابین (ara-C) است. این دارو میتواند به تنهایی با دوز کم تجویز شود که اغلب میتواند به کنترل بیماری کمک کند اما اغلب باعث بهبودی نمیشود.
گزینه دیگر، دادن همان نوع شیمی درمانی شدید است که برای بیماران جوانتر مبتلا به AML استفاده میشود. این به معنی دادن سیتارابین با دوز بالاتر همراه با سایر داروهای شیمی درمانی است. این اغلب در بیماران جوان تر و سالم تر با اشکال پرخطر MDS (مانند MDS با بلاستهای اضافی) استفاده میشود. برخی از داروهای شیمی درمانی که میتوانند با سیتارابین ترکیب شوند، عبارتند از:
- ایداروبیسین (Idarubicin)
- داونوروبیسین (Daunorubicin)
ممکن است از داروهای شیمی درمانی دیگر نیز استفاده شود.
بیمارانی که درمان با دوز بالاتر را دریافت میکنند، احتمال بیشتری دارد که MDSشان بهبود یابد اما همچنین میتوانند عوارض جانبی شدیدتر و حتی تهدید کننده زندگی داشته باشند، بنابراین این درمان معمولاً در بیمارستان انجام میشود. با این حال، این درمان ممکن است یک گزینه برای برخی از بیماران مبتلا به MDS پیشرفته باشد.
داروهای شیمی درمانی میتوانند عوارض جانبی زیادی ایجاد کنند. اینها به نوع و دوز داروهای داده شده و مدت زمان مصرف آنها بستگی دارد. عوارض جانبی رایج عبارتند از:
- ریزش مو
- زخمهای دهانی
- از دست دادن اشتها
- تهوع و استفراغ
- شمارش خون پایین
بیماران MDS در حال حاضر شمارش خون پایینی دارند که اغلب قبل از بهبودی، برای مدتی حتی بدتر نیز میشود.
- تعداد کم گلبولهای سفید منجر به افزایش خطر عفونتهای جدی میشود.
- تعداد کم پلاکتها میتواند منجر به مشکلاتی با کبودی آسان و خونریزی جدی، از جمله خونریزی در مغز یا روده شود.
- تعداد کم گلبولهای قرمز خون (یا کم خونی) میتواند منجر به خستگی و تنگی نفس شود. در افراد مبتلا به مشکلات قلبی، کم خونی شدید میتواند منجر به حمله قلبی شود.
اگر تعداد سلولهای خونی بیمار خیلی کم شود، ممکن است به درمان حمایتی (از جمله انتقال خون یا فاکتورهای رشد) برای کمک به پیشگیری یا درمان عوارض جانبی جدی نیاز داشته باشد.
اکثر عوارض جانبی ناشی از شیمی درمانی پس از پایان درمان از بین میروند. تیم مراقبتهای بهداشتی شما اغلب میتواند راههایی را برای کاهش عوارض جانبی پیشنهاد کند. به عنوان مثال، میتوان داروهایی برای کمک به پیشگیری یا کاهش تهوع و استفراغ تجویز کرد.
داروهای شیمی درمانی میتوانند اندامهای دیگر را نیز تحت تأثیر قرار دهند. مثلا:
- ایداروبیسین و دانوروبیسین میتوانند به قلب آسیب بزنند، بنابراین اغلب به بیمارانی که قبلاً مشکلات قلبی دارند، داده نمیشود.
- سیتارابین میتواند بر مغز تأثیر بگذارد و باعث اختلال در تعادل، خواب آلودگی و گیجی شود. این عوارض با دوزهای بالاتر رایج تر است.
در صورت بروز عوارض جانبی جدی، ممکن است نیاز به کاهش یا توقف شیمی درمانی، حداقل به طور موقت باشد. نظارت دقیق و تنظیم دوز دارو بسیار مهم است زیرا برخی از این عوارض جانبی میتوانند دائمی باشند.
درمانهای ایمنی (Immune treatments)
داروهای تعدیل کننده ایمنی (IMiDs یا Immunomodulating drugs)
لنالیدومید (Revlimid) متعلق به دسته ای از داروهای شناخته شده به عنوان داروهای تنظیم کننده ایمنی (IMiDs) است. به نظر میرسد که در MDS با درجه پایین به خوبی کار میکند و اغلب نیاز به انتقال خون را حداقل برای مدتی از بین میبرد. به نظر میرسد این دارو در افرادی که سلولهای MDS آنها بخشی از کروموزوم 5 (MDS-del(5q)) را از دست داده اند، بهترین کارایی را دارد اما میتواند به برخی از بیماران MDS که این کروموزوم غیر طبیعی را ندارند نیز کمک کند.
عوارض جانبی میتواند شامل موارد زیر باشد:
- کاهش شمارش خون (بیشتر تعداد گلبولهای سفید و تعداد پلاکتها)
- اسهال یا یبوست
- خستگی و ضعف
این دارو همچنین میتواند خطر لختههای خونی جدی را که در رگهای پاها شروع میشود (به نام ترومبوز ورید عمقی یا deep vein thrombosis یا DVT) افزایش دهد. گاهی اوقات، بخشی از DVT میتواند شکسته شود و به ریهها برود (به نام آمبولی ریه یا PE یا pulmonary embolus) حالتی که میتواند باعث مشکلات تنفسی یا حتی مرگ شود.
این دارو همچنین در صورت تجویز به زنان باردار ممکن است باعث نقص مادرزادی جدی شود. به همین دلیل، فقط از طریق یک برنامه خاص توسط شرکت داروساز در دسترس است.
سرکوب سیستم ایمنی
داروهایی که سیستم ایمنی را سرکوب میکنند میتوانند به برخی از بیماران مبتلا به MDS با خطر کمتر کمک کنند. این داروها برای افرادی که تعداد سلولهای کمی در مغز استخوان دارند (به نام مغز استخوان هیپوسلولی یا hypocellular bone marrow) بسیار مفید هستند.
گلوبولین ضد تیموسیت (ATG یا Anti-thymocyte globulin) یک آنتی بادی علیه نوعی گلبول سفید خون به نام لنفوسیت T است که به کنترل واکنشهای ایمنی کمک میکند. برای برخی از بیماران مبتلا به MDS، لنفوسیتهای T با تولید سلولهای خونی طبیعی تداخل دارند، بنابراین ATG میتواند مفید باشد. ATG به صورت انفوزیون از طریق ورید داده میشود. این دارو باید در بیمارستان داده شود زیرا گاهی اوقات میتواند باعث واکنشهای آلرژیک شدید و در نهایت منجر به کاهش فشار خون و مشکلات تنفسی شود.
سیکلوسپورین (Cyclosporine) داروی دیگری است که میتواند سیستم ایمنی را سرکوب کند. این میتواند همراه با ATG برای کمک به برخی از بیماران مبتلا به MDS استفاده شود. عوارض جانبی سیکلوسپورین میتواند شامل از دست دادن اشتها و آسیب کلیه باشد.
پیوند سلولهای بنیادی (Stem Cell Transplant) برای سندرم میلودیسپلاستیک
پیوند سلولهای بنیادی (SCT) در حال حاضر تنها شانس واقعی را برای درمان سندرم میلودیسپلاستیک (MDS) ارائه میدهد، اگرچه بسیاری از بیماران مبتلا به MDS ممکن است واجد شرایط انجام آن نباشند. در این درمان، بیمار شیمی درمانی با دوز بالا و یا پرتو درمانی به کل بدن را دریافت میکنند تا سلولهای موجود در مغز استخوان (از جمله سلولهای غیرطبیعی مغز استخوان) را از بین ببرد. سپس بیمار سلولهای بنیادی خون ساز جدیدی را دریافت میکند.
2 نوع اصلی SCT وجود دارد:
- در پیوند سلولهای بنیادی آلوژنیک (allogeneic stem cell transplant)، پس از تخریب مغز استخوان، بیمار سلولهای بنیادی خون ساز را از شخص دیگری دریافت میکند – اهداکننده. این نوعی پیوند است که معمولاً برای MDS استفاده میشود. نتایج این روش درمانی زمانی در بهترین حالت است که نوع سلول اهدا کننده (همچنین به عنوان نوع HLA شناخته میشود) با نوع سلول بیمار مطابقت داشته باشد و اهدا کننده ارتباط نزدیکی با بیمار مانند برادر یا خواهر داشته باشد. در موارد کمتر رایج، اهدا کننده با بیمار مطابقت داده میشود اما مرتبط نیست.
- در پیوند سلولهای بنیادی اتولوگ (autologous stem cell transplant)، بیمار سلولهای بنیادی خود را (که قبل از درمان برداشته شده اند) دریافت میکند. این نوع پیوند معمولاً برای بیماران مبتلا به MDS استفاده نمیشود زیرا مغز استخوان بیمار حاوی سلولهای بنیادی غیر طبیعی است.
SCTهای آلوژنیک میتوانند عوارض جانبی جدی و حتی تهدید کننده زندگی داشته باشند، بنابراین معمولاً در بیماران جوان تر که از سلامت نسبتاً خوبی برخوردار هستند، انجام میشود.
بیماران 60 یا حتی 70 ساله با موفقیت پیوند شده اند اما در بیماران مسن تر، SCT معمولاً با استفاده از شیمی درمانی و یا پرتو درمانی با شدت کمتر (reduced intensity) انجام میشود. دوزهای کمتر ممکن است تمام سلولهای مغز استخوان را از بین نبرند اما به اندازهای هستند که سلولهای اهدا کننده بتوانند در مغز استخوان رشد کنند و نگه داشته شوند. دوزهای پایین تر نیز عوارض جانبی کمتری ایجاد میکنند که تحمل این نوع پیوند را برای بیماران مسن آسان تر میکند. با این حال، برخی از عوارض جانبی جدی هنوز ممکن است.
اثرات جانبی
عوارض جانبی اولیه SCT مشابه عوارض جانبی مورد انتظار از شیمی درمانی و پرتو درمانی است و فقط شدیدتر است. یکی از جدی ترین عوارض جانبی کاهش شمارش خون است که میتواند منجر به خطرات عفونتهای جدی و خونریزی شود.
یکی دیگر از عوارض جانبی جدی احتمالی پیوندهای آلوژنیک، بیماری پیوند در مقابل میزبان (GVHD یا graft-versus-host disease) است. این بیماری در زمانی اتفاق میافتد که سلولهای ایمنی جدید (از اهدا کننده) بافتهای بیمار را خارجی ببینند و به آنها حمله کنند. GVHD میتواند هر بخشی از بدن را تحت تاثیر قرار دهد و میتواند تهدید کننده زندگی باشد.
اگرچه SCT آلوژنیک در حال حاضر تنها درمانی است که میتواند برخی از افراد مبتلا به MDS را درمان کند اما همه افرادی که پیوند دریافت میکنند، درمان نمیشوند. علاوه بر این، برخی از افراد ممکن است در اثر عوارض این درمان جان خود را از دست بدهند. اگر جوان هستید و MDS شما شروع به تبدیل به سرطان خون نکرده باشد، شانس شما برای درمان بیشتر است. با این حال، پزشکان اغلب توصیه میکنند قبل از در نظر گرفتن پیوند سلولهای بنیادی، صبر کنید تا MDS به مرحله پیشرفته تری تبدیل شود.
رویکرد عمومی برای درمان سندرمهای میلودیسپلاستیک
رویکرد درمانی برای سندرمهای میلودیسپلاستیک (MDS) به عوامل مختلفی بستگی دارد، مانند:
- نوع MDS
- امتیاز پیش آگهی (گروه خطر) MDS
- سن، سلامت کلی و ترجیحات فرد
برخی از افراد مبتلا به MDS که تعداد سلولهای خونی بسیار پایینی ندارند یا علائم آزار دهنده ندارند، ممکن است نیازی به درمان فوری نداشته باشند.
در صورت نیاز به درمان، پیوند سلولهای بنیادی (SCT) معمولاً تنها راه برای درمان بالقوه MDS در نظر گرفته میشود، بنابراین اگر اهدا کننده مشابه در دسترس باشد، ممکن است درمان انتخابی برای بیماران جوانتر و نسبتاً سالم باشد. متأسفانه، بسیاری از افراد مبتلا به MDS مسن تر یا در وضعیت سلامت ضعیفی هستند و ممکن است کاندیدهای خوبی برای SCT نباشند.
هنگامی که SCT یک گزینه نیست، احتمال درمان MDS بسیار کم است اما اغلب هنوز هم قابل درمان است. هدف اصلی درمان، تسکین علائم و جلوگیری از عوارض جانبی است.
اگر شمارش خون پایین باعث ایجاد مشکل میشود، درمانهای حمایتی مانند تزریق خون یا فاکتورهای رشد سلولهای خونی ممکن است مفید باشند. مراقبتهای پزشکی عمومی دقیق و اقدامات برای پیشگیری و درمان عفونتها نیز بسیار مهم است. مراقبتهای حمایتی مهم هستند صرف نظر از اینکه آیا فرد درمانهای دیگری را برای MDS دریافت میکند یا خیر.
در صورت نیاز به درمان دیگری، یک داروی شیمی درمانی مانند آزاسیتیدین (Vidaza) یا دسیتابین (Dacogen) اغلب اولین انتخاب است، به ویژه برای بیماران مبتلا به اشکال کم خطر MDS. این داروها اغلب میتوانند شمارش خون را بهبود بخشند و بسیاری از بیماران به تزریق خون کمتری نیاز دارند و کیفیت زندگی بهتری را با خستگی کمتری تجربه میکنند. این داروها همچنین میتوانند به برخی از افراد کمک کنند تا عمر طولانی تری داشته باشند. گزینه دیگر برای برخی افراد ممکن است داروهایی برای سرکوب سیستم ایمنی مانند ATG و سیکلوسپورین باشد.
اگر فردی دارای نوعdel(5q) MDS باشد (جایی که سلولها بخشی از کروموزوم 5 را ندارند)، لنالیدومید (Revlimid) اغلب به عنوان اولین درمان استفاده میشود. اگر این دارو کمکی نکرد، درمان با آزاسیتیدین یا دسیتابین اغلب گزینه بعدی است.
برای برخی از بیماران مبتلا به MDS پیشرفتهتر، مانند آنهایی که نمرات پیش آگهی آنها در معرض خطر یا بالاتر است یا آنهایی که به نظر میرسد در آنها MDS در حال تبدیل شدن به لوسمی حاد میلوئیدی (AML) است، داروهای شیمیدرمانی استاندارد ممکن است یک گزینه باشد. متأسفانه، این درمان اغلب میتواند برای بیمارانی که مسن هستند یا بسیاری از مشکلات پزشکی دیگر را دارند، بسیار سمی باشد. با این حال، برای بیماران جوان و سالم، درمان مشابه درمان AML است.
اگر یک نوع درمان مؤثر نباشد (یا اگر از کار بیفتد)، ممکن است نوع دیگری امتحان شود. بسیاری از داروهای جدید برای درمان MDS نیز در آزمایشات بالینی در حال مطالعه هستند. از آن جایی که بهترین گزینه برای درمان MDS مشخص نیست و از آن جا که درمان MDS اغلب با گذشت زمان سخت میشود، شرکت در یک کارآزمایی بالینی ممکن است در برخی موارد گزینه خوبی باشد. با تیم مراقبتهای بهداشتی خود صحبت کنید تا درباره آزمایشهای بالینی که ممکن است برای شما مناسب باشد، بیشتر بدانید.
یافتن نظر دوم
هنگامی که با درمان سرطان مواجه هستید، طبیعی است که سوال کنید که آیا پزشک دیگری میتواند اطلاعات بیشتری یا گزینه درمانی متفاوتی را ارائه دهد. ممکن است بخواهید پزشک دیگری را پیدا کنید که بتواند به نتایج آزمایش شما نگاه کند، در مورد وضعیت شخصیتان با شما صحبت کند و شاید برداشت متفاوتی از آن به شما بدهد. گرفتن نظر دوم میتواند به شما کمک کند تا در مورد تشخیص و برنامه درمانی خود اطمینان بیشتری داشته باشید.
آیا زمان کافی در جهت انتظار برای نظر دوم وجود دارد؟
تصمیمات درمانی باید پس از این که تمام آنچه را که توانستید در مورد تشخیص، پیش آگهی و گزینههای درمانی موجود آموختید، گرفته شود. بسته به نوع سرطانی که دارید، این امر ممکن است زمان ببرد. در چند سرطان، برخی از تصمیمات درمانی وجود دارد که باید فوراً اتخاذ شوند اما معمولاً میتوانید کمی زمان بگذارید و به آنها فکر کنید و باید در مورد آنها تامل کنید. اگر نگران انتظار برای شروع درمان هستید، باید با پزشک خود صحبت کنید.
چرا نظر دوم را بپرسیم؟
دلایل دریافت نظر دوم عبارتند از:
- میخواهید مطمئن شوید که همه گزینهها را بررسی کرده اید.
- شما فکر میکنید که پزشک شما میزان جدی بودن سرطان شما را دست کم میگیرد.
- پزشک شما مطمئن نیست که مشکل شما چیست.
- سرطان نادر یا غیر معمولی دارید.
- فکر میکنید ممکن است درمان دیگری در دسترس باشد.
- پزشک شما متخصص نوع سرطان شما نیست.
- پزشک به شما میگوید که در مورد نوع یا مرحله سرطان شما تردید وجود دارد.
- پزشک شما چند گزینه درمانی مختلف را به شما ارائه میدهد.
- در درک و برقراری ارتباط با پزشک خود مشکل دارید یا میخواهید گزینههای خود توسط شخص دیگری توضیح داده شود.
- شما فقط میخواهید خیالتان راحت باشد که تشخیص درستی دارید و درمان درست را انتخاب میکنید.
- شرکت بیمهتان از شما میخواهد قبل از شروع درمان نظر دیگری را بگیرید.
به یاد داشته باشید که پزشک شما چه میگوید
درک اطلاعات پیچیده زمانی که مضطرب هستید یا ترسیده اید دشوار است. گاهی اوقات پزشکان بدون اینکه بدانند از کلماتی استفاده میکنند که شما نمیفهمید. اگر چیزی را متوجه نشدید، از پزشک خود بخواهید آن را برای شما توضیح دهد.
حتی اگر دکتر با دقت مواردی را توضیح دهد، ممکن است شما تمام آنچه گفته شده را نشنوید یا به خاطر نسپارید. در اینجا چند راه وجود دارد که به شما کمک میکند تمام آن چه را که پزشک به شما میگوید به خاطر بسپارید.
- یکی از اعضای خانواده یا دوست را با خود به آن جا ببرید.
- در مورد آنچه پزشکتان میگوید یادداشت بردارید.
- بپرسید که آیا جزوهها یا کتابچههایی در مورد اطلاعاتی که پزشک به شما میگوید وجود دارد یا خیر.
- بپرسید که آیا میتوانید صحبتهایتان را ضبط کنید.
حتی پس از اینکه به پزشک خود فرصت دادید تا سرطانتان را با دقت به شما توضیح دهد، همچنان ممکن است تصمیم بگیرید که گرفتن نظر دوم برای شما مناسب است.
چگونه در مورد گرفتن نظر دوم با پزشک خود صحبت کنید
برخی از مردم برایشان سخت است که به پزشک خود بگویند که نظر پزشک دومی را میخواهند. به یاد داشته باشید که دریافت نظر دوم برای بیماران معمول است و پزشکان با این درخواست راحت هستند. اگر مطمئن نیستید که چگونه شروع کنید، در اینجا چند راه برای شروع گفتگو وجود دارد:
- «من به گرفتن نظر پزشک دومی فکر میکنم. آیا میتوانید کسی را توصیه کنید؟”
- «قبل از شروع درمان، مایلم نظر دومی داشته باشم. آیا در آن به من کمک میکنید؟»
- “اگر نوع سرطان من را داشتید، برای گرفتن نظر پزشک دوم چه کسی را میدیدید؟”
- “من فکر میکنم که میخواهم با پزشک دیگری صحبت کنم تا مطمئن شوم که همه موارد را تحت پوشش قرار داده ام.”
فرآیند نظر دوم: انتظار چه چیزی را داشته باشید
قبل از شروع به جستجوی برای دریافت نظر دوم، با شرکت بیمه خود تماس بگیرید تا متوجه شوید که بیمه نامه شما چه چیزی را پوشش میدهد. در برخی موارد، ممکن است مجبور شوید قبل از اینکه طرح، هزینه درمان شما را پرداخت کند، از پزشک دیگری که بخشی از برنامه سلامت شما است نظر دومی را دریافت کنید.
مهم است که بتوانید جزئیات دقیق تشخیص و درمان برنامه ریزی شده خود را به پزشک جدید ارائه دهید. اطمینان حاصل کنید که اطلاعات زیر را در دسترس دارید و همیشه کپیها را برای خود نگه دارید:
- یک کپی از گزارش آسیب شناسی شما از هر نمونه برداری یا جراحی
- در صورت انجام عمل جراحی، یک کپی از گزارش عمل خود
- اگر در بیمارستان بودید، یک کپی از خلاصه ترخیص که هر پزشک هنگام فرستادن بیماران به خانه تهیه میکند.
- خلاصه ای از برنامه درمانی فعلی پزشک یا طرحی که به عنوان گزینه به شما داده شده است.
- از آن جایی که برخی داروها میتوانند عوارض جانبی طولانی مدت داشته باشند، فهرستی از تمام داروهای شما، دوزهای دارو و زمان مصرف آنها
میتوانید از مطب پزشک فعلی خود کپی از سوابق خود را بخواهید. اگر درمان یا آزمایشاتی در بیمارستان یا کلینیک انجام داده اید، ممکن است لازم باشد با بخش سوابق پزشکی آنها تماس بگیرید تا نحوه دریافت این سوابق را بیابید. اگر دفتر پزشک، مرکز درمانی یا بیمارستان شما دارای یک پورتال آنلاین باشد، میتوانید سوابق خود را از طریق پورتال آنلاین درخواست کنید.
تصمیم گیری برای دریافت نظر دوم به کجا مراجعه کنید
اگر میخواهید نظر دوم را دریافت کنید، به پزشک خود اطلاع دهید. اکثر پزشکان ارزش نظر دوم را درک میکنند و زمانی که یک بیمار نظر دیگری را میخواهد، آزرده نمیشوند. حتی ممکن است بتوانند پزشک دیگری را توصیه کنند.
در زیر برخی از منابع احتمالی دیگر برای یافتن یک متخصص سرطان وجود دارد:
- بیمارستانهای محلی، کلینیکهای پزشکی یا مراکز سرطان
- هیئت آمریکایی تخصصهای پزشکی
- انجمن پزشکی
- کالج جراحان
معنا بخشیدن به نظر دوم
اگرچه به نظر میرسد که بیماران سرطانی بیشتر نظر دوم را میخواهند اما مطالعات نشان میدهد که مزایای گرفتن نظر نامشخص است. اگر نظر دوم با نظر اول متفاوت است، ممکن است نکات زیر برای شما مفید باشد:
- با پزشک اول خود قرار ملاقات بگذارید تا در مورد نظر دوم صحبت کنید.
- از هر دو پزشک بخواهید توضیح دهند که چگونه به برنامه درمانی خود رسیده اند.
- از آنها بپرسید که چگونه نتایج آزمایش شما را تفسیر کرده اند.
- بپرسید که از چه مطالعات تحقیقاتی یا دستورالعملهای حرفه ای استفاده کرده اند.
- از آنها بپرسید که چه چیزی به سایر بیماران در شرایط مشابه شما توصیه کرده اند
- بپرسید که آیا این امکان وجود دارد که دو پزشک پرونده شما را با هم بررسی کنند.
- همچنین ممکن است لازم باشد نظر سوم را از یک متخصص دیگر – یک پاتولوژیست، جراح، انکولوژیست پزشکی یا رادیو انکولوژیست – دریافت کنید تا در مورد این دو نظر صحبت و نظر آنها را در مورد وضعیت خود بیان کنید.
- ممکن است لازم باشد تحقیقات خود را در مورد آخرین دستورالعملهای درمانی انجام دهید. دو منبع خوب دستورالعملهای درمان شبکه جامع سرطان ملی (National Comprehensive Cancer Network یا NCCN) و خلاصههای درمان سرطان PDQ موسسه ملی سرطان (NCI) هستند. هر دو نسخه برای متخصصان سلامت (که از زبان و اصطلاحات پزشکی استفاده میکنند) و بیماران (که از زبان روزمره استفاده میکنند) در دسترس هستند.
اگر درمانهای سرطان از کار بیفتند
درمانهای سرطان میتوانند به جلوگیری از رشد یا گسترش سرطان کمک کنند اما گاهی اوقات درمان به خوبی جواب نمیدهد یا از کار میافتد.
شاید مدتی پیش درمان به پایان رسیده و در ابتدا موفقیت آمیز بوده باشد اما سرطان برگشته است یا شاید یکی از انواع درمان سرطان از کار افتاده باشد و سرطان به رشد خود ادامه دهد. اگر این اتفاق بیفتد، پزشک ممکن است بگوید سرطان شما پیشرفت کرده یا گسترش یافته است. ممکن است گزینههای درمانی دیگری وجود داشته باشد یا نداشته باشد اما زمانی که بسیاری از درمانهای مختلف آزمایش شده اند و دیگر سرطان را کنترل نمیکنند، زمان آن رسیده است که مزایا و خطرات ادامه آزمایش درمانهای جدید را بسنجیم.
تصمیم گیری برای ادامه درمان سرطان
در اینجا نکاتی وجود دارد که باید هنگام تصمیم گیری برای ادامه درمان سرطان در نظر بگیرید.
به تیم مراقبت از سرطان خود اعتماد کنید
صحبت با پزشک و تیم مراقبت از سرطان و اعتماد به آنها برای صادق بودن، باز بودن و حمایت کردن، بسیار مهم است. اگر به پزشکانی که توصیه میکنند اعتماد کنید، در تصمیم گیریهای درمانی اطمینان بیشتری خواهید داشت. این بدان معناست که ارتباطات بخش کلیدی مراقبت شما از تشخیص در سراسر درمان و فراتر از آن است.
سعی کنید از پرسیدن سوالاتی از پزشک و تیم مراقبت از سرطان خودداری کنید، “چه کار میکنید؟” یا “اگر شما جای من بودید، آیا درمان دیگری را امتحان میکردید؟” درعوض، سعی کنید سوالاتی مانند “لطفاً میتوانید همه گزینههای مناسب را به من بگویید؟” و “بر اساس تجربه خود در مورد درمان نوع سرطان من چه چیزی را توصیه میکنید؟” را بپرسید.
صحبت کردن با عزیزانتان
در مورد سرطان و اخباری که به شما داده شده است، با عزیزان خود باز باشید. افکار، احساسات و پیشنهادات آنها را بررسی کنید. با آنها در مورد گزینههایی که به شما داده شده است، همراه با تصمیماتی که گرفته اید یا میخواهید اتخاذ کنید، صحبت کنید. اگر احساس میکنید به نظرات آنها نیاز دارید، سوال بپرسید. اگر نه، قاطع باشید که دوست دارید خودتان تصمیم بگیرید. میتوانید در مورد اهمیت ارتباط در نزدیک شدن به پایان زندگی بیشتر مطالعه کنید.
فکر کردن به نظر دوم
برخی از بیماران یا عزیزانشان هنگام تصمیم گیری در مورد ادامه درمان سرطان ممکن است بخواهند نظر پزشک دومی را دریافت کنند. حتی زمانی که به پزشک و تیم مراقبت از سرطان خود اعتماد کامل دارید، ممکن است تعجب کنید که آیا پزشک دیگری میتواند چیز دیگر یا اطلاعات بیشتری ارائه دهد. طبیعی است که به صحبت کردن با شخص دیگری فکر کنید و اگر تصمیم به گرفتن نظر دیگری دارید، پزشک باید از شما حمایت کند. به یاد داشته باشید که تیم مراقبت از سرطان از شما میخواهد که در مورد تصمیماتی که میگیرید مطمئن باشید.
اگر درمان دیگری در دسترس باشد
اگر سرطانی دارید که به رشد خود ادامه میدهد یا پس از یک نوع درمان عود میکند، ممکن است درمان دیگری همچنان به کوچک شدن سرطان کمک کند یا حداقل آن را به اندازه کافی کنترل کنید تا به شما کمک کند، طولانی تر زندگی کنید و احساس بهتری داشته باشید. کارآزماییهای بالینی همچنین ممکن است فرصتهایی را برای آزمایش درمانهای جدیدتر که میتوانند مفید باشند، ارائه دهند.
اگر میخواهید تا زمانی که میتوانید به درمان ادامه دهید، مهم است که در مورد احتمال فواید درمان بیشتر (و این که چه فایدهای ممکن است داشته باشد)، در مقایسه با خطرات و عوارض جانبی احتمالی فکر کنید. پزشک شما میتواند به تخمین میزان احتمال پاسخ سرطان به درمانی که ممکن است در نظر داشته باشید، کمک کند. به عنوان مثال، پزشک ممکن است بگوید که درمان بیشتر ممکن است در حدود 1 در 100 شانس موثر داشته باشد. اگر این طرح را انتخاب میکنید، داشتن انتظارات واقع بینانه مهم است. فواید احتمالی، خطرات، عوارض جانبی، هزینهها، برنامه درمان و ویزیتها و تأثیر آن بر کیفیت زندگی باید همیشه مورد توجه و بحث قرار گیرد.
وقتی فردی درمانهای مختلف را امتحان کرده و سرطان همچنان در حال رشد است، حتی درمانهای جدیدتر ممکن است دیگر مفید نباشند. این احتمالاً سختترین بخش تجربه سرطان شما خواهد بود – زمانی که درمانهای زیادی را پشت سر گذاشته اید و دیگر هیچ چیز کار نمیکند. در برخی مواقع ممکن است لازم باشد در نظر داشته باشید که درمان بیشتر احتمالاً سلامت شما را بهبود نمیبخشد یا نتیجه یا بقای شما را تغییر نمیدهد. درمان در این شرایط گاهی به عنوان مراقبت بیهوده (futile care) شناخته میشود. باز هم، مهم است که به تیم مراقبت از سرطان خود اعتماد کنید و در این دوران سخت در مورد همه گزینهها با عزیزان خود صحبت کنید و در مورد ادامه درمان تصمیم بگیرید.
چه چیز دیگری میتواند انجام شود
مراقبت تسکینی (Palliative care)
چه درمان را ادامه دهید یا نه، کارهایی وجود دارد که میتوانید برای کمک به حفظ یا بهبود کیفیت زندگی خود انجام دهید. مهم این است که تا جایی که میتوانید احساس خوبی داشته باشید.
حتماً در مورد علائمی که ممکن است داشته باشید، مانند حالت تهوع یا درد، بپرسید و آنها را درمان کنید. مراقبت تسکینی میتواند مورد استفاده قرار گیرد، چه در حال درمان سرطان هستید یا نیستید و در هر مرحله از بیماری شما قابل استفاده است. مراقبت تسکینی برای کمک به کاهش علائم و عوارض جانبی استفاده میشود.
مراقبت آسایشگاهی (Hospice care)
اگر تصمیم به توقف درمان گرفته شود، در برخی مواقع، ممکن است از مراقبتهای آسایشگاهی بهره مند شوید. در پایان عمر، مراقبت آسایشگاهی بر کیفیت زندگی شما و کمک به مدیریت علائم خود تمرکز میکند. مراقبت آسایشگاهی به جای بیماری، فرد را درمان میکند و بر کیفیت زندگی شما تمرکز میکند تا طول آن.
در حالی که دریافت مراقبت از آسایشگاه به معنای پایان درمانهایی مانند شیمی درمانی و پرتو درمانی است و به این معنا نیست که نمیتوانید برای مشکلات ناشی از سرطان یا سایر بیماریهای خود درمان دریافت کنید. در آسایشگاه تمرکز مراقبت شما بر این است که زندگی را تا حد امکان به طور کامل داشته باشید و در این زمان سخت تا آن جا که میتوانید احساس خوبی داشته باشید.
امیدوار ماندن
امید شما برای زندگی بدون سرطان ممکن است چندان روشن نباشد اما هنوز امیدی برای لحظات خوب با خانواده و دوستان وجود دارد – اوقاتی که پر از شادی و معنا هستند. توقف در این زمان در درمان سرطان به شما این فرصت را میدهد که دوباره روی مهم ترین چیزهای زندگی خود تمرکز کنید. اکنون ممکن است زمانی باشد که کارهایی را انجام دهید که همیشه میخواستید انجام دهید و از انجام کارهایی که دیگر نمیخواهید انجام دهید، دست بردارید.
اگرچه سرطان ممکن است خارج از کنترل شما باشد، هنوز انتخابهایی وجود دارد که میتوانید انجام دهید.
زندگی به عنوان یک بازمانده از سندرم میلودیسپلاستیک
از آن جایی که درمان سندرمهای میلودیسپلاستیک (MDS) بسیار سخت است، اکثر افراد مبتلا به MDS هرگز درمان را کامل نمیکنند. افراد ممکن است یک سری از درمانها را با استراحت در بین آنها دریافت کنند. برخی از افراد ممکن است تصمیم بگیرند که درمان فعال را به نفع مراقبتهای حمایتی متوقف کنند. یادگیری زندگی با سرطانی که از بین نمیرود میتواند دشوار و بسیار استرس زا باشد.
مراقبتهای بعدی
صرف نظر از اینکه شما به طور فعال برای MDS تحت درمان هستید یا خیر، پزشکانتان همچنان میخواهند شما را از نزدیک تحت نظر داشته باشند، بنابراین بسیار مهم است که به تمام قرارهای ملاقات بعدی مراجعه کنید.
امتحانات و تستها
در طول ویزیتهای بعدی، پزشک شما در مورد علائم سؤال میکند، شما را معاینه میکند و ممکن است آزمایش خون را تجویز کند. آنها همچنان مراقب علائم عفونت یا پیشرفت به لوسمی و همچنین عوارض جانبی کوتاه مدت و بلند مدت درمان خواهند بود. این زمان خوبی برای شما است که هر سوالی را که نیاز به پاسخ دارید از تیم مراقبتهای بهداشتی خود بپرسید و در مورد نگرانیهایی که ممکن است داشته باشید صحبت کنید.
تقریباً هر نوع درمان سرطان میتواند عوارض جانبی داشته باشد. برخی ممکن است مدت زیادی دوام نیاورند اما برخی دیگر میتوانند دائمی باشند. دریغ نکنید که در مورد علائم یا عوارض جانبی که شما را آزار میدهد به تیم مراقبت خود بگویید تا بتوانند به شما در مدیریت آنها کمک کنند.
نگهداری از بیمه درمانی و کپی از سوابق پزشکی شما
حفظ بیمه درمانی بسیار مهم است. با یک بیماری مزمن مانند MDS، درمان شما ممکن است هرگز به پایان نرسد. شما نمیخواهید نگران پرداخت هزینه آن باشید. بسیاری از مردم به دلیل هزینههای پزشکی ورشکسته شده اند.
در برخی مواقع پس از درمان، ممکن است به پزشک جدیدی مراجعه کنید که از سابقه پزشکی شما اطلاعی ندارد. مهم است که کپیهایی از سوابق پزشکی خود را نگه دارید تا به پزشک جدید خود جزئیات تشخیص و درمان خود را ارائه دهید.
آیا میتوانم خطر پیشرفت MDS را کاهش دهم؟
اگر مبتلا به MDS هستید، احتمالاً میخواهید بدانید که آیا کارهایی وجود دارد که میتوانید برای کاهش خطر پیشرفت آن انجام دهید، مانند ورزش کردن، خوردن نوع خاصی از رژیم غذایی یا مصرف مکملهای غذایی. در حال حاضر، اطلاعات کافی در مورد MDS وجود ندارد تا با اطمینان بگوییم که آیا کارهایی وجود دارد که میتوانید انجام دهید تا به شما کمک کنند.
اتخاذ رفتارهای سالم مانند سیگار نکشیدن، خوب غذا خوردن، فعالیت بدنی منظم و حفظ وزن مناسب ممکن است کمک کننده باشند اما هیچ کس به طور قطع نمیداند. با این حال، ما میدانیم که این نوع تغییرات میتواند اثرات مثبت بسیاری بر سلامت شما داشته باشد، از جمله کمک به داشتن احساس بهتر.
درباره مکملهای غذایی
تاکنون نشان داده نشده است که هیچ مکمل غذایی (از جمله ویتامینها، مواد معدنی و محصولات گیاهی) به وضوح به کاهش خطر پیشرفت MDS کمک کند. این بدان معنا نیست که هیچ مکملی کمکی نخواهد کرد اما مهم است که بدانید هیچ کدام این کار را ثابت نکرده اند.
مکملهای غذایی مانند داروها در ایالات متحده تنظیم نمیشوند – لازم نیست قبل از فروش، اثر بخشی (یا حتی ایمن بودن) آنها ثابت شود، اگرچه محدودیتهایی برای ادعای اینکه میتوانند انجام دهند، وجود دارد. اگر به مصرف هر نوع مکمل غذایی فکر میکنید، با تیم مراقبتهای بهداشتی خود صحبت کنید. آنها میتوانند به شما کمک کنند تصمیم بگیرید که کدام یک را میتوانید با خیال راحت استفاده کنید و در عین حال از مواردی که ممکن است مضر باشند اجتناب کنید.
دریافت حمایت عاطفی
زمانی که MDS بخشی از زندگی شما باشد، مقداری احساس افسردگی، اضطراب یا نگرانی طبیعی است. برخی افراد بیش از دیگران تحت تأثیر قرار میگیرند اما همه میتوانند از کمک و حمایت افراد دیگر بهره مند شوند، خواه دوستان و خانواده، گروههای مذهبی، گروههای حمایتی، مشاوران حرفه ای یا دیگران.
چه چیز جدیدی در تحقیقات سندرم میلودیسپلاستیک وجود دارد؟
تحقیقات در مورد علل، تشخیص و درمان سندرمهای میلودیسپلاستیک (MDS) در بسیاری از مراکز تحقیقات سرطان در سراسر جهان انجام میشود.
ژنتیک و بیولوژی MDS
دانشمندان در حال پیشرفت در درک این موضوع هستند که چگونه تغییرات در DNA (ژنها) درون سلولهای طبیعی مغز استخوان میتواند باعث تبدیل آنها به سلولهای میلودیسپلاستیک شود. همچنین واضح است که همه موارد MDS تغییرات ژنی یکسانی ندارند. درک بهتر از این به طبقه بندی بهتر انواع مختلف MDS و تعیین پیش آگهی احتمالی (چشم انداز) فرد کمک میکند. همچنین ممکن است به تعیین اینکه کدام بیماران ممکن است از انواع مختلف درمان بیشتر سود ببرند، کمک کند.
دانشمندان همچنین در حال یادگیری چگونگی تأثیر سلولهای استرومایی مغز استخوان بر سلولهای MDS هستند. سلولهای استرومایی در مغز استخوان به سلولهای خونی تبدیل نمیشوند. در عوض، آنها به حمایت، تغذیه و تنظیم سلولهای خون ساز کمک میکنند. برخی مطالعات نشان میدهند که اگرچه سلولهای استرومایی در بیماران MDS سرطانی نیستند اما طبیعی نیز نیستند و به نظر میرسد در ایجاد MDS نقش دارند. دانشمندان برخی از سیگنالهای شیمیایی را که بین سلولهای استرومایی و سلولهای MDS رد و بدل میشوند، شناسایی کرده اند.
همان طور که اطلاعات بیشتر از این تحقیق آشکار میشود، ممکن است برای کمک به توسعه داروهای جدید یا انواع دیگر درمان استفاده شود.
شیمی درمانی (Chemotherapy)
مطالعاتی برای یافتن داروهای جدید و ترکیبات دارویی که ممکن است بهتر عمل کنند و همچنین عوارض جانبی کمتر جدیتری داشته باشند، در حال انجام است.
داروهایی به نام عوامل هیپومتیل کننده، مانند آزاسیتیدین (Vidaza) و دسیتابین (Dacogen)، در حال حاضر برخی از موثرترین داروها در درمان MDS هستند اما آنها برای همه مفید نیستند و در نهایت برای اکثر مردم کار نمیکنند. گوادسیتابین (Guadecitabine) داروی جدیدتری است که مربوط به دسیتابین است اما مدت بیشتری در داخل سلولها باقی میماند، بنابراین در تئوری ممکن است بهتر عمل کند. این به برخی از افراد در مطالعات اولیه کمک کرده است و اکنون در یک مطالعه بزرگتر مورد آزمایش قرار میگیرد.
محققان همچنین در حال آزمایش اشکال خوراکی (از راه دهان) آزاسیتیدین و دسیتابین هستند که ممکن است برای بیماران راحت تر باشند.
همچنین تحقیقاتی در حال انجام است تا مشخص شود آیا برخی از بیماران ممکن است از شیمی درمانی شدیدتر بهره مند شوند یا خیر.
سرکوب سیستم ایمنی
در برخی از افراد مبتلا به MDS، به نظر میرسد که سیستم ایمنی در تولید طبیعی سلولهای خونی اختلال ایجاد میکند. برخی از داروها، مانند ATG و سیکلوسپورین، در حال حاضر برای درمان برخی از افراد مبتلا به MDS استفاده میشوند. محققان اکنون به دنبال راههای دیگری برای سرکوب سیستم ایمنی در افراد مبتلا به MDS هستند تا ببینند آیا این ممکن است مفید باشد یا خیر.
درمان هدفمند (Targeted therapy)
داروهای درمان هدفمند متفاوت از داروهای شیمی درمانی استاندارد عمل میکنند. آنها بر بخشهای خاصی از سلولهای سرطانی تأثیر میگذارند که آنها را از سلولهای طبیعی و سالم متفاوت میکند. داروهای هدفمند ممکن است در برخی موارد که شیمیدرمانی مؤثر نیست، کار کنند و معمولاً عوارض جانبی متفاوتی (و گاهی کمتر شدید) دارند. داروهای هدفمند اکنون بخشی از درمان بسیاری از انواع سرطان هستند و برای استفاده در MDS نیز در حال مطالعه هستند.
به عنوان مثال، لوسپاترسپت (luspatercept) داروی جدیدی است که پروتئینهای سلولی را که بخشی از ابر خانواده TGF-بتا هستند، مسدود میکند. این پروتئینها تولید گلبولهای قرمز را کند میکنند. در مطالعات اولیه، این دارو در افزایش سطح گلبولهای قرمز خون در افراد مبتلا به اشکال کم خطر MDS بسیار نویدبخش بوده است. مطالعات بیشتر در مورد این دارو و داروهای مشابه در حال انجام است.
Rigosertib یک داروی جدید است که چندین پروتئین مختلف را هدف قرار میدهد که به طور معمول به رشد سلولهای سرطانی کمک میکنند. این دارو در مطالعات اولیه نشان داده است که به برخی از افراد مبتلا به MDS پرخطر کمک میکند و این دارو اکنون برای استفاده به تنهایی و همراه با آزاسیتیدین در حال مطالعه است.
سایر داروهای هدفمند جدید که اکنون برای استفاده در MDS مورد مطالعه قرار گرفته اند عبارتند از:
- Imetelstat، یک مهارکننده تلومراز
- Pevonedistat، یک مهارکننده NAE
- سلینکسور، یک مهارکننده XPO1
- Glasdegib، یک مهارکننده صاف شده (smoothened inhibitor یا SMO)
بسیاری از داروهای درمان هدفمند دیگر نیز اکنون در حال مطالعه هستند.
اطلاعات کلی بیشتر در مورد این نوع درمان را میتوان در مبحث درمان هدفمند یافت.
پیوند سلولهای بنیادی
دانشمندان همچنان به اصلاح این روش برای افزایش اثربخشی، کاهش عوارض و تعیین اینکه کدام بیماران بیشتر از این درمان کمک میکنند، ادامه میدهند.
همچنین بخوانید:
- آشنایی با PCR
- سیتوژنتیک چیست؟
- فلوسایتومتری چیست؟
- لکوسیتوز چیست؟ تعداد بالای گلبولهای سفید خون
- خونسازی و شناخت انواع سلول های خونی
مترجم: فاطمه فریادرس