سرطان زمانی شروع میشود که سلولهای بدن شروع به رشد خارج از کنترل میکنند. تقریباً سلولهای در هر قسمت از بدن میتوانند به سرطان تبدیل شوند و به سایر قسمتهای بدن گسترش یابند. لوسمی مزمن میلوئیدی (CML) همچنین به عنوان لوسمی میلوژن مزمن (chronic myelogenous leukemia) شناخته میشود. این بیماری یک نوع سرطان است که در سلولهای خون ساز خاصی در مغز استخوان شروع میشود.
در CML، یک تغییر ژنتیکی در نسخه اولیه (نابالغ) سلولهای میلوئیدی – سلولهایی که گلبولهای قرمز خون، پلاکتها و بسیاری از انواع گلبولهای سفید (به جز لنفوسیتها) را میسازند، رخ میدهد.
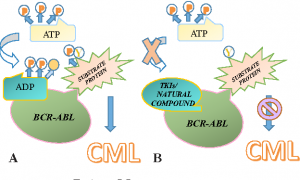
این تغییر یک ژن غیر طبیعی به نام BCR-ABL را تشکیل میدهد که سلول را به سلول CML تبدیل میکند. سلولهای لوسمی رشد میکنند و تقسیم میشوند، در مغز استخوان تجمع مییابند و به خون میریزند. با گذشت زمان، سلولها میتوانند در سایر قسمتهای بدن از جمله طحال نیز مستقر شوند. لوسمی مزمن میلوئیدی یک سرطان خون با رشد نسبتاً آهسته است اما میتواند به یک لوسمی حاد با رشد سریع تبدیل شود که درمان آن سخت است.
CML بیشتر در بزرگسالان رخ میدهد اما به ندرت کودکان را نیز درگیر میکند. به طور کلی روند درمان آنها نیز مانند بزرگسالان است.
لوسمی (leukemia) چیست؟
لوسمی سرطانی است که در سلولهای خون ساز مغز استخوان شروع میشود. وقتی یکی از این سلولها تغییر میکند و تبدیل به سلول سرطانی خون میشود، دیگر آن طور که باید بالغ نمیشود. اغلب، این سلولها برای ساختن سلولهای جدید سریعتر از حد معمول تقسیم میشوند. همچنین سلولهای لوسمی زمانی که باید بمیرند، نمیمیرند.
آنها در مغز استخوان انباشته میشوند و سلولهای طبیعی را از بین میبرند. در برخی مواقع، سلولهای لوسمی مغز استخوان را ترک میکنند و به جریان خون میریزند و اغلب باعث افزایش تعداد گلبولهای سفید خون (WBCs) در خون میشوند. سلولهای لوسمی هنگامی که به خون وارد شوند میتوانند به سایر اندامها گسترش پیدا کنند، جایی که میتوانند سلولهای دیگر بدن را از عملکرد صحیحشان باز دارند.
سرطان خون با انواع دیگر سرطان که در اندامهایی مانند ریه، روده بزرگ یا سینه شروع میشود و سپس به مغز استخوان گسترش مییابد متفاوت است. سرطانهایی که از قسمت دیگری از بدن شروع میشوند و سپس به مغز استخوان گسترش مییابند، سرطان خون نیستند.
همه لوسمیها یکسان نیستند. دانستن نوع خاص سرطان خون به پزشکان کمک میکند تا وضعیت آتی (چشم انداز) هر بیمار را بهتر پیش بینی کرده و بهترین درمان را برای وی برنامه ریزی کنند.
لوسمی مزمن (chronic leukemia) چیست؟
یک لوسمی بسته به این که بیشتر سلولهای غیر طبیعی، نابالغ (بیشتر شبیه سلولهای بنیادی هستند) یا بالغ ( بیشتر شبیه گلبولهای سفید طبیعی هستند) هستند، حاد (acute) یا مزمن (chronic) میشود.
در لوسمی مزمن، سلولها تا حدی بالغ میشوند اما نه به طور کامل. این سلولها ممکن است نسبتاً طبیعی به نظر برسند اما در واقع این طور نیستند. آنها به طور کلی مانند گلبولهای سفید معمولی با عفونت مبارزه نمیکنند.
سلولهای لوسمی نیز طولانیتر از سلولهای طبیعی عمر میکنند، ساخته میشوند و سلولهای طبیعی در مغز استخوان را از بین میبرند. ممکن است مدت زیادی طول بکشد تا لوسمیهای مزمن مشکلاتی را ایجاد کنند و بیشتر افراد میتوانند سالها با این بیماریها زندگی کنند. اما درمان لوسمیهای مزمن به طور کلی سخت تر از لوسمیهای حاد است.
لوسمی میلوئیدی (myeloid leukemia) چیست؟
اینکه سرطان خون میلوئیدی یا لنفوسیتی است بستگی به این دارد که سرطان در کدام سلولهای مغز استخوان شروع شده است.
- لوسمیهای میلوئیدی (همچنین به عنوان لوسمیهای میلوسیتیک (myelocytic)، میلوژن، یا غیرلنفوسیتی (non-lymphocytic) شناخته میشوند) در سلولهای میلوئیدی اولیه شروع میشوند – سلولهایی که تبدیل به گلبولهای سفید خون (به غیر از لنفوسیتها)، گلبولهای قرمز خون، یا سلولهای پلاکت ساز (مگاکاریوسیتها یا megakaryocytes) میشوند.
- لوسمیهای لنفوسیتی (همچنین به عنوان لوسمیهای لنفوئیدی (lymphoid) یا لنفوبلاستیک (lymphoblastic) شناخته میشوند) در سلولهایی که تبدیل به لنفوسیت میشوند، آغاز میشوند.
انواع دیگر لوسمی چیست؟
بر اساس حاد یا مزمن بودن و میلوئیدی یا لنفوسیتی بودن آنها، 4 نوع اصلی سرطان خون (لوسمی) وجود دارد:
- لوسمی حاد میلوئیدی (یا میلوژن) (AML)
- لوسمی مزمن میلوئیدی (یا میلوژن) (CML)
- لوسمی حاد لنفوسیتی (یا لنفوبلاستیک) (ALL)
- لوسمی مزمن لنفوسیتی (CLL)
در لوسمیهای حاد، سلولهای مغز استخوان نمیتوانند آن طور که باید بالغ شوند. این سلولهای نابالغ به تولید مثل و ساخته شدن ادامه میدهند. بدون درمان، اکثر افراد مبتلا به لوسمی حاد تنها چند ماه زنده خواهند ماند. برخی از انواع لوسمی حاد به خوبی به درمان پاسخ میدهند و بسیاری از بیماران قابل درمان هستند. سایر انواع لوسمی حاد چشم انداز کمتر مطلوبی دارند.
لوسمیهای لنفوسیتی از سلولهایی شروع میشوند که تبدیل به لنفوسیت میشوند. لنفومها (lymphoma) نیز سرطانهایی هستند که در این سلولها (لنفوسیتها) شروع میشوند. تفاوت اصلی بین لوسمیهای لنفوسیتی و لنفوم در این است که در لوسمی، سلول سرطانی عمدتاً در مغز استخوان و خون وجود دارند، در حالی که در لنفوم این سلول ها در غدد لنفاوی و سایر بافتها قرار دارد.
لوسمی مزمن میلومونوسیتی (Chronic myelomonocytic leukemia یا CMML) لوسمی مزمن دیگری است که در سلولهای میلوئیدی شروع میشود.
آمار کلیدی برای لوسمی میلوئید مزمن
برآوردهای انجمن سرطان آمریکا برای لوسمی مزمن میلوئیدی (CML) در ایالات متحده برای سال 2022 عبارتند از:
- حدود 8860 مورد جدید با لوسمی مزمن میلوئیدی تشخیص داده خواهد شد (5120 مورد در مردان و 3740 مورد در زنان).
- حدود 1220 نفر بر اثر لوسمی مزمن میلوئیدی خواهند مرد (670 مرد و 550 زن).
حدود 15 درصد از کل موارد جدید لوسمی، لوسمی میلوئیدی مزمن است. حدود 1 نفر از هر 526 نفر در طول زندگی خود در ایالات متحده به CML مبتلا میشود.
میانگین سنی در تشخیص لوسمی مزمن میلوئیدی حدود 64 سال است. تقریبا نیمی از موارد در افراد 65 سال و بالاتر تشخیص داده میشود. این نوع لوسمی عمدتاً بزرگسالان را مبتلا میکند و به ندرت در کودکان دیده میشود.
همچنین بخوانید:
علائم و نشانههای لوسمی میلوئید مزمن
علائم لوسمی مزمن میلوئیدی (CML) اغلب مبهم است و اغلب ناشی از موارد دیگری است. این علائم عبارتند از:
- ضعف
- خستگی
- تعریق شبانه
- کاهش وزن
- تب
- درد استخوان (ناشی از انتشار سلولهای سرطان خون از حفره مغز استخوان به سطح آن یا داخل مفصل)
- بزرگ شدن طحال (به صورت توده ای در زیر سمت چپ قفسه سینه احساس میشود)
- درد یا احساس «پری» در شکم
- احساس سیری بعد از خوردن حتی مقدار کمی غذا
اما این ها فقط علائم لوسمی مزمن میلوئیدی نیستند. آنها میتوانند همراه با سرطانهای دیگر و همچنین با بسیاری از بیماریهایی که سرطان نیستند، رخ دهند.
مشکلات ناشی از کمبود سلولهای خونی
بسیاری از علائم و نشانههای CML به این دلیل رخ میدهد که سلولهای سرطان خون جایگزین سلولهای خون ساز طبیعی مغز استخوان میشوند. در نتیجه، افراد مبتلا به لوسمی ملوسمی مزمن میلوئیدیزمن میلوئیدی به اندازه کافی گلبولهای قرمز، گلبولهای سفید و پلاکتهایی که به درستی کار کنند، نمیسازند.
- کم خونی (Anemia)، کمبود گلبولهای قرمز خون است. این وضعیت میتواند باعث ضعف، خستگی و تنگی نفس شود.
- لکوپنی (Leukopenia)، کمبود گلبولهای سفید طبیعی است. این کمبود خطر ابتلا به عفونت را افزایش میدهد. اگرچه بیماران مبتلا به لوسمی ممکن است تعداد گلبولهای سفید خون بسیار بالایی داشته باشند، سلولهای لوسمی مانند گلبولهای سفید طبیعی در برابر عفونت محافظت نمیکنند.
- نوتروپنی (Neutropenia) به این معنی است که سطح نوتروفیلهای (neutrophils) طبیعی پایین است. نوتروفیلها، نوعی گلبول سفید خون، در مبارزه با عفونت باکتریایی بسیار مهم هستند. افرادی که نوتروپنیک هستند در معرض خطر بالایی برای ابتلا به عفونتهای باکتریایی بسیار جدی میباشند.
- ترومبوسیتوپنی (Thrombocytopenia) کمبود پلاکت خون است. این حالت میتواند منجر به کبودی یا خونریزی آسان همراه با خونریزیهای مکرر یا شدید بینی و خونریزی لثهها شود. برخی از بیماران مبتلا به لوسمی مزمن میلوئیدی در واقع تعداد زیادی پلاکت دارند (ترومبوسیتوز یا thrombocytosis). اما این پلاکتها اغلب آن طور که باید کار نمیکنند، بنابراین این افراد اغلب مشکلاتی در خونریزی و کبودی نیز دارند.
شایع ترین علامت CML تعداد غیر طبیعی گلبولهای سفید خون است.
چه چیزی باعث لوسمی مزمن میلوئیدی میشود؟
سلولهای طبیعی انسان عمدتاً بر اساس اطلاعات موجود در کروموزومهای هر سلول رشد و عمل میکنند. کروموزومها مولکولهای طولانی DNA در هر سلول هستند. DNA ماده شیمیایی است که ژنهای – دستور العملهایی برای نحوه عملکرد سلولهای ما – ما را حمل میکند. ما شبیه والدین خود هستیم زیرا آنها منبع DNA ما هستند. اما ژنهای ما چیزی بیشتر از ظاهر ما را تحت تأثیر میگذارند.
هر بار که سلولی برای تقسیم به 2 سلول جدید آماده میشود، باید یک کپی جدید از DNA در کروموزومهای خود بسازد. این فرآیند کامل نیست و ممکن است خطاهایی در طی آن رخ دهد که ممکن است بر ژنهای درون DNA تأثیر بگذارد.
برخی از ژنها زمان رشد و تقسیم سلولهای ما را کنترل میکنند.
- ژنهای خاصی که باعث رشد و تقسیم سلولی میشوند، انکوژن (oncogenes) نامیده میشوند.
- سایر مواردی که تقسیم سلولی را کند میکنند یا باعث میشوند سلولها در زمان مناسب بمیرند، ژنهای سرکوب کننده تومور (tumor suppressor genes) نامیده میشوند.
سرطانها میتوانند ناشی از تغییرات در DNA (جهش) باشند که انکوژنها را فعال کرده یا ژنهای سرکوب کننده تومور را خاموش میکند.
در چند سال گذشته، دانشمندان در درک اینکه چگونه تغییرات خاصی در DNA میتواند باعث شود سلولهای طبیعی مغز استخوان به سلولهای سرطانی خون تبدیل شوند، پیشرفت زیادی کردهاند. این پدیده در هیچ سرطانی بهتر از لوسمی مزمن میلوئیدی (CML) درک نشده است.
هر سلول انسانی دارای 23 جفت کروموزوم است. بیشتر موارد لوسمی مزمن میلوئیدی در طول تقسیم سلولی شروع میشود، زمانی که DNA بین کروموزومهای 9 و 22 “مبادله یا swapped” میشود. بخشی از کروموزوم 9 به 22 و بخشی از 22 به 9 منتقل میشود.
این پدیده به عنوان جابجایی (translocation) شناخته میشود و کروموزوم 22 را میسازد که کوتاهتر از حد طبیعی است. این کروموزوم غیر طبیعی جدید کروموزوم فیلادلفیا (Philadelphia chromosome) نامیده میشود. کروموزوم فیلادلفیا در سلولهای لوسمی تقریباً همه بیماران مبتلا به CML یافت میشود.
مبادله DNA بین کروموزومها منجر به تشکیل یک ژن جدید (یک انکوژن) به نام BCR-ABL میشود. سپس این ژن پروتئین BCR-ABL را تولید میکند که نوعی پروتئین به نام تیروزین کیناز (tyrosine kinase) است. این پروتئین باعث میشود سلولهای لوسمی مزمن میلوئیدی رشد کرده و بدون کنترل تقسیم شوند.
در تعداد بسیار کمی از بیماران لوسمی مزمن میلوئیدی، سلولهای لوسمی دارای انکوژن BCR-ABL هستند اما کروموزوم فیلادلفیا را ندارند. تصور میشود که ژن BCR-ABL باید به روشی متفاوت در این افراد شکل بگیرد. در تعداد کمتری از افرادی که به نظر میرسد CML دارند، نه کروموزوم فیلادلفیا و نه انکوژن BCR-ABL یافت نمیشود. آنها ممکن است انکوژنهای ناشناخته دیگری داشته باشند که باعث بروز بیماری آنها شده باشد و در واقع CML در نظر گرفته نمیشود.
گاهی اوقات افراد، جهشهای DNA را از والدین خود به ارث میبرند که خطر ابتلا به انواع خاصی از سرطان را تا حد زیادی افزایش میدهند اما جهشهای منتقل شده توسط والدین باعث ایجاد CML نمیشود. تغییرات DNA مربوط به لوسمی مزمن میلوئیدی در طول زندگی فرد رخ میدهد، نه اینکه قبل از تولد به ارث برسد.
مراحل (سطوح) لوسمی مزمن میلوئیدی
اکثر انواع سرطان بر اساس اندازه تومور و وسعت گسترش سرطان به مرحله ای اختصاص داده میشوند. تعیین این مراحل میتوانند در تصمیم گیریهای درمانی و پیش بینی وضعیت بیمار (چشم انداز) مفید باشند.
اما از آن جایی که لوسمی مزمن میلوئیدی (CML) یک بیماری مغز استخوان است، مانند اکثر سرطانها مرحله بندی نمیشود. چشم انداز فرد مبتلا به CML به مرحله بیماری و میزان تجمع سلولهای سرطانی در مغز استخوان و همچنین به عوامل دیگری مانند سن بیمار، شمارش سلولهای خونی و بزرگ شدن طحال بستگی دارد.
CML به 3 گروه طبقه بندی میشود که به پیش بینی چشم انداز بیمار کمک میکند. پزشکان به این گروهها به جای مرحله، فاز (phase) میگویند. این مراحل عمدتاً بر اساس تعداد گلبولهای سفید نابالغ (بلاست یا blasts) در خون یا مغز استخوان تعیین میشوند.
گروههای مختلف متخصصان، معیارهای کمی متفاوت را برای تعریف فازها پیشنهاد کردهاند اما یک سیستم مشترک (پیشنهاد شده توسط سازمان بهداشت جهانی یا WHO) در زیر توضیح داده شده است. ممکن است همه پزشکان با این معیارها برای مراحل مختلف موافق نباشند یا از آنها پیروی نکنند. اگر در مورد مرحله لوسمی مزمن میلوئیدی خود سؤالی دارید، حتماً از پزشک خود بخواهید آن را به روشی که شما درک میکنید برای شما توضیح دهد.
فاز مزمن (Chronic phase)
بیماران در فاز مزمن معمولاً کمتر از 10 درصد بلاست در نمونه خون یا مغز استخوان خود دارند. این بیماران معمولاً علائم نسبتاً خفیفی دارند (در صورت وجود) و معمولاً به درمانهای استاندارد پاسخ میدهند. اکثر بیماران در مرحله مزمن تشخیص داده میشوند.
فاز تسریع شده (Accelerated phase)
در صورت صحت هر یک از موارد زیر، بیماران در فاز تسریع شده در نظر گرفته میشوند:
- نمونههای خون 15 درصد یا بیشتر، اما کمتر از 30 درصد بلاست دارند.
- بازوفیلها 20 درصد یا بیشتر از خون را تشکیل میدهند.
- بلاستها و پرومیلوسیتها (promyelocyte) با هم 30 درصد یا بیشتر از خون را تشکیل میدهند.
- تعداد پلاکت بسیار کم (100×1000 در هر میلی متر مکعب یا کمتر) که در اثر روند درمان ایجاد نمیشود.
- تغییرات کروموزومی جدید در سلولهای لوسمی با کروموزوم فیلادلفیا
بیمارانی که لوسمی مزمن میلوئیدی آنها در مرحله تسریع است ممکن است علائمی مانند تب، کم اشتهایی و کاهش وزن داشته باشند. لوسمی مزمن میلوئیدی در فاز تسریع شده به اندازه لوسمی مزمن میلوئیدی در فاز مزمن به درمان پاسخ نمیدهد.
فاز تجمع (Blast phase که فاز حاد (acute phase) یا بحران تجمع (blast crisis) نیز نامیده میشود)
نمونههای مغز استخوان یا خون از یک بیمار در این مرحله دارای 20 درصد یا بیشتر بلاست هستند. خوشههای بزرگی از بلاستها در مغز استخوان دیده میشود. سلولهای بلاست به بافتها و اندامهای فراتر از مغز استخوان گسترش یافته اند. این بیماران اغلب تب، کم اشتهایی و کاهش وزن دارند. در این مرحله، لوسمی مزمن میلوئیدی بسیار شبیه به لوسمی حاد عمل میکند.
عوامل پیش بینی کننده برای لوسمی میلوئید مزمن
همراه با مرحله لوسمی مزمن میلوئیدی، عوامل دیگری وجود دارد که ممکن است به پیش بینی چشم انداز بقا در بیماران کمک کند. این عوامل گاهی اوقات هنگام انتخاب نوع روند درمان مفید هستند. عواملی که با زمان بقای کوتاهتر مرتبط هستند، عوامل پیش بینی کننده نامطلوب (adverse prognostic factors) نامیده میشوند.
عوامل نامطلوب پیش بینی کننده:
- فاز تسریع شده یا فاز تجمع
- بزرگ شدن طحال
- نواحی آسیب دیده استخوان ناشی از رشد لوسمی
- افزایش تعداد بازوفیلها (basophils) و ائوزینوفیلها (eosinophils) – انواع خاصی از گرانولوسیتها – در نمونههای خون
- تعداد پلاکت بسیار بالا یا بسیار پایین
- سن 60 سال یا بیشتر
- تغییرات کروموزومی متعدد در سلولهای CML

بسیاری از این عوامل در سیستم Sokal در نظر گرفته میشوند که امتیازی را برای کمک به پیش بینی وضعیت بیمار ایجاد میکند. این سیستم سن فرد، درصد بلاست و تجمع در خون، اندازه طحال و تعداد پلاکتها را در نظر میگیرد.
از این عوامل برای تقسیم بیماران به گروههای کم خطر، متوسط یا پرخطر استفاده میشود. سیستم دیگری به نام رتبه یورو (Euro score) شامل فاکتورهای فوق و همچنین درصد بازوفیلها و ائوزینوفیلهای خون میباشد. داشتن تعداد بیشتری از این سلولها نشاندهنده چشم انداز ضعیفتر است.
مدلهای Sokal و Euro در گذشته مفید بودند، قبل از اینکه داروهای جدیدتر و موثرتری برای لوسمی مزمن میلوئیدی ساخته شوند. مشخص نیست که آنها در حال حاضر چقدر در پیش بینی چشم انداز یک فرد مفید هستند. داروهای درمان هدفمند (Targeted therapy drugs) مانند ایماتینیب (Gleevec یا imatinib) درمان CML را به طور چشمگیری تغییر داده است. این مدلها در افرادی که تحت درمان با این داروها هستند، آزمایش نشده است.
عوامل خطرزا برای لوسمی میلوئیدی مزمن
عامل خطرزا چیزی است که بر شانس ابتلای فرد به بیماری مانند سرطان تأثیر میگذارد. به عنوان مثال، قرار گرفتن پوست در معرض نور شدید خورشید یک عامل خطرزا برای سرطان پوست است. سیگار کشیدن یک عامل خطرزا برای تعدادی از سرطانها است. اما داشتن یک عامل خطرساز یا حتی بسیاری از این عوامل به این معنی نیست که شما به این بیماری مبتلا خواهید شد. بسیاری از افرادی که به این بیماری مبتلا میشوند ممکن است هیچ عامل خطرزا شناخته شده ای نداشته باشند.
تنها عوامل خطرزا برای لوسمی مزمن میلوئیدی (CML) عبارتند از:
- قرار گرفتن در معرض تشعشع: قرار گرفتن در معرض تشعشعات با دوز بالا (مانند زنده ماندن از انفجار بمب اتمی یا حادثه راکتور هسته ای) خطر ابتلا به لوسمی مزمن میلوئیدی را افزایش میدهد.
- سن: خطر ابتلا به لوسمی مزمن میلوئیدی با افزایش سن افزایش مییابد.
- جنسیت: این بیماری در مردان کمی بیشتر از زنان است اما علت آن مشخص نیست.
هیچ عامل خطر اثبات شده دیگری برای لوسمی مزمن میلوئیدی وجود ندارد. به نظر نمیرسد خطر ابتلا به لوسمی مزمن میلوئیدی تحت تأثیر سیگار کشیدن، رژیم غذایی، قرار گرفتن در معرض مواد شیمیایی یا عفونتها قرار گیرد. همچنین لوسمی مزمن میلوئیدی در خانوادهها ایجاد نمیشود و یک سرطان ارثی نیست.
آیا لوسمی میلوئیدی مزمن را میتوان زودتر تشخیص داد؟
انجمن سرطان آمریکا آزمایشهای غربالگری برای برخی سرطانها را در افرادی که هیچ علامتی ندارند توصیه میکند زیرا این سرطانها در صورت تشخیص زود هنگام دارای درمان آسان تری هستند. اما در این زمان، هیچ آزمایش غربالگری به طور معمول برای تشخیص زود هنگام لوسمی مزمن میلوئیدی (CML) توصیه نمیشود.
گاهی اوقات میتوان لوسمی مزمن میلوئیدی را زمانی که آزمایشات معمولی خون به دلایل دیگری انجام میشود، پیدا کرده و تشخیص داد. نتایج آزمایش ممکن است نشان دهد که تعداد گلبولهای سفید خون فرد بسیار بالا است، حتی اگر هیچ علامتی نداشته باشد.
مهم است که هر گونه علائمی را که میتواند ناشی از لوسمی مزمن میلوئیدی باشد، فوراً به پزشک گزارش دهید.
آزمایشات برای لوسمی میلوئیدی مزمن
بسیاری از افراد مبتلا به لوسمی مزمن میلوئیدی (CML) هنگامی که مبتلا به این بیماری تشخیص داده میشوند، علائمی ندارند. لوسمی اغلب زمانی پیدا میشود که پزشک آزمایشهای خون را برای یک اختلال در سلامتی نامرتبط یا در طول معاینه معمولی تجویز کند. حتی زمانی که علائمی هم وجود دارد، اغلب این علائم مبهم و غیر اختصاصی هستند.
تستهای آزمایشگاهی
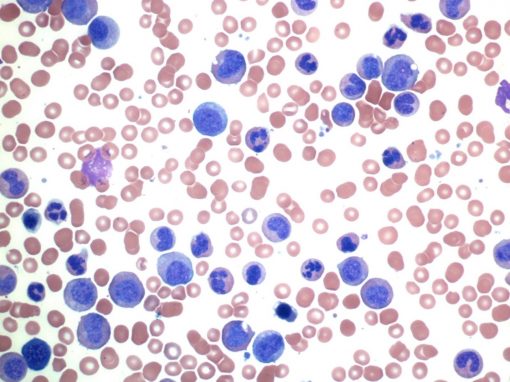
اگر علائم و نشانهها حاکی از ابتلا به سرطان خون باشند، پزشک باید خون و مغز استخوان شما را بررسی کند تا از این تشخیص مطمئن شود. خون معمولا از ورید بازوی شما گرفته میشود. مقدار کمی از مغز استخوان با آسپیراسیون مغز استخوان (bone marrow aspiration) و بیوپسی (biopsy) برداشته میشود. این نمونهها به آزمایشگاه فرستاده میشوند و در آن جا زیر میکروسکوپ برای بررسی وجود سلولهای سرطانی خون تحت آزمایش قرار میگیرند.
شمارش سلولهای خونی (Blood cell counts)
شمارش کامل خون (CBC) آزمایشی است که سطح سلولهای مختلف مانند گلبولهای قرمز، گلبولهای سفید و پلاکتها را در خون شما اندازه گیری میکند. CBC اغلب شامل یک بازه اختلافی (diff) که شمارشی از انواع مختلف گلبولهای سفید خون در نمونه خون شما است. در یک اسمیر خون، مقداری از خون شما روی یک اسلاید گذاشته میشود تا ببیند سلولها در زیر میکروسکوپ چگونه به نظر میرسند.
اکثر افراد مبتلا به لوسمی مزمن میلوئیدی دارای تعداد زیادی گلبول سفید با تعداد زیادی سلول اولیه (نابالغ) به نام میلوبلاست یا بلاست هستند. پزشکان به اندازه و شکل سلولها و اینکه آیا آنها حاوی گرانول (granule) هستند (لکههای کوچکی که در برخی از انواع گلبولهای سفید دیده میشود)، نگاه میکنند.
یک عامل مهم این است که آیا سلولها بالغ به نظر میرسند (مانند سلولهای خونی در گردش طبیعی) یا نابالغ (فقدان ویژگیهای سلولهای خونی در گردش طبیعی). گاهی اوقات بیماران لوسمی مزمن میلوئیدی دارای تعداد کمی گلبول قرمز یا پلاکت خون هستند. حتی اگر این یافتهها نشان دهنده وجود لوسمی باشد، این تشخیص معمولاً باید با آزمایش خون دیگری یا آزمایش مغز استخوان تأیید شود.
نمونههای مغز استخوان
سرطان خون از مغز استخوان شروع میشود، بنابراین بررسی مغز استخوان برای تائید وجود سلولهای سرطانی خون بخش مهمی از آزمایش آن است. نمونههای مغز استخوان از 2 آزمایش که معمولاً همزمان انجام میشوند، به دست میآید:
- آسپیراسیون مغز استخوان (Bone marrow aspiration)
- بیوپسی مغز استخوان (Bone marrow biopsy)
نمونهها معمولاً از پشت استخوان لگن (hip) گرفته میشوند اما گاهی اوقات به جای آن از استخوانهای دیگری نیز استفاده میکنند. اگر قرار باشد فقط آسپیراسیون انجام شود، نمونه برداری ممکن است از جناغ سینه (استخوان سینه) گرفته شود.
برای آسپیراسیون مغز استخوان، روی یک میز دراز بکشید (به پهلو یا روی شکم). پزشک پوست لگن را تمیز میکند و سپس با تزریق یک بی حس کننده موضعی، ناحیه و سطح استخوان را بی حس میکند. این کار ممکن است باعث حس سوختگی یا سوزش مختصری شود.
سپس یک سوزن نازک و تو خالی به استخوان وارد میشود و از یک سرنگ برای مکیدن مقدار کمی از مغز استخوان مایع استفاده میشود. حتی با استفاده از داروی بی حسی، اکثر بیماران هنوز هم در هنگام برداشتن مغز استخوان کمی درد دارند.
بیوپسی مغز استخوان معمولاً درست بعد از آسپیراسیون انجام میشود. یک تکه کوچک از استخوان و مغز آن را با یک سوزن کمی بزرگتر که به پایین و به سمت داخل استخوان فشار داده میشود، بر میدارند. این کار ممکن است باعث درد مختصری نیز شود. پس از انجام بیوپسی، برای کمک به جلوگیری از خونریزی، به محل فشار وارد میشود.
این آزمایشهای مغز استخوان برای کمک به تشخیص سرطان خون استفاده میشوند اما ممکن است بعداً تکرار شوند تا مشخص شود آیا سرطان خون به روند درمان پاسخی میدهد یا خیر.
یکی از ویژگیهای مهم نمونه مغز استخوان این است که چه مقدار از آن سلولهای خون ساز است. این نسبت به عنوان سلولاریتی (cellularity) شناخته میشود. مغز استخوان طبیعی شامل سلولهای خون ساز و سلولهای چربی است.
اگر مغز استخوان شما بیش از حد انتظار سلولهای خون ساز داشته باشد، گفته میشود که مغز استخوان هایپرسلولار (hypercellular) است. اگر تعداد بسیار کمی از این سلولها یافت شود، مغز استخوان هیپوسلولار (hypocellular) نامیده میشود.
در افراد مبتلا به لوسمی مزمن میلوئیدی، مغز استخوان اغلب هیپرسلولار است زیرا پر از سلولهای سرطانی خون میباشد. این آزمایشها همچنین ممکن است پس از درمان انجام شوند تا بررسی شود که آیا سرطان خون به درمان پاسخ میدهد یا خیر.
آزمایشات شیمیایی خون
این آزمایشها میزان برخی مواد شیمیایی را در خون شما اندازهگیری میکنند اما برای تشخیص سرطان خون استفاده نمیشوند. آنها میتوانند به یافتن مشکلات کبدی یا کلیوی ناشی از گسترش سلولهای سرطانی خون یا عوارض جانبی برخی داروها کمک کنند. این آزمایشات همچنین به تعیین اینکه آیا شما برای اصلاح سطوح پایین یا بالا برخی از مواد معدنی در خون نیاز به درمان دارید یا خیر، کمک میکند.
آزمایشات ژنتیکی
نوعی آزمایش ژنی برای جستجوی کروموزوم فیلادلفیا و یا ژن BCR-ABL انجام خواهد شد. این نوع آزمایش برای تایید تشخیص CML و کسب اطلاعات بیشتر در مورد سلولهای CML شما استفاده میشود.
سیتوژنتیک کانورشنال (Conventional cytogenetics)
این آزمایش کروموزومها (تکههای DNA) را زیر میکروسکوپ بررسی میکند تا هرگونه تغییری را پیدا کند.
به این آزمایش کاریوتایپ (karyotype) نیز میگویند. از آن جایی که کروموزومها در زمان تقسیم سلولی به بهترین شکل قابل مشاهده هستند، نمونه ای از خون یا مغز استخوان شما باید (در آزمایشگاه) رشد داده شود تا سلولها شروع به تقسیم کنند. این کار زمان میبرد و همیشه هم به خوبی پاسخ نمیدهد.
سلولهای طبیعی انسان دارای 23 جفت کروموزوم هستند که هر کدام اندازه مشخصی دارند. سلولهای لوسمی در بسیاری از بیماران لوسمی مزمن میلوئیدی حاوی کروموزومی غیر طبیعی به نام کروموزوم فیلادلفیا (Ph) هستند که شبیه نسخه کوتاه شده کروموزوم 22 است. این کروموزوم در اثر تعویض قطعات (جابه جایی) بین کروموزومهای 9 و 22 ایجاد میشود.
یافتن کروموزوم Ph در تشخیص لوسمی مزمن میلوئیدی مفید است. اما حتی زمانی که کروموزوم Ph دیده نمیشود، آزمایشهای دیگر اغلب میتوانند ژن BCR-ABL را پیدا کنند. سایر تغییرات کروموزومی را میتوان با آزمایش سیتوژنتیک نیز یافت.
هیبریداسیون در محل فلورسنت (FISH یا Fluorescent in situ hybridization)
FISH روش دیگری برای بررسی کروموزومها است. این آزمایش از رنگهای فلورسنت خاصی استفاده میکند که فقط به ژنها یا قسمتهایی از کروموزومها متصل میشوند. در لوسمی مزمن میلوئیدی میتوان از FISH برای جستجوی قطعات خاصی از ژن BCR-ABL در کروموزومها استفاده کرد. میتوان از آن بر روی نمونههای معمولی خون یا مغز استخوان بدون رشد سلولها استفاده کرد، بنابراین نتایج را سریعتر از سیتوژنتیک کانوکشنال دریافت میکنید.
واکنش زنجیره ای پلیمراز (PCR یا Polymerase chain reaction)
این یک آزمایش فوق حساس است که میتواند برای جستجوی ژن BCR-ABL در سلولهای سرطان خون و اندازه گیری میزان وجود آن استفاده شود. این آزمایش میتواند بر روی نمونههای خون یا مغز استخوان انجام شده و مقادیر بسیار کمی از BCR-ABL را تشخیص دهد، حتی زمانی که پزشکان نمیتوانند کروموزوم فیلادلفیا را در سلولهای مغز استخوان با آزمایش سیتوژنتیک پیدا کنند.
PCR میتواند برای کمک به تشخیص لوسمی مزمن میلوئیدی استفاده شود. همچنین پس از درمان بیماری برای بررسی اینکه آیا نسخههایی از ژن BCR-ABL هنوز وجود دارد یا خیر مفید است. اگر نسخههایی از این ژن یافت شود، به این معنی است که سرطان خون هنوز وجود دارد، حتی زمانی که سلولها با میکروسکوپ قابل مشاهده نیستند.
تستهای تصویر برداری
از تستهای تصویر برداری برای گرفتن عکس از داخل بدن شما استفاده میشود. آنها برای تشخیص لوسمی مزمن میلوئیدی مورد نیاز نیستند اما گاهی اوقات برای جستجوی علت علائم یا برای دیدن بزرگ شدن طحال یا کبد استفاده میشوند.
اسکن توموگرافی کامپیوتری (CT)
سی تی اسکن میتواند نشان دهد که آیا گرههای لنفاوی یا اندامهای بدن شما بزرگ شده اند یا خیر. این آزمایش برای تشخیص لوسمی مزمن میلوئیدی لازم نیست اما اگر پزشک مشکوک باشد که سرطان خون در اندامی مانند طحال شما در حال رشد است، ممکن است انجام شود.
در برخی موارد، میتوان از سی تی اسکن برای هدایت سوزن بیوپسی به سمت یک ناهنجاری مشکوک، مانند آبسه (abscess)، استفاده کرد. برای این روش که بیوپسی سوزنی هدایت شده با سی تی (CT-guided needle biopsy) نامیده میشود، روی میز سی تی اسکن میمانید در حالی که رادیولوژیست سوزن بیوپسی را از روی پوست شما و به سمت توده حرکت میدهد.
سی تی اسکن تا زمانی که سوزن در توده قرار گیرد، تکرار میشود. سپس یک نمونه برداشته میشود و در زیر میکروسکوپ بررسی میشود. این کار به ندرت در لوسمی مزمن میلوئیدی مورد نیاز است.
تصویربرداری رزونانس مغناطیسی (MRI یا Magnetic resonance imaging)
MRI برای بررسی مغز و نخاع بسیار مفید است.
سونوگرافی (Ultrasound)
از سونوگرافی میتوان برای مشاهده غدد لنفاوی نزدیک سطح بدن یا برای جستجوی اندامهای بزرگ شده داخل شکم (belly) مانند کلیهها، کبد و طحال استفاده کرد.
مطالب مرتبط:
CML چگونه درمان میشود؟
داروهای درمان هدفمند (Targeted therapy drugs)، درمان اصلی برای لوسمی مزمن میلوئیدی (CML) هستند اما برخی از بیماران ممکن است به درمانهای دیگری نیز نیاز داشته باشند.
درمانهای هدفمند (Targeted Therapies) برای لوسمی میلوئید مزمن
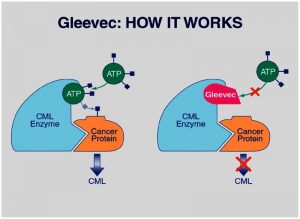
سلولهای لوسمی مزمن میلوئیدی (CML) حاوی یک ژن غیر طبیعی به نام BCR-ABL هستند که در سلولهای طبیعی یافت نمیشود. این ژن پروتئینی به نام BCR-ABL میسازد که باعث رشد و تکثیر سلولهای لوسمی مزمن میلوئیدی خارج از کنترل میشود. BCR-ABL نوعی پروتئین است که به نام تیروزین کیناز شناخته میشود. داروهای شناخته شده به عنوان مهارکنندههای تیروزین کیناز (TKIs) که BCR-ABL را هدف قرار میدهند، درمان استاندارد برای لوسمی مزمن میلوئیدی هستند.
این داروها شامل:
- ایماتینیب (Gleevec یا Imatinib)
- داساتینیب (Sprycel یا Dasatinib)
- نیلوتینیب (Tasigna یا Nilotinib)
- بوسوتینیب (Bosulif یا Bosutinib)
- پوناتینیب (Iclusig یا Ponatinib)
- آسسیمینیب (Scemblix یا Asciminib)
به نظر میرسد این داروها زمانی که لوسمی مزمن میلوئیدی در فاز مزمن است، بهترین کارایی را دارند اما برخی از آنها میتوانند به بیماران مبتلا به بیماری پیشرفته تر (فازهای تسریع شده یا تجمعی) نیز کمک کنند.
در اکثر افراد، به نظر نمیرسد که TKIs باعث از بین رفتن لوسمی مزمن میلوئیدی برای همیشه شود، بنابراین این داروها باید به طور نامحدود مصرف شوند. اما برای برخی از افرادی که پاسخهای بسیار خوب و طولانی مدت به درمان دارند، ممکن است بتوان مصرف این داروها را متوقف کرد یا حداقل دوز آنها را کاهش داد.
این داروها قرصهایی هستند که شما در خانه مصرف میکنید. برای به دست آوردن بهترین نتایج، مهم است که آنها را دقیقاً همان طور که پزشک به شما میگوید مصرف کنید. نادیده گرفتن مصرف قرصها یا تنظیم دوزشان میتواند بر روش درمان TKI تأثیر بگذارد.
همه این داروها میتوانند تداخلات جدی با برخی از داروها، مکملهای بدون نسخه و حتی برخی غذاها (مانند گریپ فروت و انار) داشته باشند. مطمئن شوید که پزشک شما همیشه فهرستی به روز از همه چیزهایی که مصرف میکنید، شامل داروهای بدون نسخه، ویتامینها و مکملهای گیاهی را در اختیار دارد.
همچنین باید قبل از شروع هر داروی جدیدی با پزشک خود مشورت کنید تا از بی خطر بودن آن مطمئن شوید.
همچنین درک این نکته مهم است که تمام TKIها در صورت مصرف در دوران بارداری میتوانند به جنین آسیب برسانند.
TKIها اغلب برای درمان فاز مزمن لوسمی مزمن میلوئیدی استفاده میشوند.
هر یک از این TKIها ممکن است به عنوان اولین (یا خط مقدم) درمان لوسمی مزمن میلوئیدی فاز مزمن استفاده شوند.
ایماتینیب (Imatinib)
ایماتینیب (Gleevec) اولین دارویی بود که به طور خاص پروتئین تیروزین کیناز BCR-ABL را هدف قرار داد.
تقریباً همه بیماران CML به درمان با ایماتینیب پاسخ میدهند و به نظر میرسد که بیشتر این پاسخها برای سالها باقی میمانند.
ایماتینیب معمولاً یک بار در روز به صورت خوراکی و به همراه غذا مصرف میشود.
ایماتینیب عمومی (Generic imatinib) نیز موجود است. مطالعات نشان داده اند که این دارو به همان اندازه کارایی داشته و باعث ایجاد عوارض جانبی مشابهی با داروی ایماتینیب با نام تجاری Gleevec میشود.
عوارض جانبی ایماتینیب
عوارض جانبی رایج میتواند شامل اسهال، حالت تهوع، درد عضلانی و خستگی باشد. این حالتها عموماً خفیف هستند. برخی افراد زائدههای پوستی خارش دار دارند. اکثر این علائم در صورت نیاز قابل درمان هستند.
یکی دیگر از عوارض جانبی رایج تجمع مایع در اطراف چشمها، پاها یا شکم (belly) است. در موارد نادر ممکن است مایع در ریهها یا اطراف قلب جمع شود که میتواند باعث ایجاد مشکلات تنفسی شود.
برخی از مطالعات نشان داده اند که برخی از موارد تجمع مایع ممکن است ناشی از اثرات دارو بر قلب باشد، اگرچه این امر نادر است. هنوز مشخص نیست که این پدیده چقدر جدی است یا اگر درمان متوقف شود ممکن است برطرف شود یا خیر. اگر این دارو را مصرف میکنید و متوجه افزایش ناگهانی وزن یا تجمع مایع در هر نقطه از بدن یا مشکل تنفسی شدید، فوراً به پزشک خود اطلاع دهید.
تعداد گلبولهای سفید و پلاکتهای فرد ممکن است کاهش یابد. وقتی این اتفاق در ابتدای روند درمان رخ میدهد، ممکن است به این دلیل باشد که سلولهای خون ساز که این سلولها را میسازند، بخشی از فرآیند سرطان خون هستند. در این صورت، سلولهای خون ساز طبیعی کنترل میشوند و شمارش خون (blood counts) به مرور زمان شروع به افزایش میکند.
ممکن است پزشک به شما بگوید که اگر شمارش خون شما خیلی کم شد، مصرف دارو را برای مدت کوتاهی متوقف کنید. این کار ممکن است در مراحل بعدی درمان نیز اتفاق بیفتد. پزشک ممکن است دوز ایماتینیب را کاهش دهد تا ببیند آیا شمارش خون شما بهبود مییابد یا خیر.
در برخی از بیماران، به نظر میرسد که ایماتینیب با گذشت زمان از کار میافتد. این پدیده به مقاومت به ایماتینیب (imatinib resistance) معروف است. به نظر میرسد مقاومت به ایماتینیب ناشی از ایجاد تغییرات در ژنهای سلولهای لوسمی مزمن میلوئیدی باشد. گاهی اوقات میتوان با افزایش دوز ایماتینیب بر این مقاومت غلبه کرد اما برخی از بیماران باید داروی خود را به داروی دیگری مانند یکی از TKIهای دیگر تغییر دهند.
داساتینیب (Dasatinib)
(Sprycel) Dasatinib، TKI دیگری است که پروتئین BCR-ABL را هدف قرار میدهد.
این دارو قرصی است که یک بار در روز همراه با غذا یا بدون غذا مصرف میشود.
داساتینیب را میتوان به عنوان اولین درمان برای لوسمی مزمن میلوئیدی استفاده کرد اما همچنین میتواند برای بیمارانی که به دلیل عوارض جانبی یا به دلیل اینکه ایماتینیب برایشان کار نمیکند و نمیتوانند از آن استفاده کنند نیز مفید باشد.
عوارض جانبی داساتینیب
به نظر میرسد عوارض جانبی احتمالی داساتینیب مشابه اثرات ایماتینیب باشد، از جمله تجمع مایعات، کاهش تعداد سلولهای خونی، حالت تهوع، اسهال و زوائد پوستی.
یک عارضه جانبی جدی که میتواند با این دارو رخ دهد، تجمع مایع در اطراف ریه است (به نام پلورال افیوژن یا pleural effusion). این عارضه جانبی در بیمارانی که دو بار در روز داساتینیب مصرف میکنند، شایع تر است. مایع را میتوان با یک سوزن تخلیه کرد اما میتواند دوباره جمع شود و ممکن است نیاز به کاهش دوز داساتینیب داشته باشد.
نیلوتینیب (Nilotinib)
(Tasigna) Nilotinib، TKI دیگری است که پروتئین BCR-ABL را هدف قرار میدهد. این دارو را میتوان به عنوان اولین درمان برای لوسمی مزمن میلوئیدی استفاده کرد و همچنین برای افرادی که نمیتوانند ایماتینیب مصرف کنند یا CML دیگر به آن پاسخ نمیدهد نیز استفاده میشود.
این دارو به صورت قرص مصرف میشود. بیمار 2 ساعت قبل از مصرف نیلوتینیب و 1 ساعت بعد از مصرف آن نمیتواند غذا بخورد.
عوارض جانبی نیلوتینیب
عوارض جانبی نیلوتینیب خفیف به نظر میرسد اما میتواند شامل تجمع مایعات، کاهش تعداد سلولهای خونی، حالت تهوع، اسهال، زوائد پوستی و برخی تغییرات شیمیایی در خون باشد که ممکن است نیاز به درمان داشته باشند (به عنوان مثال، سطوح پایین پتاسیم و منیزیم). این دارو میتواند باعث افزایش قند خون و پانکراتیت (pancreatitis) نیز شود اما این اتفاق نادر است.
این دارو همچنین میتواند بر ریتم قلب تأثیر بگذارد و باعث ایجاد وضعیتی به نام سندرم QT طولانی مدت (prolonged QT syndrome) شود. این سندروم معمولاً هیچ علامتی را ایجاد نمیکند اما میتواند جدی یا حتی کشنده باشد. به همین دلیل، بیماران باید قبل از شروع نیلوتینیب و سپس مجدداً در حین انجام روند درمان، نوار قلب (EKG) را انجام دهند.
این اختلال در ریتم قلب گاهی اوقات میتواند ناشی از تداخل نیلوتینیب با سایر داروها یا مکملها باشد، بنابراین بسیار مهم است که مطمئن شوید پزشک شما در مورد داروهایی که مصرف میکنید، از جمله داروهای بدون نسخه، ویتامینها، داروهای گیاهی و مکملها، اطلاع دارد. همچنین باید قبل از شروع هر داروی جدیدی با پزشک خود مشورت کنید تا از بی خطر بودن آن مطمئن شوید.
TKI زمانی استفاده میشود که سایر TKIها از کار بیفتند.
بوسوتینیب (Bosutinib)
(Bosulif) Bosutinib TKI دیگری است که پروتئین BCR-ABL را هدف قرار میدهد. میتوان از آن به عنوان اولین درمان برای لوسمی مزمن میلوئیدی استفاده کرد اما اغلب اگر TKI دیگری دیگر کارایی نداشته باشد، از آن استفاده میشود.
این دارو به صورت قرص همراه با غذا یک بار در روز مصرف میشود.
عوارض جانبی بوسوتینیب
عوارض جانبی رایج معمولاً خفیف هستند و شامل اسهال، تهوع، استفراغ، درد شکم (belly)، زوائد پوستی، تب، خستگی و تعداد کم گلبولهای خونی (شامل تعداد کم پلاکتها، تعداد کم گلبولهای قرمز خون و کاهش تعداد گلبولهای سفید خون) میشوند.
در موارد نادری، این دارو همچنین میتواند مشکلاتی اعم از احتباس مایعات، آسیب کبدی و واکنش آلرژیک شدید ایجاد کند. پزشک شما به طور منظم نتایج آزمایش خون شما را بررسی میکند تا مشکلات کبدی و شمارش خون پایین شما را پایش کند.
پوناتینیب (Ponatinib)
پوناتینیب (Iclusig) یک TKI است که پروتئین BCR-ABL را هدف قرار میدهد. از آن جایی که این دارو میتواند عوارض جانبی جدی ایجاد کند، تنها در صورتی برای درمان بیماران مبتلا به CML استفاده میشود که تمام TKIهای دیگر کارایی نداشته باشند یا حالتی که سلولهای لوسمی آنها تغییر ژنی به نام جهش T315I داشته باشند. پوناتینیب یک TKI برای مقابله با سلولهای لوسمی مزمن میلوئیدی است که دارای این جهش هستند.
این دارو قرصی است که یک بار در روز با غذا یا بدون غذا مصرف میشود.
عوارض جانبی پوناتینیب
بیشتر عوارض جانبی خفیف هستند و میتوانند شامل درد شکم (belly)، سردرد، زوائد پوستی یا سایر مشکلات مربوط به آن و خستگی باشند. فشار خون بالا نیز نسبتاً رایج است و ممکن است فرد نیاز به درمان با داروهای فشار خون داشته باشد.
همچنین خطر لخته شدن خون به شکل جدی وجود دارد که میتواند منجر به حملات قلبی و سکته مغزی شود یا شریانها و وریدهای بازوها و پاها را مسدود کند. به ندرت، لختههای خون در بیمارانی که این دارو را مصرف میکنند، گردش خون را قطع کرده و منجر به نیاز به قطع یک دست یا پا میشوند.
برای درمان این لختههای خون ممکن است به جراحی یا روش دیگری نیاز باشد. خطر لخته شدن خون جدی در بیماران مسن – کسانی که عوامل خطرزا خاصی مانند فشار خون بالا، کلسترول بالا یا دیابت دارند و کسانی که قبلاً حمله قلبی، سکته مغزی یا گردش خون ضعیفی داشته اند – بیشتر است.
در موارد کمتر رایج، این دارو همچنین میتواند عضله قلب را تضعیف کند و منجر به بروز وضعیتی به نام نارسایی احتقانی قلب (CHF یا congestive heart failure) شود. همچنین میتواند باعث ایجاد مشکلات کبدی، از جمله نارسایی کبد و همچنین پانکراتیت (pancreatitis یا التهاب پانکراس که میتواند منجر به بروز درد شدید شکم، حالت تهوع و استفراغ گردد) شود.
آسسیمینیب (Asciminib)
(Scemblix) Asciminib یک TKI است که ناحیه بسیار خاصی از پروتئین BCR-ABL را هدف قرار میدهد. این دارو برای درمان بیماران مبتلا به CML فاز مزمن در صورتی استفاده میشود که دو یا چند TKI دیگر قبلاً آزمایش شده باشند یا اگر سلولهای لوسمی آنها دارای تغییر ژنی به نام جهش T315I باشند. Asciminib یکی دیگر از TKI برای مقابله با سلولهای لوسمی مزمن میلوئیدی است که دارای جهش T315I هستند.
این دارو به صورت یک قرص در روز یا دو بار در روز بسته به میزان دوز مصرفی خورده میشود.
عوارض جانبی آسسیمینیب
شایع ترین عوارض جانبی آسسیمینیب شامل احساس خستگی، حالت تهوع، اسهال، درد مفاصل و عضلات، زوائد پوستی و عفونت مجاری هوایی فوقانی است. همچنین ممکن است باعث تغییراتی در عملکرد خون شما شود؛ مانند تعداد کم پلاکت، افزایش تری گلیسیرید، کاهش تعداد گلبولهای سفید و قرمز خون و عملکرد غیر طبیعی کلیه.
اینترفرون درمانی (Interferon Therapy) برای لوسمی میلوئید مزمن
اینترفرونها (Interferons) خانوادهای از مواد هستند که به طور طبیعی توسط سیستم ایمنی بدن (CML) ساخته میشوند. اینترفرون آلفا یک داروی ساخته دست بشر است که مانند ماده ای عمل میکند که سیستم ایمنی بدن ما به طور طبیعی تولید میکند. این ماده رشد و تقسیم سلولهای سرطانی خون را کاهش میدهد. اینترفرون آلفا نوعی اینترفرون است که اغلب در درمان لوسمی میلوئیدی مزمن (CML) استفاده میشود.
اینترفرون زمانی بهترین درمان برای لوسمی مزمن میلوئیدی بود اما اکنون، مهارکنندههای تیروزین کیناز پایه اصلی روندهای درمانی هستند و اینترفرون به ندرت استفاده میشود.
برای درمان CML، این دارو اغلب به صورت تزریق روزانه (شات) زیر پوست تجویز میشود. همچنین ممکن است به عضله یا ورید تزریق شود. این دارو باید در طول سالها به بیمار تزریق شود.
عوارض جانبی اینترفرون
اینترفرون میتواند عوارض جانبی قابل توجهی ایجاد کند. این عوارض شامل علائم «آنفولانزا مانندی» مثل دردهای عضلانی، درد استخوان، تب، سردرد، خستگی، حالت تهوع و استفراغ است. بیمارانی که از این دارو استفاده میکنند ممکن است در تفکر و تمرکز دچار مشکل شوند. اینترفرون همچنین میتواند تعداد سلولهای خونی را کاهش دهد.
عوارض جانبی تا زمانی که دارو استفاده میشود، ادامه دارد اما به مرور زمان تحمل آن آسان تر میشود. وضعیت بیمار پس از قطع دارو نیز بهتر میشود. با این حال، برخی از بیماران به سختی میتوانند هر روز با این عوارض جانبی مقابله کنند و ممکن است به دلیل بروز آنها نیاز به توقف درمان داشته باشند.
شیمی درمانی (Chemotherapy) برای لوسمی میلوئیدی مزمن
شیمی درمانی (chemo) استفاده از داروهای ضد سرطانی است که به داخل رگ تزریق شده یا از طریق دهان و به طور خوراکی مصرف میشوند. این داروها وارد جریان خون میشوند و به تمام نواحی بدن میرسند و این نوع درمان را برای سرطانهایی که در سراسر بدن پخش میشوند، مانند لوسمی مزمن میلوئیدی (CML) مفید میسازند.
هر دارویی که برای درمان سرطان استفاده میشود (از جمله مهارکنندههای تیروزین کیناز یا TKIs) را میتوان شیمی درمانی در نظر گرفت اما در اینجا شیمی به معنای درمان با داروهای متداول سیتوتوکسیک (cytotoxic یا سلول کش) است که عمدتاً سلولهایی را که به سرعت در حال رشد و تقسیم هستند، از بین میبرند.
شیمی درمانی زمانی یکی از درمانهای اصلی برای لوسمی مزمن میلوئیدی بود. در حال حاضر این روش درمانی به ندرت استفاده میشود زیرا TKI مانند imatinib (Gleevec) بسیار بهتر عمل میکنند. امروزه، زمانی که TKIها از کار افتاده باشند، ممکن است از شیمی درمانی برای درمان لوسمی مزمن میلوئیدی استفاده شود. این روش همچنین به عنوان بخشی از روند درمانی پیوند سلولهای بنیادی نیز استفاده میشود.
داروهای شیمیایی مورد استفاده برای درمان CML
داروی شیمیایی هیدروکسی اوره (Hydrea یا hydroxyurea) به عنوان یک قرص مصرف میشود و میتواند به کاهش سریع تعداد بسیار بالای گلبولهای سفید خون و کوچک شدن طحال بزرگ شده کمک کند. سایر داروهایی که گاهی اوقات مورد استفاده قرار میگیرند عبارتند از سیتارابین (Ara-C)، بوسولفان (busulfan)، سیکلوفسفامید (Cytoxan یا cyclophosphamide) و وین کریستین (Oncovin یا vincristine).
(Synribo) Omacetaxine یک داروی شیمی درمانی است که برای درمان CML که به TKIs مقاوم است و تا فاز تسریع شده پیشرفت کرده، تأیید شده است. همچنین میتواند به برخی از بیمارانی که لوسمی مزمن میلوئیدی آنها جهش T315I را – که اکثر TKIها را از عمل کردن باز میدارد – ایجاد کرده است، کمک کند. (این موضوع در بخش درمان هدفمند مورد بحث قرار گرفت.)
عوارض جانبی شیمی درمانی
داروهای شیمی درمانی با حمله به سلولهایی که به سرعت تقسیم میشوند، عمل میکنند و به همین دلیل است که آنها علیه سلولهای سرطانی کارایی داشته و مورد استفاده قرار میگیرند. اما سلولهای دیگر بدن مانند سلولهای مغز استخوان، پوشش دهان و روده و فولیکولهای مو نیز به سرعت تقسیم میشوند. احتمالاً این سلولها نیز تحت تأثیر شیمی درمانی قرار میگیرند که میتواند منجر به بروز عوارض جانبی در این روش شود.
عوارض جانبی احتمالی به نوع و دوز داروهای داده شده و مدت زمان مصرف آنها بستگی دارد. برخی از عوارض جانبی رایج شیمی درمانی عبارتند از:
- ریزش مو
- زخمهای دهان
- از دست دادن اشتها
- تهوع و استفراغ
- تعداد کم گلبولهای سفید خون (لکوپنی) که خطر عفونت را به طور جدی افزایش میدهد.
- تعداد کم پلاکت خون (ترومبوسیتوپنی) که میتواند منجر به ایجاد کبودی یا خونریزی آسان شود.
- تعداد کم گلبولهای قرمز خون (کم خونی) که میتواند منجر به ایجاد احساس خستگی و ضعف شود.
با این حال، داروهای مختلف میتوانند عوارض جانبی متفاوتی داشته باشند. به عنوان مثال، وین کریستین میتواند باعث آسیب عصبی (نوروپاتی یا neuropathy) شود که منجر به بی حسی، سوزن سوزن شدن یا حتی درد یا ضعف در دستها یا پاها میشود. آسیب ریه ناشی از بوسولفان نادر است اما میتواند شدید باشد.
قبل از شروع درمان، با تیم پزشکی خود در مورد داروهایی که دریافت میکنید و عوارض جانبی احتمالی آنها صحبت کنید. اکثر عوارض جانبی مدت کوتاهی باقی میمانند و پس از پایان درمان از بین میروند اما برخی از آنها میتوانند دائمی باشند.
در حین درمان، حتماً در مورد هر گونه عوارض جانبی که دارید، به تیم پزشکان سرطان خود اطلاع دهید. ممکن است راههایی برای درمان آنها یا جلوگیری از بدتر شدن آنها وجود داشته باشد. به عنوان مثال، داروهایی وجود دارند که برای پیشگیری یا کاهش تهوع و استفراغ به خوبی عمل میکنند.
اگر تعداد پلاکتهای شما بسیار کم باشد، ممکن است برای کمک به محافظت از شما در برابر خونریزی، تزریق پلاکت برای شما انجام شود. به همین ترتیب، اگر تعداد کم گلبولهای قرمز خون باعث ایجاد مشکلاتی (مانند تنگی نفس و یا ضعف) شود، ممکن است با تزریق گلبول قرمز درمان شوید.
پرتو درمانی (Radiation Therapy) برای لوسمی میلوئیدی مزمن
پرتو درمانی درمان با پرتوها یا ذرات پر انرژی برای از بین بردن سلولهای سرطانی است.
پرتو درمانی به ندرت بخشی از روند درمان بیماران مبتلا به لوسمی مزمن میلوئیدی (CML) است اما ممکن است در شرایط خاصی استفاده شود.
اگر اندامهای داخلی متورم (مانند بزرگ شدن طحال) روی سایر اندامها فشار بیاورد، برخی از افراد علائمی را تجربه میکنند. به عنوان مثال، فشار روی معده ممکن است بر اشتها تأثیر بگذارد. اگر سایر درمانها به این علائم کمک نکنند، پرتو درمانی برای کوچک کردن طحال ممکن است یک گزینه باشد.
پرتو درمانی همچنین میتواند در درمان درد ناشی از آسیب استخوانی ناشی از رشد سلولهای لوسمی در مغز استخوان نیز مفید باشد.
پرتو درمانی ممکن است در دوزهای کم بر کل بدن، به عنوان بخشی از پیوند سلولهای بنیادی، انجام شود.
عوارض جانبی پرتو درمانی
عوارض جانبی اصلی کوتاه مدت پرتو درمانی به این بستگی دارد که کدام قسمت از بدن تحت این روند درمانی قرار میگیرد.
- خستگی (tiredness) یک عارضه جانبی رایج است. (بدون توجه به اینکه چه قسمتی از بدن تحت تاثیر قرار گیرد.)
- تغییرات پوستی میتواند در ناحیه تحت درمان رخ دهد که از قرمزی خفیف تا تاول و پوسته پوسته شدن متغیر است.
- اگر تابش به سمت سر یا گردن باشد، پوشش داخلی دهان و گلو ممکن است قرمز و تحریک شود.
- تابش اشعه به شکم یا لگن میتواند باعث تهوع و استفراغ و یا اسهال شود.
جراحی (Surgery) برای لوسمی میلوئید مزمن
سلولهای لوسمی به طور گسترده در سراسر مغز استخوان و سایر اندامها پخش میشوند، بنابراین نمیتوان از جراحی برای درمان این نوع سرطان استفاده کرد. جراحی حتی در تشخیص لوسمی مزمن میلوئیدی (CML) نیز به ندرت نقشی دارد زیرا آزمایش خون یا آسپیراسیون مغز استخوان و بیوپسی معمولاً تمام چیزی است که برای تشخیص لازم است.
اسپلنکتومی (Splenectomy)
اگر لوسمی به طحال سرایت کند، میتواند به اندازه ای بزرگ شود که اندامهای مجاور را فشرده کرده و علائمی را ایجاد کند. اگر شیمی درمانی یا پرتو درمانی به کوچک شدن طحال کمک نکند، ممکن است این اندام با جراحی برداشته شود. این عمل که اسپلنکتومی نامیده میشود، برای بهبود علائم طحال بزرگ شده است و این عمل هیچ نقشی در درمان لوسمی مزمن میلوئیدی ندارد.
اسپلنکتومی همچنین ممکن است تعداد سلولهای خونی را بهبود بخشد و نیاز به انتقال فرآوردههای خونی را کاهش دهد. یکی از عملکردهای طبیعی طحال، حذف سلولهای خونی فرسوده از جریان خون است.
اگر لوسمی یا سایر بیماریها باعث بزرگ شدن طحال شوند، ممکن است این اندام برای حذف سلولهای خونی بیش از حد فعال شود و همین امر منجر به کمبود گلبولهای قرمز یا پلاکت شود. بیرون آوردن طحال ممکن است تعداد گلبولهای قرمز و پلاکتها را در برخی بیماران بهبود بخشد.
اکثر مردم مشکلی برای زندگی بدون طحال ندارند اما خطر ابتلا به برخی عفونتهای باکتریایی در آنها افزایش مییابد.
به همین دلیل است که پزشکان اغلب توصیه میکنند قبل از برداشتن طحال، واکسنهای خاصی به بیمار زده شود.
پیوند سلولهای بنیادی (Stem Cell Transplant) برای لوسمی میلوئید مزمن
امروزه پیوند سلولهای بنیادی (SCT) یک درمان رایج برای لوسمی مزمن میلوئیدی (CML) نیست. در گذشته، قبل از اینکه مهارکنندههای تیروزین کیناز (TKIs) در دسترس باشند، SCT اغلب برای درمان لوسمی مزمن میلوئیدی استفاده میشد. در حال حاضر، TKIها روش درمانی استاندارد هستند و پیوندها به مراتب کمتر مورد استفاده قرار میگیرند.
از آن جایی که SCT آلوژنیک تنها شانس اثبات شده برای درمان CML را ارائه میدهد، پزشکان همچنان ممکن است پیوند را برای بیماران جوان تر، به ویژه کودکان توصیه کنند. پیوند به احتمال زیاد برای کسانی که اهداکننده همسان در دسترس دارند – مانند یک برادر یا خواهر دو قلوی همسان – در نظر گرفته میشود.
اگر لوسمی مزمن میلوئیدی به خوبی به TKIها پاسخ نمیدهد، ممکن است پیوند نیز توصیه شود. همچنین این روش یک گزینه مهم برای افراد مبتلا به CML است که در مراحل تسریع یا تجمع در حال پیشرفت یا تشخیص هستند.
پیوند سلولهای بنیادی چیست؟
دوزهای معمول داروهای شیمی درمانی میتواند با آسیب رساندن به سلولهایی که به سرعت تقسیم میشوند مانند مغز استخوان، عوارض جانبی جدی ایجاد کند. حتی اگر دوزهای بالاتر این داروها ممکن است در از بین بردن سلولهای سرطان خون بهتر باشد اما این دوزها تجویز نمیشوند زیرا آسیب شدید به سلولهای مغز استخوان باعث کمبود مرگبار سلولهای خونی میشود.
برای پیوند سلولهای بنیادی (SCT)، دوزهای بالایی از شیمی درمانی برای از بین بردن سلولهای سرطان خون داده میشود. گاهی اوقات به کل بدن دوز کمی از پرتو تابیده میشود. این روش درمانی سلولهای سرطانی خون را از بین میبرد اما به سلولهای طبیعی مغز استخوان نیز آسیب میرساند. سپس پس از این درمانها، بیمار پیوند سلولهای بنیادی خونساز را برای بازیابی مغز استخوان دریافت میکند.
سلولهای بنیادی خون ساز که برای پیوند استفاده میشوند میتوانند از خون (به نام پیوند سلولهای بنیادی خون محیطی یا PBSCT) یا از مغز استخوان (به نام پیوند مغز استخوان یا BMT) حاصل شوند. پیوند مغز استخوان در گذشته بیشتر انجام میشد اما تا حد زیادی با PBSCT جایگزین شده است.
2 نوع اصلی پیوند سلولهای بنیادی آلوژنیک (allogeneic) و اتولوگ (autologous) هستند.
برای پیوند اتولوگ، سلولهای بنیادی خود بیمار از خون یا مغز استخوان جمع آوری شده و پس از درمان به او بازگردانده میشود. مشکل این است که سلولهای سرطانی خون ممکن است همراه با سلولهای بنیادی جمع آوری شوند.
در پیوند آلوژنیک، سلولهای بنیادی از شخص دیگری (یک اهدا کننده) بدست میآیند. برای کاهش احتمال عوارض، اهدا کننده باید با نوع بافت بیمار “تطابق” داشته باشد. اغلب، یک خویشاوند نزدیک، مانند یک برادر یا خواهر، گزینه خوبی است. در موارد کمتر شایع، ممکن است یک اهدا کننده نامرتبط اما مشابه پیدا شود.
از آن جایی که جمع آوری سلولهای بنیادی بیمار میتواند سلولهای سرطان خون را نیز جمع آوری کند، پیوند آلوژنیک نوع اصلی پیوند مورد استفاده برای درمان لوسمی مزمن میلوئیدی است.
پیوند سلولهای بنیادی آلوژنیک تنها درمان شناخته شده برای لوسمی مزمن میلوئیدی است. با این حال، این نوع پیوند میتواند اختلالات و عوارض جانبی شدید یا حتی تهدید کننده ای برای زندگی ایجاد کند و اغلب در افرادی که مسن هستند یا مشکلات سلامتی دیگری دارند، گزینه مناسبی نیست.
مطالب مرتبط:
مترجم: فاطمه فریادرس