تکنیک ها
مدلسازی همسانی (Homology Modeling) – سازوکار، مراحل و کاربردها
مدلسازی همسانی – سازوکار، مراحل و کاربردها
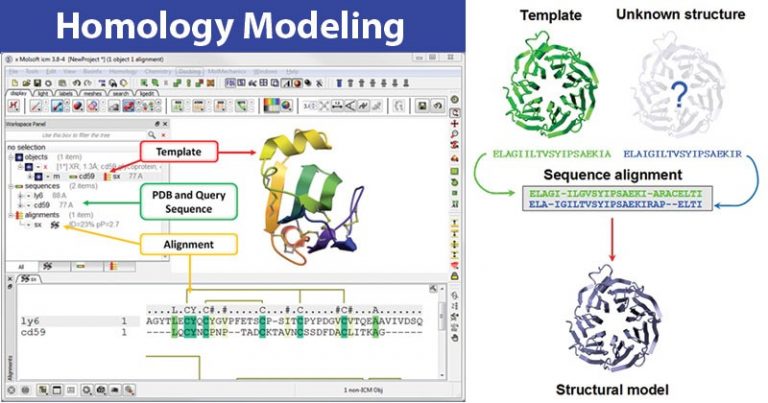
مدلسازی همسانی بهعنوان مدلسازی مقایسهای نیز شناخته میشود که ساختارهای پروتئین را بر اساس همسانی توالی با ساختارهای شناخته شده پیشبینی میکند.
این روش بر اساس این اصل است که «اگر توالی دو پروتئین بهقدر کافی مشابه باشند، احتمالاً ساختارهای سهبعدی بسیار مشابهی نیز دارند»
ازاینرو این روش به شناسایی یک یا چند ساختار پروتئینی شناخته شده که احتمالاً شبیه ساختار توالی مورد بررسی هستند، و بر ساخت یک توازن (Alignment) که قسمتهای باقیماندهها در توالی مجهول را با قسمتهای باقیمانده در توالی الگو رسم میکند، متکی است.
بنابراین، اگر یکی از توالیهای پروتئینی دارای ساختار شناخته شدهای باشد، آنگاه ساختار را میتوان با سطح اطمینان بالایی به پروتئین ناشناخته کپی کرد.
سازوکار مدلسازی همسانی
این فرایند، ساختار سهبعدی یک توالی پروتئین معین (هدف) را بر اساس همترازی با یک یا چند ساختار پروتئینی شناخته شده (الگوها) پیشبینی میکند. اگر شباهت بین توالی هدف و دنباله الگو تشخیص داده شود، میتوان فرض را بر شباهت ساختاری نیز گذاشت. بهطورکلی، ۳۰ درصد از اصلیت یک توالی برای تولید یک مدل مفید موردنیاز است.
مراحل مدلسازی همسانی
روش کلی مدلسازی همسانی شامل شش مرحله است.
مرحله اول انتخاب الگو است که شامل شناسایی توالیهای همولوگ در پایگاهدادههای مربوط به ساختار پروتئین است تا بهعنوان الگو برای مدلسازی استفاده شود.
این روش معمولاً متکی به هم ردیفسازی دوگانهای است که به کمک تکنیکهای جستجوی پایگاهداده مانند FASTA و BLAST است، اما ممکن است علاوه بر اینها، از روشهای دیگری مانند PSI-BLAST، Protein Threading و غیره نیز استفاده شود.
مرحله دوم مدلسازی همسانی تراز کردن توالیهای هدف و الگو است.
هنگامی که ساختاری با بیشترین شباهت بهعنوان یک الگو شناسایی شد، توالیهای تمام طول الگو و پروتئینهای هدف برای دستیابی به تراز بهینه، باید با استفاده از الگوریتمهای تراز اصلاحشده مجدداً همتراز شوند.
برای این منظور باید از بهترین الگوریتمهای همترازی چندگانه ممکن مانند Praline و T-coffee استفاده شود و به دنبال آن بهصورت دستی اصلاح شود تا کیفیت تراز را بهبود بخشد.
مرحله سوم مدلسازی همسانی ، ساختن یک ساختار اصولی برای پروتئین هدف است که از اتمهای زنجیره اصلی تشکیل شده است.
هنگامی که تراز بهینه به دست آمد، مختصات قسمتهای باقیمانده مربوط به پروتئینهای الگو را میتوان بهسادگی بر روی پروتئین هدف کپی کرد.
اگر دو باقیمانده تراز شده یکسان باشند، مختصات اتمهای زنجیره جانبی همراه با اتمهای زنجیره اصلی کپی میشود. اگر این دو باقیمانده متفاوت باشند، فقط اتمهای ستون اصلی میتوانند کپی شوند.
مرحله چهارم ساخت مدل شامل افزودن و بهینهسازی اتمها و حلقههای زنجیره جانبی است.
در تراز توالی برای مدلسازی، اغلب مناطقی وجود دارد که توسط جایگذاریها و حذفها شکافهایی در تراز توالی ایجاد شده است. شکافها را نمیتوان مستقیماً مدلسازی کرد و باعث ایجاد «حفره» در مدل میشود.
بستن شکافها نیاز به مدلسازی حلقه دارد که چالش بسیار دشواری است.
در حال حاضر، دو تکنیک اصلی برای دستیابی به روش حل این مشکل مورداستفاده قرار میگیرد: روش جستجوی پایگاهداده و روش اب اینیتو (ab initio).
هنگامی که اتمهای زنجیره اصلی ساخته میشوند، باید موقعیت زنجیرههای جانبی که مدلسازی نشدهاند تعیین شود.
مدلسازی هندسی زنجیره جانبی در ارزیابی برهمکنشهای پروتئین – لیگاند در مکانهای فعال و برهمکنشهای پروتئین – پروتئین در تماس فیزیکی بسیار مهم است.
اکثر بستههای مدلسازی از تابع اصلاح زنجیره جانبی استفاده میکنند. یکی از برنامههای تخصصی مدلسازی زنجیره جانبی که عملکرد نسبتاً خوبی دارد، SCWRL (جایگذاری زنجیره جانبی با استفاده از کتابخانه روتامر (rotamer library)) است که یک برنامه یونیکس UNIX است که با قراردادن زنجیرههای جانبی بر روی الگوی ستون اصلی بر اساس اولویتهای کتابخانه روتامری وابسته به ستون اصلی کار میکند.
مرحله پنجم اصلاح و بهینهسازی کل مدل بر اساس معیارهای انرژی است.
مدل همولوژی پردازش نشده، کاملاً عاری از بینظمیهای ساختاری مانند زوایای پیوند نامطلوب، طول پیوند یا تماسهای اتمی نزدیک است.
اگر بینظمیهای ساختاری مشاهده شود، میتوان با اعمال روش کمینهسازی انرژی در کل مدل، آن را اصلاح کرد.
یکی دیگر از روشهای اصلاح ساختار که اغلب مورداستفاده قرار میگیرد، شبیهسازی دینامیک مولکولی است. GROMOS (www. gc.ethz.ch/gromos/) یک برنامه یونیکس برای شبیهسازی دینامیک مولکولی است.
مرحله نهایی شامل ارزیابی کیفیت کلی مدل بهدستآمده است.
مدل همسانی نهایی باید ارزیابی شود تا اطمینان حاصل شود که ویژگیهای ساختاری مدل با قوانین فیزیکوشیمیایی سازگار است.
در صورت لزوم، همترازی و ساخت مدل تا حصول نتیجه رضایتبخش تکرار میشود.
کاربردهای مدلسازی همسانی
مدلسازی پروتئین مبنای قابلاطمینانی برای موارد زیر فراهم میکند:
طراحی منطقی پروتئینها با افزایش پایداری یا عملکردهای جدید
تجزیهوتحلیل عملکرد پروتئین، فعلوانفعالات، رفتار آنتی ژنی
طراحی دارو بر اساس ساختار
ازآنجاییکه بهدستآوردن ساختارهای آزمایشی از روشهایی مانند کریستالوگرافی اشعه ایکس و پروتئین NMR برای هر پروتئین موردنظر، دشوار و زمان بر است، مدلسازی همسانی میتواند مدلهای ساختاری قابلاستفادهای را برای ایجاد فرضیههایی در مورد عملکرد پروتئین و هدایت کارهای تجربی بیشتر ارائه دهد.
مترجم: مریم محجوب
مطالعه صدها مطلب علمی در حوزه بیولوژی
آرشیو جدیدترین خبرهای روز دنیای بیولوژی