مقدمهای بر مولتیپل میلوما
سرطان زمانی شروع میشود که سلولها شروع به رشد خارج از کنترل میکنند. سلولها تقریباً در هر قسمت از بدن میتوانند به سرطان تبدیل شوند و به نواحی دیگر گسترش یابند.
مولتیپل میلوما سرطان سلولهای پلاسما است. سلولهای پلاسما طبیعی در مغز استخوان یافت میشوند و بخش مهمی از سیستم ایمنی هستند. سیستم ایمنی از چندین نوع سلول تشکیل شده است که با یکدیگر برای مبارزه با عفونتها و سایر بیماریها کار میکنند. لنفوسیتها (سلولهای لنفاوی) یکی از انواع اصلی گلبولهای سفید در سیستم ایمنی هستند و شامل سلولهای T و B هستند. لنفوسیتها در بسیاری از نواحی بدن مانند غدد لنفاوی، مغز استخوان، رودهها و جریان خون قرار دارند.
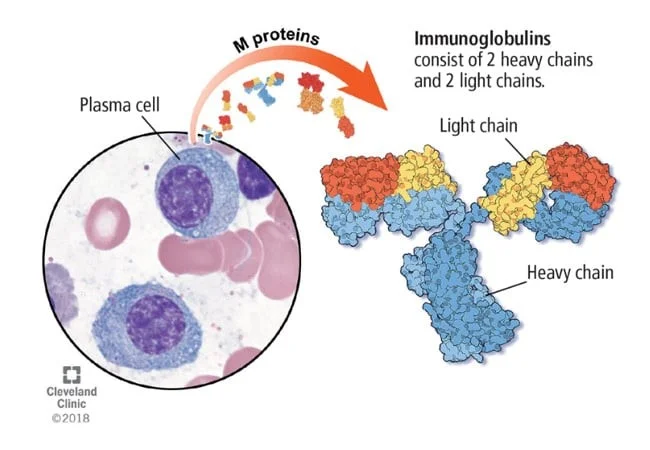
هنگامی که سلولهای B به عفونت پاسخ میدهند، بالغ شده و به سلولهای پلاسما تبدیل میشوند. سلولهای پلاسما آنتیبادیهایی (که ایمونوگلوبولینها نیز نامیده میشوند) تولید میکنند که به بدن کمک میکنند تا به میکروبها حمله کنند و آنها را از بین ببرند. سلولهای پلاسما عمدتاً در مغز استخوان یافت میشوند. مغز استخوان بافت نرم داخل استخوانهاست. علاوه بر سلولهای پلاسما، مغز استخوان طبیعی خانه سایر سلولهای خونی مانند گلبولهای قرمز، گلبولهای سفید و پلاکتها نیز میباشد.
به طور کلی، زمانی که سلولهای پلاسما سرطانی میشوند و خارج از کنترل رشد میکنند، به آن میلوم متعدد یا مولتیپل (multiple myeloma) میگویند. سلولهای پلاسما یک پروتئین غیر طبیعی (آنتی بادی) میسازند که با نامهای مختلفی از جمله ایمونوگلوبولین مونوکلونال، پروتئین مونوکلونال (پروتئین M)، M-spike یا پاراپروتئین شناخته میشود.
با این حال، سایر اختلالات پلاسماسلی (plasma cell disorders) نیز وجود دارند که پلاسماسلهای غیرطبیعی دارند اما معیارهای نامیدن مولتیپل میلوم فعال را ندارند. سایر اختلالات سلولهای پلاسما عبارتند از:
- گاموپاتی مونوکلونال با اهمیت نامشخص (Monoclonal gammopathy of uncertain significance یا MGUS)
- میلوم مولتیپل اسمولدرینگ (Smoldering multiple myeloma یا SMM)
- پلاسماسیتوما منفرد (Solitary plasmacytoma)
- آمیلوئیدوز با زنجیره سبک (Light chain amyloidosis)
ویژگیهای مولتیپل میلوما
کم خونی
در مولتیپل میلوما، رشد بیش از حد سلولهای پلاسما در مغز استخوان میتواند سلولهای خون ساز طبیعی را از بین ببرد و منجر به کم خونی شود.
- این میتواند باعث کم خونی (کمبود گلبولهای قرمز) شود. افراد مبتلا به کم خونی ضعیف و خسته میشوند.
- مولتیپل میلوما همچنین میتواند باعث کاهش سطح پلاکتها در خون شود (به نام ترومبوسیتوپنی یا thrombocytopenia). این میتواند منجر به افزایش خونریزی و کبودی شود.
- بیماری دیگری که میتواند ایجاد شود، لکوپنی یا leukopenia (کمبود گلبولهای سفید طبیعی خون) است. این میتواند منجر به مشکلاتی در مبارزه با عفونت شود.
مشکلات استخوان و کلسیم
سلولهای میلوما همچنین با سلولهایی که به قوی نگه داشتن استخوانها کمک میکنند، تداخل میکنند. استخوانها دائماً در حال بازسازی هستند تا آنها را قوی نگه دارند. دو نوع سلول استخوانی با هم کار میکنند تا استخوانها را سالم و قوی نگه دارند:
- استئوکلاستها (Osteoclasts) استخوان قدیمی را میشکنند.
- استئوبلاستها (Osteoblasts) استخوان جدید را شکل میدهند.
سلولهای میلوما مادهای میسازند که به استئوکلاستها میگوید تا انحلال استخوان را تسریع کنند. بنابراین استخوان قدیمی بدون استخوان جدید برای جایگزینی شکسته میشود و باعث میشود استخوانها ضعیف و به راحتی شکسته شوند. شکستگی استخوان یک مشکل عمده در افراد مبتلا به میلوما است. این افزایش در تجزیه استخوان میتواند سطح کلسیم در خون را نیز افزایش دهد. مشکلات ناشی از سطوح بالای کلسیم در علائم و نشانههای مولتیپل میلوما مورد بحث قرار گرفته است.
عفونتها
سلولهای پلاسما غیر طبیعی نمیتوانند از بدن در برابر عفونت محافظت کنند. همانطور که قبلا ذکر شد، سلولهای پلاسما طبیعی آنتی بادیهایی تولید میکنند که به میکروبها حمله میکنند. در مولتیپل میلوما، سلولهای میلوما سلولهای پلاسما طبیعی را از بین میبرند، به طوری که آنتیبادی برای مبارزه با عفونت نمیتواند ساخته شود. آنتی بادی ساخته شده توسط سلولهای میلوما به مبارزه با عفونتها کمک نمیکند. این به این دلیل است که سلولهای میلوما فقط کپیهای زیادی از یک سلول پلاسما هستند – همگی از یک آنتیبادی دقیق (یا مونوکلونال) یک کپی میسازند.
مشکلات کلیوی
سلولهای میلوما آنتی بادی میسازند که میتواند به کلیهها آسیب برساند و منجر به آسیب کلیه و حتی نارسایی کلیه شود.
سایر اختلالات سلولهای پلاسما
گاموپاتی مونوکلونال (Monoclonal gammopathy)
گاموپاتی مونوکلونال زمانی است که سلولهای پلاسما کپیهای زیادی از همان آنتی بادی میسازند. این بیماری معمولاً هنگام جستجوی سایر شرایط در آزمایش خون معمولی یافت میشود. اگرچه افراد مبتلا به مولتیپل میلوما دارای گاموپاتی مونوکلونال هستند اما همه افراد مبتلا به گاموپاتی مونوکلونال به مولتیپل میلوما مبتلا نیستند.
این بیماری همچنین میتواند در سایر بیماریها مانند ماکروگلوبولینمی والدنستروم و برخی از لنفومها نیز رخ دهد و همچنین میتواند در اختلالی به نام گاموپاتی مونوکلونال با اهمیت نامشخص (MGUS) رخ دهد که مانند مولتیپل میلوما مشکلاتی ایجاد نمیکند. با این حال، برخی از افراد مبتلا به MGUS در نهایت به مولتیپل میلوما یا سایر بیماریها مبتلا میشوند.
گاموپاتی مونوکلونال با اهمیت نامشخص (Monoclonal gammopathy of undetermined significance)
در گاموپاتی مونوکلونال با اهمیت نامشخص (MGUS)، سلولهای پلاسما غیرطبیعی کپیهای زیادی از یک آنتیبادی مشابه (به نام پروتئین مونوکلونال) میسازند. با این حال، این سلولهای پلاسما یک تومور یا توده واقعی تشکیل نمیدهند و هیچ یک از مشکلات مشاهده شده در مولتیپل میلوما را ایجاد نمیکنند. MGUS معمولاً بر سلامت فرد تأثیر نمیگذارد و باعث ضعیف شدن استخوانها، سطح کلسیم بالا، مشکلات کلیوی یا شمارش خون پایین نمیشود.
این بیماری اغلب زمانی دیده میشود که یک آزمایش خون معمولی سطح بالایی از پروتئین را در خون پیدا کند و آزمایشات بیشتر نشان دهد که پروتئین یک آنتی بادی مونوکلونال است. در MGUS، تعداد سلولهای پلاسما ممکن است افزایش یابد اما همچنان کمتر از 10 درصد از سلولهای مغز استخوان را تشکیل میدهند.
MGUS سرطان در نظر گرفته نمیشود اما گاهی اوقات آن را پیش بدخیم (pre-malignant) مینامند زیرا برخی از افراد مبتلا به MGUS در نهایت به سرطانهایی مانند مولتیپل میلوما، لنفوم یا آمیلوئیدوز مبتلا میشوند. هر سال حدود 1 درصد از افراد مبتلا به MGUS به یکی از این بیماریها مبتلا میشوند. این خطر در افرادی که سطح پروتئین آنها بالاست بیشتر است. بیماران مبتلا به MGUS نیازی به درمان ندارند اما به دقت تحت نظر قرار میگیرند تا ببینند آیا به بیماری ای مبتلا میشوند که نیاز به درمان دارد یا خیر، مانند مولتیپل میلوما.
پلاسماسیتوماهای منفرد (Solitary plasmacytomas)
پلاسماسیتوما نوعی رشد غیرطبیعی سلولهای پلاسما است که سرطانی است. به جای بسیاری از تومورها در مکانهای مختلف مانند مولتیپل میلوما، تنها یک تومور وجود دارد، از این رو پلاسماسیتوما منفرد نامیده میشود.
پلاسماسیتوما منفرد اغلب در استخوان ایجاد میشود. هنگامی که پلاسماسیتوما در سایر بافتها (مانند ریهها یا سایر اندامها) شروع میشود، پلاسماسیتوم خارج مدولاری منفرد (solitary extramedullary) یا خارج استخوانی (extraosseous plasmacytoma) نامیده میشود. پلاسماسیتوماهای منفرد اغلب با پرتو درمانی درمان میشوند.
گاهی اوقات ممکن است از جراحی استفاده شود. تا زمانی که هیچ پلاساسیتوم دیگری بعداً پیدا نشود، چشم انداز بیمار معمولاً عالی است. با این حال، از آن جایی که بسیاری از افراد مبتلا به پلاسماسیتوما انفرادی به مولتیپل میلوما مبتلا میشوند، این افراد از نزدیک برای بررسی علائم این بیماری تحت نظر هستند.
میلوم مولتیپل اسمولدرینگ (SMM)
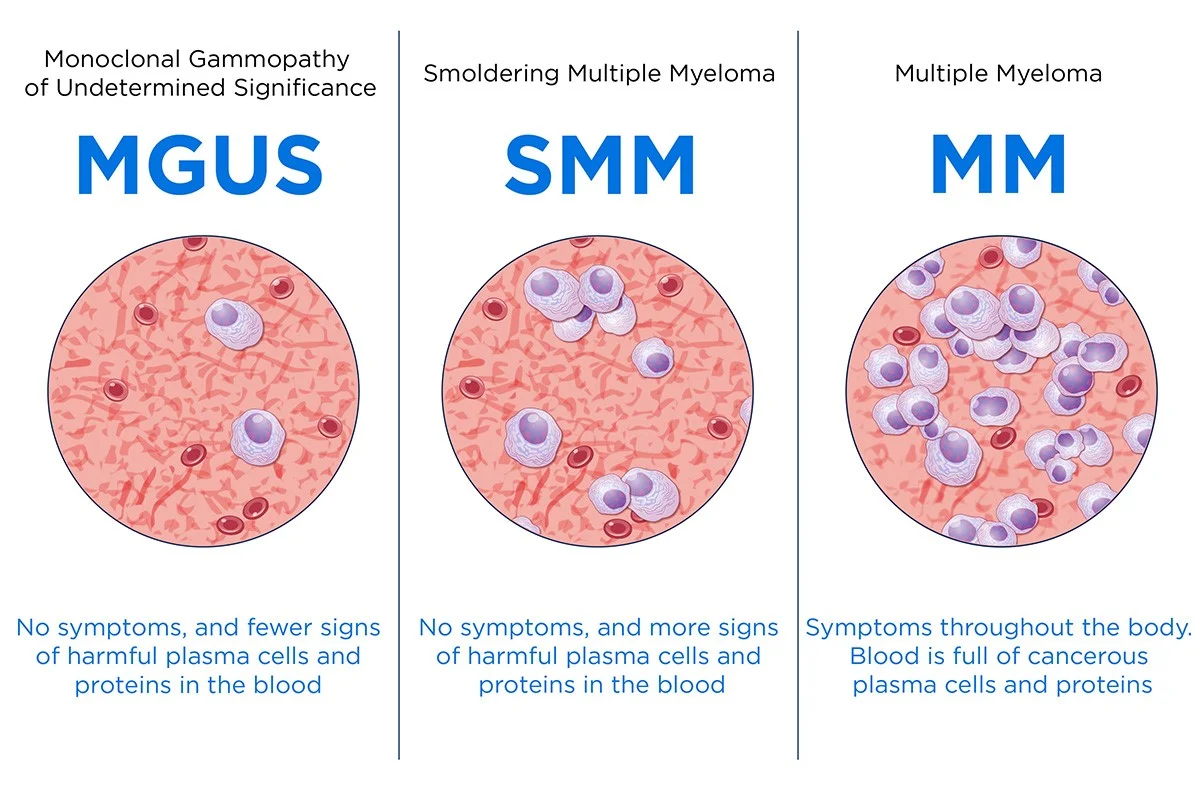
میلوم مولتیپل اسمولدرینگ (SMM) یک میلوم زودرس یا بدون علامت (asymptomatic) است که هیچ مشکلی ایجاد نمیکند. افراد مبتلا به این نوع میلوما دارای برخی از علائم مولتیپل میلوما هستند، مانند هر یک از موارد زیر:
- وجود مقدار زیادی سلولهای پلاسما در مغز استخوان
- وجود سطح بالایی از ایمونوگلوبولین مونوکلونال (پروتئین مونوکلونال) در خون
- وجود سطح بالایی از زنجیرههای سبک (بخشهای پروتئینی کوچک که پروتئین Bence Jones نیز نامیده میشود) در ادرار
اما آنها دارای شمارش خون طبیعی، سطح کلسیم طبیعی، عملکرد طبیعی کلیه، بدون آسیب استخوان یا اندام و هیچ نشانه ای از آمیلوئیدوز (amyloidosis) هستند.
افراد مبتلا به مولتیپل میلوما اسمولدرینگ نیازی به درمان فوری ندارند زیرا این بیماری ممکن است از ماهها تا سالها طول بکشد تا به میلوم فعال (علامت دار) تبدیل شود. برخی از افراد ممکن است بیماری بسیار کندی داشته باشند که هرگز به میلوم فعال تبدیل نمیشود. SMM حوزه تحقیقات فعال است.
SMMهایی که دارای ویژگیهای پرخطری هستند که آنها را در شانس بیشتری برای تبدیل شدن به میلوم فعال قرار میدهد و مطالعاتی در حال انجام است تا مشخص شود که آیا آنها باید به عنوان میلوم “فعال” طبقه بندی شوند یا باید زودتر درمان را شروع کنند. افراد مبتلا به SMM نیز از نظر علائم میلوما به دقت تحت نظر هستند.
آمیلوئیدوز زنجیره سبک (Light chain amyloidosis)

آمیلوئیدوز با زنجیره سبک نیز یک اختلال در رشد غیر طبیعی سلولهای پلاسما است اما با مقادیر کمتری از سلولهای پلاسما غیر طبیعی در مغز استخوان در مقایسه با مولتیپل میلوما.
پروتئینهای مونوکلونال (آنتی بادیها) از زنجیرههای پروتئینی به هم پیوسته تشکیل شده اند – 2 زنجیره سبک کوتاه و 2 زنجیره سنگین بلندتر. در آمیلوئیدوز با زنجیره سبک، سلولهای پلاسما غیرطبیعی زنجیرههای سبک زیادی میسازند که کوتاهتر بوده و وزن کمتری نسبت به زنجیرههای سنگین دارند. زنجیرههای سبک در بافتها به عنوان یک پروتئین غیر طبیعی به نام آمیلوئید (amyloid) ساخته میشوند.
تجمع آمیلوئید در اندامهای خاص میتواند آنها را بزرگ کرده و بر نحوه عملکرد آنها تأثیر بگذارد. به عنوان مثال، هنگامی که آمیلوئید در قلب تجمع مییابد، میتواند باعث ضربان قلب نامنظم و باعث بزرگ شدن و ضعیف شدن قلب شود.
قلب ضعیف میتواند منجر به وضعیتی به نام نارسایی احتقانی قلب با علائمی مانند تنگی نفس و تورم در پاها شود. آمیلوئید موجود در کلیهها میتواند باعث عملکرد ضعیف آنها شود. این ممکن است در اوایل علائم ایجاد نکند اما عملکرد ضعیف کلیه ممکن است در آزمایش خون مشخص شود. اگر بدتر شود، میتواند منجر به نارسایی کلیه شود. مبحث علائم و نشانههای مولتیپل میلوما را مطالعه کنید.
نامهای دیگر آمیلوئیدوز با زنجیره سبک عبارتند از AL و آمیلوئیدوز اولیه.
آمیلوئیدوز با زنجیره سبک تنها یکی از بیماریهایی است که در آن آمیلوئید تجمع مییابد و مشکلاتی را ایجاد میکند. آمیلوئیدوز همچنین میتواند ناشی از یک بیماری ژنتیکی (ارثی) به نام آمیلوئیدوز خانوادگی (familial amyloidosis) باشد. عفونت و یا التهاب طولانی مدت (مزمن) نیز میتواند باعث آمیلوئیدوز شود. این حالت به عنوان آمیلوئیدوز ثانویه یا AA شناخته میشود. این انواع دیگر آمیلوئیدوز در اینجا پوشش داده نشده است.
ماکروگلوبولینمی والدنستروم (WM یا Waldenstrom macroglobulinemia)
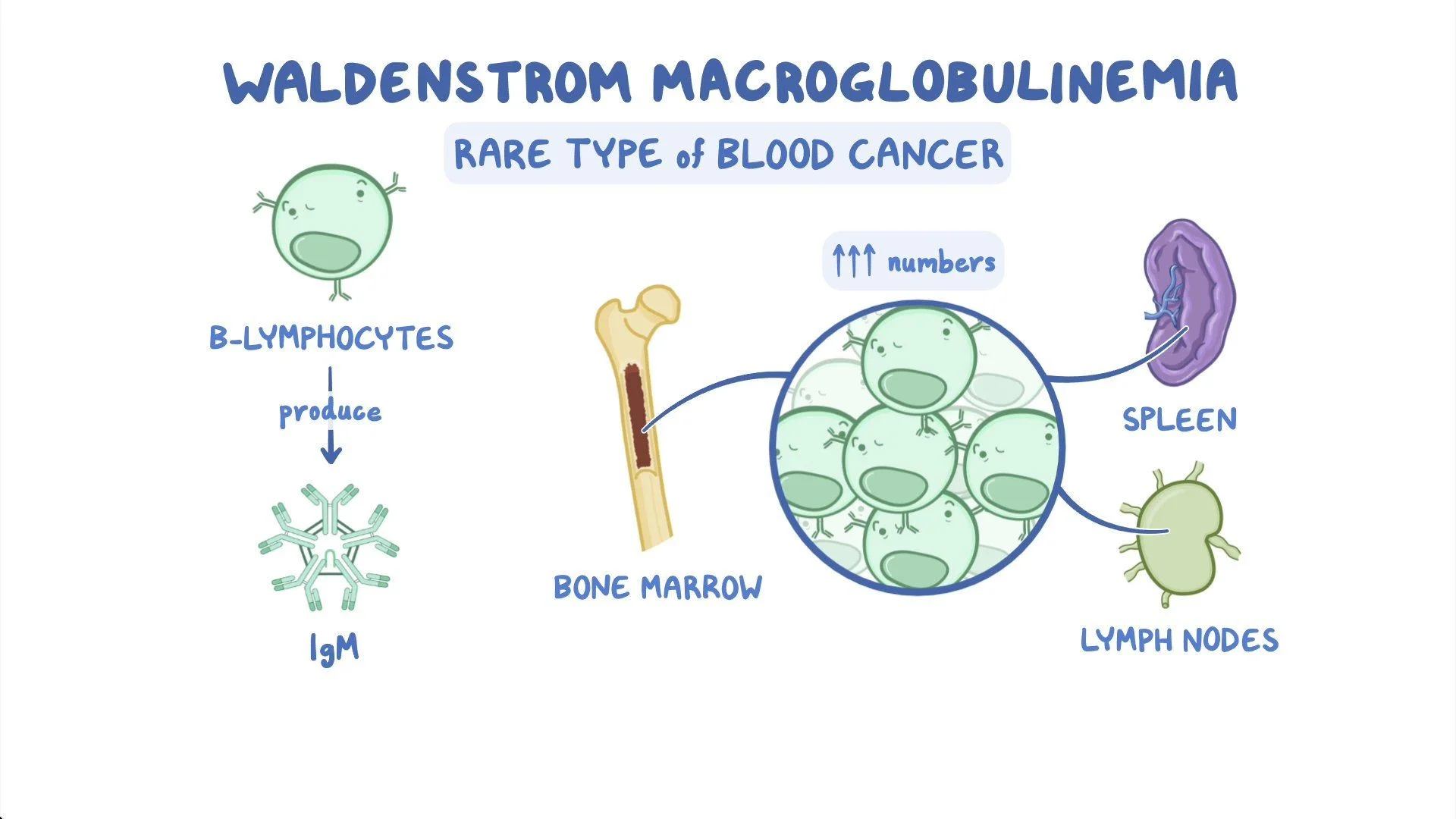
سلولهای سرطانی در افراد مبتلا به WM مشابه سلولهای مولتیپل میلوما و لنفوم غیر هوچکین (NHL) است. مولتیپل میلوما به عنوان سرطان سلولهای پلاسما در نظر گرفته میشود و لنفوم غیر هوچکین سرطان لنفوسیتها است. سلولهای WM دارای ویژگیهای سلولهای پلاسما و لنفوسیتها هستند.
سلولهای WM مقادیر زیادی از نوع خاصی از آنتی بادی (ایمونوگلوبولین M یا IgM) میسازند که به عنوان ماکروگلوبولین (macroglobulin) شناخته میشود. هر آنتی بادی (پروتئین) ساخته شده توسط سلولهای WM یکسان است، بنابراین پروتئین مونوکلونال یا فقط پروتئین M نامیده میشود.
تجمع این پروتئین M در بدن میتواند منجر به بسیاری از علائم WM از جمله خونریزی بیش از حد، مشکلات بینایی و مشکلات سیستم عصبی شود. اگرچه WM دارای یک گاموپاتی مونوکلونال است و گاهی اوقات در سایر اختلالات سلولهای پلاسما گروه بندی میشود اما نوعی NHL در نظر گرفته میشود. نام دیگر WM لنفوم لنفوپلاسمی است. درمان WM شامل داروهایی است که برای درمان مولتیپل میلوما و NHL استفاده میشود.
آمار کلیدی در مورد مولتیپل میلوما
مولتیپل میلوما یک سرطان نسبتاً ناشایع است. در ایالات متحده، خطر ابتلا به مولتیپل میلوما در طول زندگی 1 در 132 (۷۶/۰ درصد) است.
تخمینهای انجمن سرطان آمریکا برای مولتیپل میلوما در ایالات متحده برای سال 2023 عبارتند از:
- حدود 35730 مورد جدید تشخیص داده خواهد شد (19860 مورد در مردان و 15870 مورد در زنان).
- پیش بینی میشود حدود 12590 مرگ (7000 در مردان و 5590 در زنان) رخ دهد.
علائم و نشانههای مولتیپل میلوما
برخی از بیماران مبتلا به مولتیپل میلوما هیچ علامتی ندارند. برخی دیگر ممکن است علائم مشترک این بیماری را داشته باشند از جمله:
مشکلات استخوانی
- درد استخوان که میتواند در هر استخوانی باشد اما اغلب در پشت، باسن و جمجمه است.
- ضعف استخوان، چه در سرتاسر (پوکی استخوان) و چه در جایی که پلاسماسیتوما وجود دارد.
- شکستگی استخوانها (fractures)، گاهی اوقات تنها به دلیل استرس یا آسیب جزئی
کم خونی
کمبود گلبولهای قرمز، گلبولهای سفید و پلاکتهای خون در مولتیپل میلوما شایع است و ممکن است منجر به علائم دیگری شود.
- کم خونی: کاهش تعداد گلبولهای قرمز خون که میتواند باعث ضعف، کاهش توانایی ورزش، تنگی نفس و سرگیجه شود.
- لکوپنی: تعداد بسیار کمی گلبولهای سفید خون که میتوانند مقاومت در برابر عفونتهایی مانند ذات الریه را کاهش دهند.
- ترومبوسیتوپنی: هنگامی که تعداد پلاکتهای خون پایین است که ممکن است باعث خونریزی جدی حتی با خراشها، بریدگیها یا کبودیهای جزئی شود.
سطح بالای کلسیم خون
سطوح بالای کلسیم در خون (که هیپرکلسمی یا hypercalcemia نامیده میشود) میتواند باعث موارد زیر شود:
- تشنگی شدید که منجر به نوشیدن زیاد میشود.
- ادرار کردن (Urinating) زیاد
- کم آبی بدن
- مشکلات کلیوی و حتی نارسایی کلیه
- یبوست شدید
- درد شکم (belly)
- از دست دادن اشتها
- ضعف
- احساس خواب آلودگی
- گیجی
اگر سطح کلسیم به اندازه کافی بالا رود، حتی میتوانید به کما بروید.
علائم سیستم عصبی
اگر میلوما استخوانهای ستون فقرات را ضعیف کند، میتوانند فرو بریزند و به اعصاب نخاعی فشار بیاورند. این فشردگی نخاع (spinal cord compression) نامیده میشود و میتواند باعث بروز موارد زیر شود:
- کمر درد شدید ناگهانی
- بی حسی، اغلب در پاها
- ضعف عضلانی، اغلب در پاها
این یک وضعیت پزشکی اورژانسی است و باید فوراً با پزشک خود تماس بگیرید یا به اورژانس مراجعه کنید. اگر فشردگی نخاع فوراً درمان نشود، احتمال فلج دائمی وجود دارد.
آسیب عصبی
گاهی اوقات، پروتئینهای غیر طبیعی تولید شده توسط سلولهای میلوما برای اعصاب سمی هستند. این آسیب میتواند منجر به ضعف و بیحسی و گاهی اوقات احساس سوزن سوزن شدن شود. این وضعیت نوروپاتی محیطی (peripheral neuropathy) نیز نامیده میشود.
هایپر ویسکوزیته (Hyperviscosity)
در برخی بیماران، مقادیر زیادی پروتئین میلوما میتواند باعث “غلیظ شدن” خون شود. این غلیظ شدن هیپر ویسکوزیته نامیده میشود. میتواند جریان خون به مغز را کند کند و باعث شود:
- گیجی
- سرگیجه
- علائم سکته مغزی، مانند ضعف در یک طرف بدن و تکلم نامفهوم
بیمارانی که این علائم را دارند باید با پزشک خود تماس بگیرند. حذف پروتئین از خون با استفاده از روشی به نام پلاسمافرزیس (plasmapheresis) میتواند به سرعت این مشکل را معکوس کند. (توجه: این وضعیت حالتی نیست که بتوان آن را با داروهایی به نام «رقیق کنندههای خون» درمان کرد.)
مشکلات کلیوی
پروتئین میلوما میتواند به کلیهها آسیب برساند. در اوایل، این هیچ علامتی ایجاد نمیکند اما علائم آسیب کلیه ممکن است در آزمایش خون یا آزمایش ادرار مشاهده شود. با شروع از کار افتادن کلیهها، توانایی خلاص شدن از شر نمک اضافی، مایعات و مواد زائد بدن را از دست میدهند. این میتواند منجر به علائمی مانند موارد زیر گردد:
- ضعف
- تنگی نفس
- خارش
- تورم پا
عفونتها
احتمال ابتلا به عفونت در بیماران میلوما بسیار بیشتر است. هنگامی که فردی مبتلا به میلوما دچار عفونت میشود، ممکن است دیر به درمان پاسخ دهد. آن شخص ممکن است برای مدت طولانی بیمار بماند. پنومونی (Pneumonia) یک عفونت شایع و جدی است که در بیماران میلوما دیده میشود.
علائم و نشانههای آمیلوئیدوز زنجیره سبک
بیماران مبتلا به آمیلوئیدوز (که در مبحث مولتیپل میلوما چیست، توضیح داده شد) ممکن است برخی از مشکلات مشابه بیماران مبتلا به میلوما را داشته باشند، مانند مشکلات کلیوی و آسیب عصبی. آنها همچنین ممکن است مشکلات دیگری داشته باشند، مانند:
- مشکلات قلبی: قلب ممکن است بزرگ شده و ضعیف شود. در برخی از افراد، قلب آنقدر ضعیف میشود که مایعی در ریهها جمع میشود و باعث میشود آنها احساس تنگی نفس کنند. همچنین ممکن است مایع در پاها و پاها جمع شود (ادم). این نارسایی احتقانی قلب (congestive heart failure) نامیده میشود.
- بزرگ شدن کبد: ممکن است فرد کبد را در زیر دندههای سمت راست احساس کند. وقتی این مقدار بزرگ میشود میتواند روی معده فشار بیاورد بنابراین فرد بعد از خوردن مقدار کمی غذا احساس سیری میکند.
- بزرگ شدن زبان: وقتی آمیلوئید در زبان جمع میشود، میتواند بزرگتر شود. این میتواند منجر به مشکلات بلع و مشکلات تنفسی در طول خواب (آپنه خواب یا sleep apnea) شود.
- تغییرات پوستی: تغییر در رنگ یا بافت، کبودی آسان و خونریزی در پوست اطراف چشم (“چشمهای راکون یا raccoon eyes “)
- مشکلات کلیوی
- سندرم تونل کارپال (Carpal tunnel syndrome) که باعث بی حسی و ضعف در دستها میشود.
چه چیزی باعث مولتیپل میلوما میشود؟
دانشمندان هنوز دقیقاً نمیدانند چه چیزی باعث بیشتر موارد مولتیپل میلوما میشود. با این حال، آنها در درک اینکه چگونه تغییرات خاصی در DNA میتواند سلولهای پلاسما را سرطانی کند، پیشرفت کرده اند. DNA ماده شیمیایی است که دستورالعملهای تقریباً هر کاری را که سلولهای ما انجام میدهند را حمل میکند.
- برخی از ژنها (بخشهایی از DNA ما) حاوی دستورالعملهایی برای کنترل زمان رشد و تقسیم سلولهای ما هستند. این ژنهایی که باعث رشد سلولی میشوند، انکوژن (oncogenes) نامیده میشوند.
- سایر ژنهایی که رشد سلولی را کند میکنند یا سلولها را در زمان مناسب میکشند، ژنهای سرکوب کننده تومور (tumor suppressor genes) نامیده میشوند.
سرطانها میتوانند ناشی از اشتباهات یا نقصهایی در DNA به نام جهش باشند که انکوژنها را فعال میکنند یا ژنهای سرکوبگر تومور را خاموش میکنند.
مطالعات اخیر نشان داده اند که ناهنجاریهای برخی از انکوژنها (مانند MYC) در اوایل دوره تومورهای سلولهای پلاسما ایجاد میشوند. تغییرات در سایر انکوژنها (مانند ژنهای RAS) اغلب پس از درمان در سلولهای میلوما در مغز استخوان مشاهده میشود و تغییرات در ژنهای سرکوبکننده تومور (مانند ژن p53) با انتشار به سایر اندامها مرتبط است.
سلولهای میلوما نیز ناهنجاریهایی را در کروموزومهای خود نشان میدهند. در سلولهای انسانی، DNA به صورت کروموزومهایی بسته بندی میشود. اگرچه سلولهای طبیعی انسان حاوی 46 کروموزوم هستند اما برخی از سلولهای سرطانی ممکن است کروموزومهای اضافی داشته باشند (به نام تکرار یا duplication) یا تمام یا بخشی از کروموزوم از دست رفته باشد (به نام حذف یا deletion). یکی از یافتههای رایج در سلولهای میلوما این است که قسمتهایی از کروموزوم شماره 17 از دست رفته است. به نظر میرسد که این حذفها میلوما را تهاجمیتر و در برابر درمان مقاومتر میکنند.
در حدود نیمی از افراد مبتلا به میلوما، بخشی از یک کروموزوم با بخشی از کروموزوم دیگر در سلولهای میلوما جا به جا شده است. به این جابجایی (translocation) میگویند. هنگامی که این اتفاق در یک منطقه حیاتی در کنار انکوژن رخ میدهد، میتواند انکوژن را روشن کند.
محققان دریافتهاند که بیماران مبتلا به تومورهای پلاسما سل ناهنجاریهای مهمی در سایر سلولهای مغز استخوان دارند و این ناهنجاریها ممکن است باعث رشد بیش از حد سلولهای پلاسما شوند. سلولهای خاصی در مغز استخوان به نام سلولهای دندریتیک (dendritic cells)، هورمونی به نام اینترلوکین-6 (IL-6) ترشح میکنند که سلولهای پلاسما طبیعی را تحریک میکند تا رشد کنند. به نظر میرسد تولید بیش از حد IL-6 توسط این سلولها عامل مهمی در ایجاد تومورهای سلولهای پلاسما باشد.
عوامل خطرزا برای مولتیپل میلوما
عامل خطرزا هر چیزی است که شانس ابتلای فرد به بیماری مانند سرطان را تغییر دهد. سرطانهای مختلف عوامل خطرزا متفاوتی دارند. برای مثال، قرار گرفتن پوست در معرض نور شدید خورشید یک عامل خطرزا برای سرطان پوست است. سیگار یک عامل خطرزا برای سرطان ریه و بسیاری از سرطانهای دیگر است اما عوامل خطرزا همه چیز را به ما نمیگوید. افرادی که هیچ فاکتور خطری ندارند همچنان میتوانند به این بیماری مبتلا شوند. همچنین داشتن یک عامل خطرزا یا حتی چندین عامل به این معنی نیست که فرد به این بیماری مبتلا میشود.
در اینجا چند عامل خطرزا وجود دارد که میتواند بر شانس ابتلا به مولتیپل میلوما تأثیر بگذارد.
سن
با افزایش سن، خطر ابتلا به مولتیپل میلوما افزایش مییابد. کمتر از 1 درصد موارد در افراد کمتر از 35 سال تشخیص داده میشود. اکثر افراد مبتلا به این سرطان حداقل 65 سال سن دارند.
جنسیت
مردان اندکی بیشتر از زنان در معرض ابتلا به مولتیپل میلوما هستند.
نژاد
مولتیپل میلوما در آمریکاییهای آفریقایی تبار بیش از دو برابر آمریکاییهای سفید پوست شایع است. دلیل این امر معلوم نیست.
سابقه خانوادگی
به نظر میرسد مولتیپل میلوما در برخی خانوادهها دیده میشود. احتمال ابتلا به میلوما در افرادی که خواهر یا برادر یا والدینی دارند بیشتر از افرادی است که سابقه خانوادگی این بیماری را ندارند. با این حال، اکثر بیماران هیچ بستگان مبتلایی ندارند، بنابراین این تنها تعداد کمی از موارد را شامل میشود.
چاقی
اضافه وزن یا چاقی خطر ابتلا به میلوما را در افراد افزایش میدهد.
ابتلا به سایر بیماریهای سلولهای پلاسما
افراد مبتلا به گاموپاتی مونوکلونال با اهمیت نامشخص (MGUS) یا پلاسماسیتوما منفرد نسبت به افرادی که این بیماریها را ندارند در معرض خطر بیشتری برای ابتلا به مولتیپل میلوما هستند.
آیا میلوما مولتیپل قابل پیشگیری است؟
برای انواع خاصی از سرطان، عوامل خطرزا در بیشتر موارد شناخته شده است. به عنوان مثال، سیگار باعث بیشتر سرطانهای ریه میشود. این امر فرصتی را برای پیشگیری فراهم میکند. برای سرطانهای دیگر، مانند سرطان دهانه رحم، پیش سرطانها را میتوان با آزمایش غربالگری زود تشخیص داد و قبل از تبدیل شدن به سرطان مهاجم درمان کرد.
با مولتیپل میلوما، موارد کمی با عوامل خطرزا مرتبط است که میتوان از آنها اجتناب کرد. هیچ راه شناخته شده ای برای جلوگیری از ایجاد مولتیپل میلوما در افراد مبتلا به گاموپاتی مونوکلونال با اهمیت نامشخص یا پلاسماسیتوم منفرد وجود ندارد. تحقیقات در حال بررسی این موضوع است که آیا درمان برخی از میلومای مولتیپل پرخطر ممکن است از تبدیل شدن آن به مولتیپل میلوم فعال جلوگیری کند یا خیر.
آیا میلوما مولتیپل زود تشخیص داده میشود؟
تشخیص زودهنگام مولتیپل میلوما دشوار است. اغلب، مولتیپل میلوما تا زمانی که به مرحله پیشرفته نرسد، هیچ علامتی ایجاد نمیکند. گاهی اوقات، ممکن است علائم مبهمی ایجاد کند که در ابتدا به نظر میرسد ناشی از بیماریهای دیگر باشد. گاهی اوقات، زمانی که یک آزمایش خون معمولی مقدار غیرطبیعی پروتئین در خون را نشان میدهد، مولتیپل میلوما در اوایل تشخیص داده میشود.
افراد مبتلا به MGUS (گاموپاتی مونوکلونال با اهمیت ناشناخته) یا پلاسماسیتوما منفرد در معرض خطر ابتلا به مولتیپل میلوما هستند و برای نظارت بر آن آزمایش خون منظم انجام میدهند. مولتیپل میلوما ممکن است در این افراد زودتر از افرادی که MGUS یا پلاساسیتوم منفرد ندارند، تشخیص داده شود.
آزمایشهایی برای یافتن مولتیپل میلوما
اگر علائم حاکی از آن است که ممکن است فرد مبتلا به مولتیپل میلوما باشد، آزمایشهای بیشتری انجام میشود.
تستهای آزمایشگاهی
ضربان خون
شمارش کامل خون (complete blood count یا CBC) آزمایشی است که سطح گلبولهای قرمز، گلبولهای سفید و پلاکتها را در خون اندازه گیری میکند. اگر تعداد زیادی سلول میلوما در مغز استخوان وجود داشته باشد، سطح برخی از این سلولهای خونی ممکن است پایین باشد. شایع ترین یافته کاهش تعداد گلبولهای قرمز خون (کم خونی) است.
آزمایشات شیمیایی خون
سطح کراتینین خون، آلبومین، کلسیم و سایر الکترولیتها بررسی خواهد شد.
- سطح کراتینین (Creatinine) نشان میدهد که کلیههای شما چقدر خوب کار میکنند. سطوح بالا به این معنی است که کلیهها به خوبی کار نمیکنند. این در افراد مبتلا به میلوما شایع است.
- آلبومین پروتئینی است که در خون یافت میشود. سطوح پایین در میلوما دیده میشود.
- سطح کلسیم ممکن است در افراد مبتلا به میلوم پیشرفته بالا باشد. سطوح بالای کلسیم (هیپرکلسمی) میتواند باعث علائم خستگی، ضعف و گیجی شود.
ممکن است آزمایش خون برای اندازه گیری سطح لاکتیک دهیدروژناز (LDH یا lactic dehydrogenase) نیز انجام شود. این میتواند یک شاخص مفید برای پیش آگهی (چشم انداز) بیمار باشد. سطوح بالا به این معنی است که بیماری پیشرفته تر است و ممکن است پیش آگهی بدتری داشته باشد.
آزمایشات ادرار
نمونه ادرار معمولی برای جستجوی پروتئین میلوما که در کلیه فیلتر شده است، گرفته میشود. همچنین به احتمال زیاد از شما خواسته میشود که نمونه ادراری را که در یک دوره 24 ساعته جمع آوری شده است را تحویل بدهید تا بتواند میزان پروتئین میلوما را اندازه گیری کند. این آزمایشات الکتروفورز پروتئین ادرار (urine protein electrophoresis یا UPEP) و ایمونوفیکساسیون ادرار (urine immunofixation) نامیده میشوند.
ایمونوگلوبولینهای کمی (Quantitative immunoglobulins)
این آزمایش سطوح خونی آنتی بادیهای مختلف (که ایمونوگلوبولینها نیز نامیده میشوند) را اندازه گیری میکند. انواع مختلفی از آنتی بادیها در خون وجود دارد: IgA، IgD، IgE، IgG و IgM. سطح این ایمونوگلوبولینها اندازهگیری میشود تا مشخص شود که آیا آنها به طور غیرعادی بالا یا پایین هستند. در مولتیپل میلوما، سطح یک نوع ممکن است بالا باشد در حالی که بقیه پایین باشند.
الکتروفورز (Electrophoresis)
آنتی بادی تولید شده توسط سلولهای میلوما غیر طبیعی است زیرا مونوکلونال است (دقیقاً یکسان). الکتروفورز پروتئین سرم (SPEP یا Serum protein electrophoresis) آزمایشی است که آنتی بادیهای موجود در خون را اندازه گیری میکند و میتواند یک آنتی بادی مونوکلونال را پیدا کند.
آزمایش دیگری به نام ایمونوفیکساسیون (immunofixation) یا ایمونوالکتروفورز (immunoelectrophoresis) برای تعیین نوع دقیق آنتی بادی غیر طبیعی (IgG. IgA یا نوع دیگری) استفاده میشود. پیدا کردن یک آنتی بادی مونوکلونال در خون ممکن است اولین قدم در تشخیص مولتیپل میلوما باشد. این پروتئین غیرطبیعی با نامهای مختلفی از جمله ایمونوگلوبولین مونوکلونال، پروتئین مونوکلونال (پروتئین M)، اسپایک M یا پاراپروتئین شناخته میشود.
آنتی بادیها از زنجیرههای پروتئینی تشکیل شده اند: 2 زنجیره بلند (سنگین) و 2 زنجیره کوتاه (سبک). گاهی اوقات قطعاتی از پروتئین غیر طبیعی میلوما از طریق کلیه به ادرار فیلتر میشود. این پروتئین ادرار که به پروتئین Bence Jones معروف است بخشی از آنتی بادی به نام زنجیره سبک است. آزمایشهایی که برای یافتن آنتیبادی مونوکلونال در ادرار استفاده میشوند، الکتروفورز پروتئین ادرار (UPEP) و ایمونوفیکساسیون ادرار نامیده میشوند. اینها اغلب بر روی ادراری که در یک دوره 24 ساعته جمع آوری شده است، انجام میشود، نه فقط بر روی یک نمونه ادرار معمولی.
زنجیر سبک بدون سرم (Serum free light chains)
این آزمایش خون میتواند سطح زنجیره سبک را در خون اندازهگیری کند و زمانی که به دنبال میلوما یا آمیلوئیدوز زنجیره سبک هستید، انجام میشود.
این در موارد نادر میلوما که در آن پروتئین M توسط SPEP یافت نمیشود، بسیار مفید است. از آن جایی که SPEP سطح آنتی بادیهای دست نخورده (کل) را اندازه گیری میکند، نمیتواند فقط مقدار زنجیرههای سبک را اندازه گیری کند.
این آزمایش همچنین نسبت زنجیره سبک را محاسبه میکند که برای بررسی اینکه آیا یک نوع زنجیره سبک بیشتر از دیگری وجود دارد یا خیر، استفاده میشود. دو نوع زنجیره سبک وجود دارد: کاپا (kappa) و لامبدا (lambda). به طور معمول، آنها به مقدار مساوی در خون وجود دارند و نسبت 1 به 1 را نشان میدهند. اگر یک نوع زنجیره سبک بیشتر از دیگری باشد، نسبت متفاوت خواهد بود که میتواند نشانه ای از میلوما باشد.
میکروگلوبولین بتا 2 (Beta-2 microglobulin)
این پروتئین دیگری است که توسط سلولهای میلوما ساخته میشود. اگرچه این پروتئین به خودی خود مشکلی ایجاد نمیکند اما میتواند یک شاخص مفید برای پیش آگهی (چشم انداز) بیمار باشد. سطوح بالا به این معنی است که بیماری پیشرفته تر است و ممکن است پیش آگهی بدتری داشته باشد.
انواع بیوپسی
بیوپسی مغز استخوان (Bone marrow biopsy)
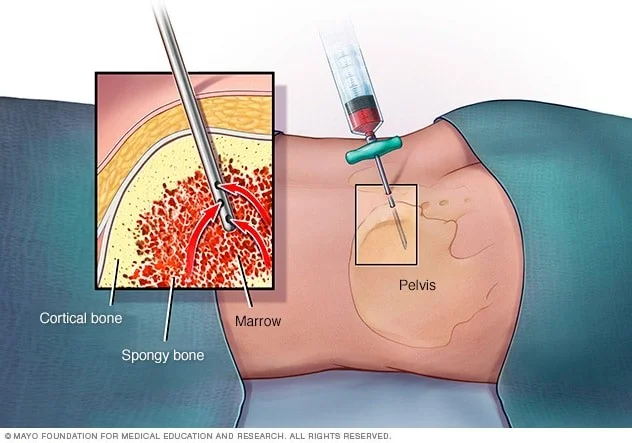
افراد مبتلا به مولتیپل میلوما دارای تعداد زیادی پلاسماسل در مغز استخوان خود هستند. روشی که برای بررسی مغز استخوان استفاده میشود، بیوپسی و آسپیراسیون مغز استخوان نامیده میشود. این روش هم در مطب پزشک و هم در بیمارستان قابل انجام است.
در آسپیراسیون مغز استخوان (bone marrow aspiration)، پشت استخوان لگن با بی حسی موضعی بی حس میشود. سپس یک سوزن وارد استخوان شده و از یک سرنگ برای برداشتن مقدار کمی از مغز استخوان مایع استفاده میشود. این باعث ایجاد یک درد شدید کوتاه میشود.
در بیوپسی، یک سوزن برای برداشتن یک قطعه کوچک از استخوان و مغز استفاده میشود. بیماران ممکن است در طول بیوپسی فشاری را احساس کنند. وقتی داروی بی حس کننده از بین میرود، مقداری درد در ناحیه بیوپسی وجود دارد. اکثر بیماران میتوانند بلافاصله پس از عمل به خانه بروند.
بافت مغز استخوان در آزمایشگاه بررسی میشود تا ظاهر، اندازه و شکل سلولها، نحوه چیدمان سلولها مشخص شده و تعیین شود که آیا سلولهای میلوما در مغز استخوان وجود دارند یا خیر و اگر وجود دارند، چه تعدادی هستند. آسپیرات یا aspirate (قسمت مایع مغز استخوان) همچنین ممکن است برای آزمایشهای دیگر، از جمله ایمونوهیستوشیمی و فلوسیتومتری و آنالیز کروموزوم، از جمله کاریوتیپ و هیبریداسیون فلورسنت درجا (همچنین به عنوان FISH) ارسال شود.
- ایمونوهیستوشیمی (Immunohistochemistry): بخشی از نمونه بیوپسی با پروتئینهای خاصی درمان میشود که باعث تغییر رنگ و کمک به شناسایی سلولهای میلوما میشوند.
- فلوسایتومتری (Flow cytometry): نمونه ای از مغز استخوان با پروتئینهای خاصی که فقط به سلولهای خاصی میچسبند، درمان میشود. این میتواند به تعیین اینکه آیا آن سلولها غیرطبیعی هستند و آیا سلولهای میلوما، سلولهای لنفوم، برخی سرطانهای دیگر یا یک بیماری غیرسرطانی هستند، کمک میکند.

- سیتوژنتیک (Cytogenetics): آزمایشی که کروموزومها (رشتههای بلند DNA) را در سلولهای طبیعی مغز استخوان و سلولهای میلوما ارزیابی میکند. برخی از سلولهای میلوما ممکن است کروموزومهای بسیار زیاد، کروموزومهای بسیار کم یا سایر ناهنجاریهای کروموزومی (مانند جابهجایی و حذف) داشته باشند. یافتن این تغییرات گاهی اوقات میتواند به پیش بینی پیش آگهی (چشم انداز) فرد کمک کند. آزمایش سیتوژنتیک معمولاً حدود 2 تا 3 هفته طول میکشد تا نتیجه حاصل شود.
- هیبریداسیون درجا فلورسنت (FISH یا Fluorescent in situ hybridization): از رنگهای فلورسنت خاصی استفاده میکند که فقط به قسمتهای خاصی از کروموزومها متصل میشوند. این میتواند اکثر تغییرات کروموزومی (مانند جابه جاییها و حذفها) را که در آزمایشگاه در آزمایشات سیتوژنتیک استاندارد دیده میشوند و همچنین برخی تغییرات بسیار کوچک که با آزمایشهای سیتوژنتیک معمولی قابل مشاهده نیستند، پیدا کند. این روش بسیار دقیق است و نتایج اغلب در عرض چند روز در دسترس هستند.

بیوپسی آسپیراسیون با سوزن ظریف (Fine needle aspiration biopsy)
آسپیراسیون با سوزن ظریف (FNA) از یک سوزن بسیار نازک و یک سرنگ برای خارج کردن مقدار کمی از بافت از تومور یا غدد لنفاوی استفاده میکند. پزشک میتواند سوزن را در حالی که بزرگ شدن غدد لنفاوی در نزدیکی سطح بدن احساس میکند، نشانه بگیرد. اگر ناحیه غیرطبیعی (تومور) در عمق بدن باشد، میتوان سوزن را در حین مشاهده توموگرافی کامپیوتری (computed tomography یا CT) هدایت کرد. مزیت اصلی FNA این است که نیازی به جراحی ندارد. نقطه ضعف آن این است که در برخی موارد سوزن نازک نمیتواند بافت کافی برای تشخیص قطعی را جدا کند.
بیوپسی با سوزن مرکزی (Core needle biopsy)
این آزمایش مشابه FNA است اما از یک سوزن بزرگتر استفاده میشود و یک نمونه بافت بزرگتر برداشته میشود.
اگر ناحیهای در عکسبرداری با اشعه ایکس غیرطبیعی به نظر برسد، ممکن است برای تایید پلاسماسیتوما بودن آن، بیوپسی مورد نیاز باشد. اغلب از بیوپسی سوزنی (ریز یا هسته ای) استفاده میشود.
تستهای تصویر برداری
تستهای تصویر برداری از امواج صوتی، اشعه ایکس، میدانهای مغناطیسی یا مواد رادیواکتیو برای ایجاد تصاویری از داخل بدن شما استفاده میکنند. آزمایشات تصویر برداری ممکن است به دلایل مختلفی انجام شوند، مانند:
- برای بررسی نواحی مشکوک که ممکن است سرطان باشند.
- برای فهم میزان گسترش سرطان
- برای کمک به تعیین اینکه آیا درمان موثر است یا خیر
اشعه ایکس استخوان (Bone x-rays)
اشعه ایکس میتواند تخریب استخوان ناشی از سلولهای میلوما را تشخیص دهد. اغلب پزشکان یک سری عکس برداری با اشعه ایکس انجام میدهند که بیشتر استخوانها را شامل میشود. این بررسی استخوان (bone survey) یا بررسی اسکلتی (skeletal survey) نامیده میشود.
سی تی اسکن (توموگرافی کامپیوتری یا Computed tomography scan)
سی تی اسکن از اشعه ایکس گرفته شده از زوایای مختلف استفاده میکند که توسط کامپیوتر برای ایجاد تصاویر دقیق از اندامها ترکیب میشود. گاهی اوقات، این آزمایش میتواند به شما کمک کند تا بفهمید که آیا استخوانهای شما توسط میلوما آسیب دیده اند یا خیر. همچنین میتوان از آن برای هدایت سوزن بیوپسی به ناحیه مورد نظر استفاده کرد.
اسکن تصویر برداری رزونانس مغناطیسی (MRI یا Magnetic resonance imaging)
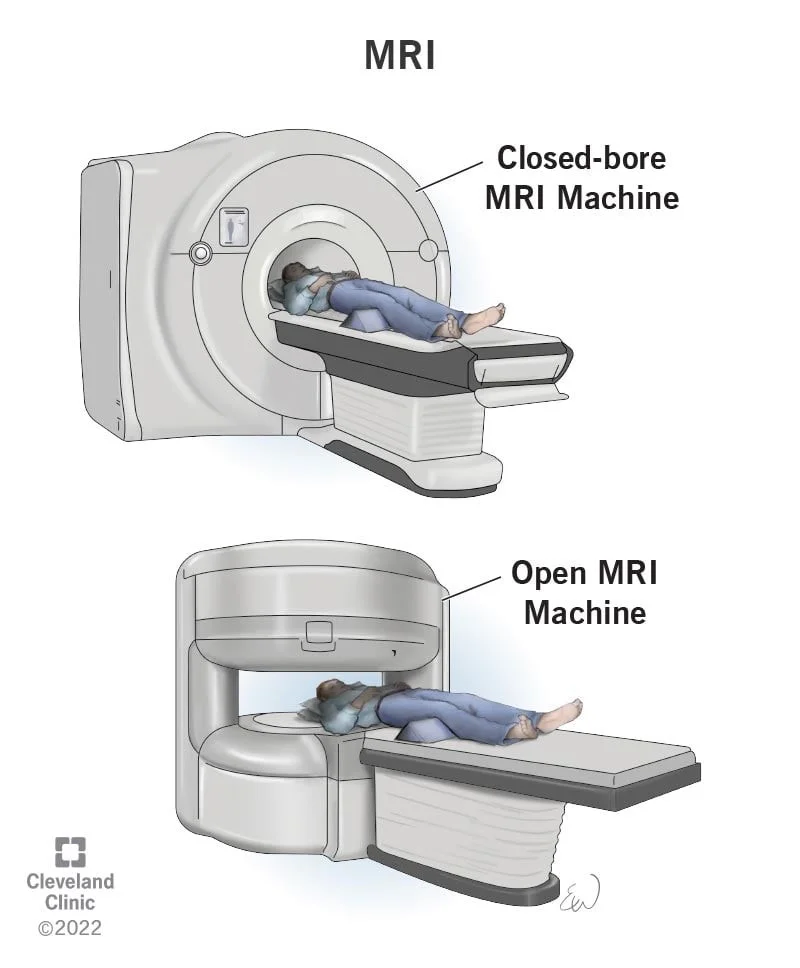
مانند سی تی اسکن، اسکن ام آر آی تصاویر دقیقی از بافتهای نرم بدن نشان میدهد اما در اسکن MRI به جای اشعه ایکس از امواج رادیویی و آهنرباهای قوی استفاده میشود. ماده حاجب به نام گادولینیوم (gadolinium) ممکن است قبل از اسکن به داخل ورید تزریق شود تا جزئیات را بهتر ببینید.
اسکن MRI برای بررسی استخوانها، مغز و نخاع بسیار مفید است. از آن جایی که MRI میتواند پلاسماسیتومهایی را پیدا کند که در عکس برداریهای معمولی دیده نمیشوند، اگر بیمار دردی در استخوان داشته باشد اما هیچ چیز غیر طبیعی در اشعه ایکس دیده نشود، میتواند مفید باشد. MRI همچنین میتواند برای بررسی مغز استخوان در بیماران مبتلا به مولتیپل میلوما استفاده شود.
اسکن توموگرافی گسیل پوزیترون (PET یا Positron emission tomography)
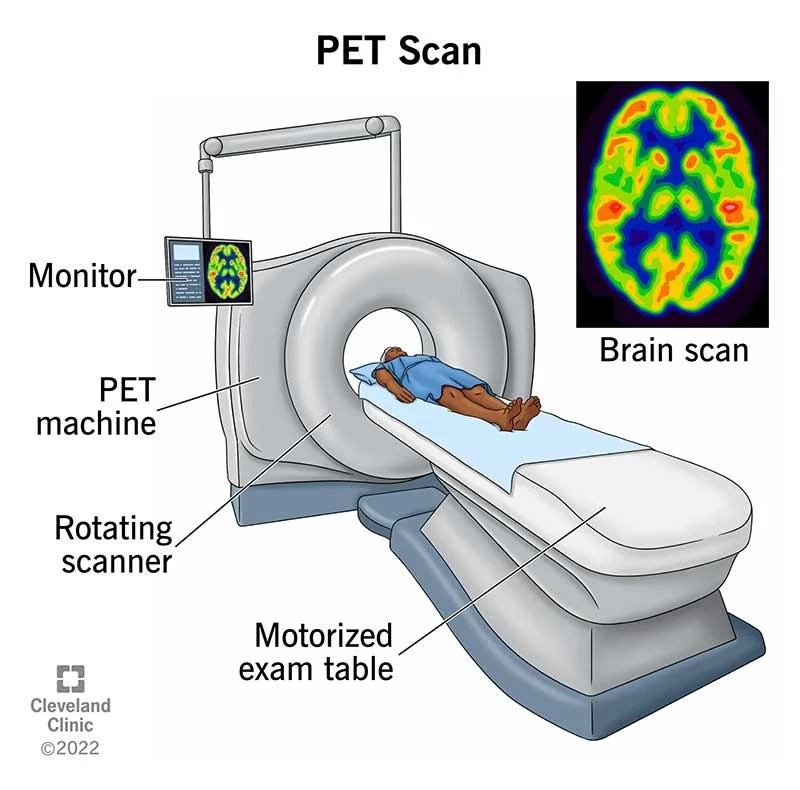
در این آزمایش، نوعی قند رادیواکتیو وارد رگ میشود و در سراسر بدن حرکت میکند. سلولهای سرطانی مقادیر بالایی از این قند را جذب میکنند. سپس یک دوربین مخصوص عکسهایی میگیرد که نواحی تجمع قند در بدن را نشان میدهد. اسکن PET اغلب با سی تی اسکن (معروف به اسکن PET/CT) ترکیب میشود.
هنگامی که به نظر میرسد یک بیمار پلاسماسیتوما انفرادی دارد، ممکن است از اسکن PET برای جستجوی پلاسماسیتوماهای دیگر استفاده شود. مانند اسکنهای MRI، اسکنهای PET میتوانند پلاسماسیتومهایی را پیدا کنند که در عکس برداری معمولی دیده نمیشوند، بنابراین اگر بیمار درد در استخوان داشته باشد اما نتیجه اشعه ایکس منفی باشد، مفید است.
اکوکاردیوگرافی (ECHO یا Echocardiogram)

آمیلوئیدوز اغلب قلب را تحت تاثیر قرار میدهد، بنابراین اگر پزشک شما این اختلال را تشخیص دهد یا مشکوک باشد، ممکن است اکوکاردیوگرام (ECHO) تجویز شود. این آزمایش در اصل سونوگرافی قلب است. از امواج صوتی برای مشاهده عضله قلب و نحوه عملکرد آن استفاده میکند. اکوکاردیوگرام میتواند تشخیص دهد که آیا اندازه قلب طبیعی است و آیا به طور طبیعی پمپاژ میکند. همچنین در صورت مشکوک بودن به آمیلوئید بسیار مفید است زیرا آمیلوئید موجود در عضله قلب با ماهیچه طبیعی قلب متفاوت به نظر میرسد.
تشخیص مولتیپل میلوما
مولتیپل میلوما اغلب بر اساس آزمایشات، علائم بیمار و معاینه فیزیکی بیمار توسط پزشک تشخیص داده میشود. تشخیص مولتیپل میلوما به یکی از موارد زیر نیاز دارد:
- تومور پلاسماسل (تأیید شده با بیوپسی) یا حداقل 10 درصد پلاسماسل در مغز استخوان و
- حداقل یکی از موارد زیر:
- سطح کلسیم خون بالا
- عملکرد ضعیف کلیهها
- تعداد کم گلبولهای قرمز خون (کم خونی)
- سوراخهایی در استخوانهای ناشی از تومور که در مطالعات تصویر برداری (CT، MRI، PET scan) یافت شد.
- افزایش یک نوع زنجیره سبک در خون به طوری که یک نوع آن 100 برابر بیشتر از دیگری است.
- 60 درصد یا بیشتر سلولهای پلاسما در مغز استخوان
میلوم اسمولدرینگ
این اصطلاح به معنای میلوم اولیه است که هیچ علامتی ایجاد نمیکند. افراد مبتلا به این میلوما دارای برخی از علائم مولتیپل میلوما هستند، مانند هر یک از موارد زیر:
- سلولهای پلاسما در مغز استخوان بین 10 تا 60 درصد
- سطح بالای ایمونوگلوبولین مونوکلونال (پروتئین M) در خون
- سطح بالای زنجیرههای سبک در ادرار (که پروتئین بنس جونز نیز نامیده میشود)
اما آنها دارای شمارش خون طبیعی، سطح کلسیم طبیعی، عملکرد طبیعی کلیه، بدون آسیب استخوان یا اندام و هیچ نشانه ای از آمیلوئیدوز هستند.
آمیلوئیدوز زنجیره سبک
تشخیص آمیلوئیدوز با زنجیره سبک زمانی انجام میشود که بیمار تمام موارد زیر را داشته باشد:
- علائم و نشانههای آمیلوئیدوز
- بیوپسی که آمیلوئید را در هر بافتی (چربی، مغز استخوان یا اندامی مانند قلب) نشان میدهد.
- آزمایش مثبت که نشان میدهد پروتئین آمیلوئید یک زنجیره سبک است و نه یک زنجیره سنگین
- سلولهای پلاسما غیر طبیعی در مغز استخوان، سطح بالای پروتئین M در خون یا سطح بالای پروتئین M در ادرار.
آمیلوئید میتواند در هر بافتی ایجاد شود و بیوپسی ممکن است بتواند این بیماری را تشخیص دهد. گاهی اوقات میتوان آن را در بیوپسی مغز استخوان مشاهده کرد. بیوپسی که اغلب برای جستجوی آمیلوئید انجام میشود از یک سوزن برای برداشتن مقداری چربی از دیواره شکم (belly) استفاده میکند. این کار پس از بی حس شدن پوست روی محل بیوپسی با دارو است. پزشک از یک رنگ مخصوص روی چربی برداشته شده برای جستجوی آمیلوئید استفاده میکند.
از آن جا که آمیلوئید اغلب بر قلب و کلیهها تأثیر میگذارد، ممکن است برای جستجوی آمیلوئید بیوپسی نیز انجام شود. این به ندرت برای بررسی اینکه آیا بیمار مبتلا به آمیلوئیدوز با زنجیره سبک است یا خیر، مورد نیاز است اما گاهی اوقات در فردی که آمیلوئید دارد، اگر مشخص نباشد که مشکلات قلبی یا کلیوی آنها ناشی از آمیلوئید یا مشکل دیگری است، انجام میشود.
آزمایشهای دیگری نیز اغلب انجام میشود تا تأیید شود که بیمار مبتلا به آمیلوئیدوز زنجیره سبک است و نه نوع دیگری. اینها شامل بیوپسی مغز استخوان، زنجیرههای سبک آزاد سرم و الکتروفورز ادرار هستند (این موارد قبلاً در این بخش مورد بحث قرار گرفته اند).
مراحل مولتیپل میلوما
پس از تشخیص سرطان در فردی، پزشکان سعی میکنند بفهمند که آیا سرطان گسترش یافته است یا خیر و اگر چنین است، این گسترش تا کجاست. این فرآیند مرحله بندی (staging) نامیده میشود. مرحله سرطان، میزان سرطان در بدن را توصیف میکند. این به تعیین اینکه سرطان چقدر جدی است و بهترین روش درمان آن کمک میکند. پزشکان همچنین هنگام صحبت در مورد آمار بقا از مرحله سرطان استفاده میکنند.
سیستم بازبینی بین المللی صحنه سازی (Revised International Staging System)
مولتیپل میلوما با استفاده از سیستم مرحلهبندی بینالمللی تجدید نظر شده (RISS) بر اساس 4 عامل مرحله بندی میشود:
- میزان آلبومین خون
- میزان بتا-2 میکروگلوبولین در خون
- مقدار LDH در خون
- ناهنجاریهای ژنی خاص (سیتوژنتیک) سرطان
- مغز استخوان ممکن است برای انجام آزمایشهایی به جهت بررسی کروموزومهای سلولهای سرطانی فرستاده شود. این آزمایش ممکن است سیتوژنتیک (cytogenetics) نیز نامیده شود. برخی تغییرات کروموزومی میتواند به معنای چشم انداز ضعیف تر باشد.
به عنوان مثال، از دست دادن یک قطعه از کروموزوم 17 با نتیجه ضعیف تری مرتبط است. یکی دیگر از ناهنجاریهای ژنتیکی که پیامد ضعیف را پیش بینی میکند، تبادل مواد از کروموزومهای 4 و 14 است. به این حالت جابهجایی میگویند. جابجایی شامل کروموزومهای 14 و 16 نیز با نتیجه ضعیف تری مرتبط است. این 3 تغییر کروموزومی خاص به عنوان موارد پرخطر در نظر گرفته میشوند. سایر ناهنجاریهای کروموزومی در معرض خطر استاندارد یا پرخطر در نظر گرفته میشوند.
- مرحله بندی سرطان میتواند پیچیده باشد، بنابراین از پزشک خود بخواهید آن را به روشی که شما درک میکنید برایتان توضیح دهد.
عواملی غیر از مرحله که بر بقا تأثیر میگذارند:
- عملکرد کلیه
سطح کراتینین خون نشان میدهد که کلیهها چقدر سالم هستند. کلیهها این ماده شیمیایی را از بدن دفع میکنند. هنگامی که آنها توسط ایمونوگلوبولین مونوکلونال آسیب میبینند، سطح کراتینین خون افزایش مییابد و چشم انداز بدتری را پیش بینی میکند.
- سن
سن نیز مهم است. در مطالعات سیستم مرحلهبندی بینالمللی، افراد مسن مبتلا به میلوما به این اندازه عمر نمیکنند.
- سلامت کلی
سلامت کلی میتواند بر روی چشم انداز فرد مبتلا به میلوما تأثیر بگذارد. به عنوان مثال، شرایط بهداشتی کنترل نشده، مانند دیابت یا بیماری قلبی، میتواند پیش آگهی بدتری را پیش بینی کند.
میزان بقای مولتیپل میلوما
نرخ بقا به شما نشان میدهد که چند درصد از افراد مبتلا به همان نوع و مرحله سرطان، برای مدت معینی (معمولاً 5 سال) پس از تشخیص هنوز زنده هستند. آنها نمیتوانند به شما بگویند که چقدر زنده خواهید ماند اما ممکن است به شما کمک کنند تا درک بهتری در مورد احتمال موفقیت روش درمانی خود داشته باشید.
به خاطر داشته باشید که میزان بقا تخمینی است و اغلب بر اساس نتایج قبلی تعداد زیادی از افرادی است که سرطان خاصی داشتند اما آنها نمیتوانند پیش بینی کنند که در مورد فرد خاصی چه اتفاقی خواهد افتاد. این آمار میتواند گیج کننده باشد و ممکن است شما را به پرسیدن سوالات بیشتری سوق دهد. از پزشک خود که با شرایط شما آشنایی دارد، بپرسید که چگونه این اعداد ممکن است برای شما اعمال شوند.
نرخ بقای نسبی 5 ساله چقدر است؟
نرخ بقای نسبی افراد مبتلا به همان نوع و مرحله سرطان را با افراد موجود در کل جمعیت مقایسه میکند. به عنوان مثال، اگر نرخ بقای نسبی 5 ساله برای مرحله خاصی از مولتیپل میلوما 60 درصد باشد، به این معنی است که احتمال زنده مانی افرادی که به آن سرطان مبتلا هستند برای ۵ سال پس از تشخیص ابتلا به بیماری، نسبت به افرادی که به آن سرطان مبتلا نیستند به طور متوسط حدود 60 درصد است.
این اعداد از کجا میآیند؟
انجمن سرطان آمریکا برای ارائه آمار بقای انواع مختلف سرطان به اطلاعات پایگاه داده نظارت، اپیدمیولوژی و نتایج نهایی (Surveillance, Epidemiology, and End Results یا SEER) که توسط موسسه ملی سرطان (National Cancer Institute یا NCI) نگهداری میشود، متکی است.
پایگاه داده SEER نرخ بقای نسبی 5 ساله میلوما در ایالات متحده را بر اساس میزان گسترش سرطان دنبال میکند. با این حال، پایگاه داده SEER، سرطانها را بر اساس سیستم بازبینی بین المللی مرحله بندی (مرحله 1، مرحله 2 یا مرحله 3) گروه بندی نمیکند. در عوض، سرطانها را به مراحل موضعی، منطقه ای و دور دسته بندی میکند:
- موضعی (Localized): فقط یک تومور (یک پلاسماسیتوما منفرد) در استخوان یا خارج از استخوان در حال رشد است.
- منطقه ای (Regional): این مرحله در مورد میلوما صدق نمیکند زیرا این نوع سرطان به غدد لنفاوی گسترش نمییابد.
- دور (Distant): بسیاری از تومورها در داخل یا خارج استخوانها یافت میشوند یا مولتیپل میلوما تشخیص داده شده است.
نرخ بقای نسبی 5 ساله برای میلوما
این اعداد بر اساس اطلاعات افرادی است که بین سالهای 2012 تا 2018 مبتلا به پلاسماسیتوما یا مولتیپل میلوما تشخیص داده شدها ند.
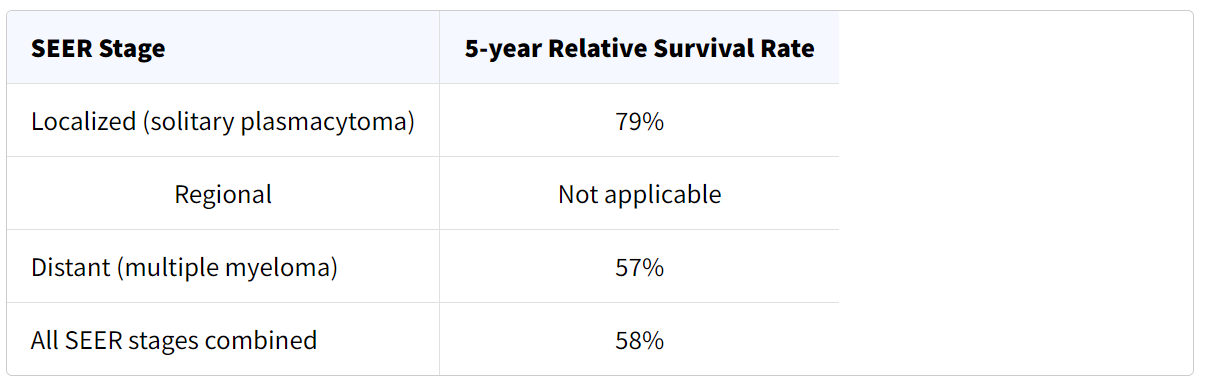
درک اعداد
- این اعداد همه چیز را در نظر نمیگیرند. میزان بقای میلوما به طور کلی بر اساس یافتن یک پلاسماسیتوما یا تشخیص مولتیپل میلوما است اما عوامل دیگری مانند سیتوژنتیک تومور (تغییرات کروموزومی)، سطح پروتئینهای خاص و سایر مواد در خون، عملکرد کلیهها، سن و سلامت کلی شما نیز میتوانند بر دیدگاه شما تأثیر بگذارند.
- افرادی که اکنون مبتلا به میلوما تشخیص داده میشوند، ممکن است چشم انداز بهتری نسبت به این اعداد داشته باشند. درمانها در طول زمان بهبود یافته اند و این اعداد بر اساس اطلاعات افرادی هستند که حداقل 5 سال زودتر تشخیص داده شده و درمان شده اند.
درمان مولتیپل میلوما
اگر مولتیپل میلوما در شما تشخیص داده شده است، تیم مراقبت از سرطان شما گزینههای درمانیتان را با شما در میان میگذارد. مهم است که در مورد هر یک از انتخابهای خود به دقت فکر کنید. مزایای هر گزینه درمانی را در مقابل خطرات و عوارض جانبی احتمالی بسنجید.
درمانهای محلی یا موضعی (Local treatments)
برخی از درمانها را درمانهای موضعی مینامند. این بدان معنی است که آنها تومور را بدون تأثیر بر بقیه بدن درمان میکنند. این درمانها بیشتر برای سرطانهای مرحله اولیه (کمتر پیشرفته) مفید هستند، اگرچه ممکن است در برخی شرایط دیگر نیز استفاده شوند.
جراحی (Surgery) برای مولتیپل میلوما
گاهی اوقات از جراحی برای برداشتن پلاسماسیتوما منفرد استفاده میشود اما به ندرت برای درمان مولتیپل میلوما مورد استفاده قرار میگیرد. زمانی که فشردگی طناب نخاعی باعث فلج، ضعف شدید عضلانی یا بی حسی شود، ممکن است به جراحی اورژانسی نیاز باشد.
جراحی برای اتصال میلهها یا صفحات فلزی میتواند به حمایت از استخوانهای ضعیف شده کمک کند و ممکن است برای پیشگیری یا درمان شکستگیها مورد نیاز باشد.
پرتو درمانی (Radiation Therapy) برای مولتیپل میلوما
پرتو درمانی از پرتوها یا ذرات پر انرژی برای از بین بردن سلولهای سرطانی استفاده میکند. رادیواکتیو ممکن است برای درمان نواحی از استخوان آسیب دیده توسط میلوما استفاده شود که به شیمی درمانی و یا سایر داروها پاسخ نداده و باعث درد میشود یا ممکن است نزدیک به شکستگی باشد. این همچنین رایج ترین درمان برای پلاسماسیتوما منفرد است.
اگر میلوما به شدت استخوانهای مهره (پشت) را ضعیف کند، این استخوانها میتوانند فرو بریزند و به نخاع و اعصاب نخاعی فشار وارد کنند. علائم عبارتند از تغییر ناگهانی در حواس (مانند بی حسی یا سوزن سوزن شدن)، ضعف ناگهانی عضلات پا یا مشکلات ناگهانی در ادرار یا حرکت رودهها. این یک وضعیت پزشکی اورژانسی است. بیمارانی که این علائم را دارند باید فوراً با پزشک خود تماس بگیرند. درمان سریع با پرتو درمانی و یا جراحی اغلب برای جلوگیری از فلج مورد نیاز است.
نوع پرتو درمانی که اغلب برای درمان مولتیپل میلوما یا پلاساسیتومای منفرد استفاده میشود، پرتو درمانی خارجی (external beam radiation therapy) نامیده میشود. تابش از دستگاهی خارج از بدن به سمت سرطان میرود. انجام پرتو درمانی بسیار شبیه به عکس برداری تشخیصی با اشعه ایکس است با این تفاوت که هر درمان طولانی تر است و دوره درمان میتواند برای چند هفته ادامه یابد.
عوارض جانبی پرتو درمانی میتواند شامل موارد زیر باشد:
- تغییرات پوستی در ناحیه تحت درمان که میتواند از قرمزی تا تاول زودن و پوسته پوسته شدن متغیر باشد.
- خستگی (Fatigue)
- حالت تهوع
- اسهال (اگر شکم یا لگن در حال درمان است)
- شمارش خون پایین
این علائم پس از پایان روند درمان بهبود مییابند.
درمانهای سیستمیک (Systemic treatments)
مولتیپل میلوما را میتوان با استفاده از داروها نیز درمان کرد که میتواند از طریق دهان مصرف شده یا مستقیماً وارد جریان خون شود. این درمانهای سیستمیک میتوانند به سلولهای سرطانی در هر نقطه از بدن برسند.
درمان دارویی برای مولتیپل میلوما
انواع مختلفی از داروها را میتوان برای درمان مولتیپل میلوما استفاده کرد.
شیمی درمانی
شیمی درمانی (Chemotherapy) استفاده از انواع خاصی از داروها است که رشد سلولهای سرطانی را از بین میبرند یا کنترل میکنند. این داروها را میتوان از طریق دهان به فرد داده یا در رگ یا عضله تزریق کرد. آنها وارد جریان خون شده و تقریباً به تمام نقاط بدن میرسند.
زمانی شیمی درمانی اغلب بخشی از درمان اصلی مولتیپل میلوما بود. از آن جایی که در سالهای اخیر انواع جدیدتری از داروها در دسترس قرار گرفته اند، شیمی درمانی در درمان میلوما اهمیت کمتری پیدا کرده است، اگرچه هنوز در برخی شرایط استفاده میشود.
داروهای شیمی درمانی که میتوانند برای درمان مولتیپل میلوما استفاده شوند، عبارتند از:
- سیکلوفسفامید (Cytoxan)
- اتوپوزید (VP-16)
- دوکسوروبیسین (Adriamycin)
- دوکسوروبیسین لیپوزومی (Doxil)
- ملفالان (Melphalan)
- بنداموستین (Treanda)
اغلب یکی از این داروها با انواع دیگر داروها مانند کورتیکواستروئیدها و داروهای تنظیم کننده ایمنی ترکیب میشود (به مباحث زیر مراجعه کنید). اگر برای پیوند سلولهای بنیادی برنامه ریزی شده باشد، اکثر پزشکان از استفاده از داروهای شیمی درمانی خاص مانند ملفالان که میتواند به مغز استخوان آسیب برساند، اجتناب میکنند.
عوارض جانبی شیمی درمانی
داروهای شیمی درمانی سلولهای سرطانی را از بین میبرند اما همچنین میتوانند به سلولهای طبیعی آسیب برسانند. آنها برای جلوگیری یا کاهش عوارض جانبی شیمی درمانی با دقت تجویز میشوند. این عوارض جانبی به نوع و دوز داروهای داده شده و مدت زمان مصرف آنها بستگی دارد. عوارض جانبی رایج شیمی درمانی عبارتند از:
- ریزش مو
- زخمهای دهانی
- از دست دادن اشتها
- تهوع و استفراغ
- اسهال یا یبوست
شیمی درمانی اغلب منجر به کاهش شمارش خون میشود که میتواند باعث موارد زیر شود:
- افزایش خطر عفونت جدی (به دلیل داشتن گلبولهای سفید بسیار کم)
- کبودی یا خونریزی آسان (به دلیل داشتن تعداد بسیار کم پلاکت خون)
- احساس خستگی یا تنگی نفس (به دلیل داشتن گلبولهای قرمز بسیار کم)
اکثر عوارض جانبی پس از پایان درمان از بین میروند.
اگر عوارض جانبی دارید، تیم مراقبت از سرطان میتواند اقداماتی را برای کاهش آنها پیشنهاد کند. به عنوان مثال، داروهایی را میتوان همراه با شیمی درمانی برای جلوگیری یا کاهش تهوع و استفراغ تجویز کرد.
در کنار این عوارض جانبی کوتاه مدت، برخی از داروهای شیمی درمانی میتوانند به طور دائمی به اندامهای خاصی مانند قلب یا کلیهها آسیب بزنند. خطرات احتمالی این داروها به دقت در برابر فواید آنها متعادل شده و عملکرد این اندامها در طول درمان به دقت کنترل میشوند. اگر آسیب جدی به اندامها وارد شود، دارویی که باعث آن شده است متوقف میشود و گاهی با داروی دیگری جایگزین میشود.
کورتیکواستروئیدها (استروئیدها)
کورتیکواستروئیدها، مانند دگزامتازون (dexamethasone) و پردنیزون (prednisone)، بخش مهمی از درمان مولتیپل میلوما هستند. آنها را میتوان به تنهایی یا همراه با سایر داروها به عنوان بخشی از درمان استفاده کرد. کورتیکواستروئیدها همچنین برای کمک به کاهش تهوع و استفراغی که ممکن است شیمی درمانی ایجاد کند، استفاده میشوند.
عوارض جانبی رایج این داروها عبارتند از:
- قند خون بالا
- افزایش اشتها و افزایش وزن
- مشکلات خواب
- تغییر در خلق و خو (برخی افراد تحریک پذیر یا “بیش از حد” این تغییرات را تجربه میکنند.)
در صورت استفاده طولانی مدت، کورتیکواستروئیدها سیستم ایمنی را نیز سرکوب میکنند. این خطر ابتلا به عفونتهای جدی را افزایش میدهد. استروئیدها همچنین میتوانند استخوانها را ضعیف کنند.
بیشتر این عوارض پس از قطع دارو به مرور زمان از بین میروند.
داروهای تعدیل کننده ایمنی (Immunomodulatory drugs یا IMiDs)
روشی که داروهای تعدیل کننده ایمنی (IMiDs) بر روی سیستم ایمنی اثر میگذارند کاملاً مشخص نیست اما این داروها اغلب در درمان مولتیپل میلوما مفید هستند.
این داروها روزانه به صورت قرص و با وقفه از درمان در روزهای خاصی در هر ماه مصرف میشوند.
این داروها ممکن است هنگام مصرف در دوران بارداری نقایص مادرزادی شدیدی ایجاد کنند، بنابراین آنها را فقط میتوان از طریق برنامه ویژه ای که توسط شرکت دارویی سازنده آنها اجرا میشود، تهیه کرد.
از آن جایی که این داروها میتوانند خطر لخته شدن خون را به طور جدی افزایش دهند، اغلب همراه با آسپرین یا رقیق کننده خون تجویز میشوند.
تالیدومید (Thalomid) اولین IMiD بود که برای درمان مولتیپل میلوما استفاده شد. عوارض جانبی تالیدومید میتواند شامل خواب آلودگی، خستگی، یبوست شدید و آسیب عصبی دردناک (نوروپاتی یا neuropathy) باشد. نوروپاتی میتواند شدید باشد و ممکن است پس از قطع دارو از بین نرود. همچنین خطر لخته شدن جدی خون که از پا شروع میشود و میتواند به ریهها برود، افزایش مییابد.
لنالیدومید (Revlimid) شبیه تالیدومید است، اگرچه عوارض جانبی کمتری دارد. این اغلب اولین IMiD است که در درمان مولتیپل میلوما استفاده میشود. شایع ترین عوارض جانبی لنالیدومید ترومبوسیتوپنی (تعداد کم پلاکت خون) و تعداد کم گلبولهای سفید خون است. همچنین میتواند باعث آسیب عصبی دردناک شود. خطر لخته شدن خون به اندازه تالیدومید بالا نیست اما همچنان افزایش مییابد.
در افرادی که میلوم آنها پس از پیوند سلولهای بنیادی یا درمان اولیه در حال بهبودی است، ممکن است لنالیدوماید برای درمان نگهدارنده برای کمک به طولانی شدن بهبودی تجویز شود.
Pomalidomide (Pomalyst) همچنین میتواند برای درمان مولتیپل میلوما استفاده شود، اغلب پس از آزمایش سایر درمانها. برخی از عوارض جانبی رایج شامل تعداد کم گلبولهای قرمز خون (کم خونی) و تعداد کم گلبولهای سفید خون است. خطر آسیب عصبی به اندازه سایر داروهای تنظیم کننده سیستم ایمنی شدید نیست اما با افزایش خطر لخته شدن خون نیز مرتبط است.
مهار کنندههای پروتئازوم (Proteasome inhibitors)
مهارکنندههای پروتئازوم با متوقف کردن کمپلکسهای آنزیمی (پروتئازومها) در سلولها از تجزیه پروتئینهای مهم برای کنترل تقسیم سلولی کار میکنند. به نظر میرسد که آنها سلولهای تومور را بیشتر از سلولهای طبیعی تحت تأثیر قرار میدهند اما بدون عوارض نیستند.
بورتزومیب (Velcade) اولین دارویی از این نوع بود که مورد تایید قرار گرفت و اغلب برای درمان مولتیپل میلوما استفاده میشود. ممکن است به ویژه در درمان بیماران میلوما با مشکلات کلیوی مفید باشد. این دارو یک یا دو بار در هفته به داخل ورید (IV) یا زیر پوست تزریق میشود.
از عوارض شایع این دارو میتوان به تهوع و استفراغ، خستگی، اسهال، یبوست، تب، کاهش اشتها و کاهش شمارش خون اشاره کرد. تعداد پلاکتها (که میتواند باعث کبودی و خونریزی راحت تر شود) و تعداد گلبولهای سفید خون (که میتواند خطر عفونت جدی را افزایش دهد) اغلب تحت تأثیر قرار میگیرند.
بورتزومیب (Bortezomib) همچنین میتواند باعث آسیب عصبی (نوروپاتی محیطی) شود که میتواند منجر به مشکلات بی حسی، گزگز یا حتی درد در دستها و پاها شود. خطر آسیب عصبی زمانی که دارو زیر پوست داده میشود، کمتر است. برخی از بیماران در حین مصرف این دارو دچار زونا (هرپس زوستر یا herpes zoster) میشوند. برای کمک به جلوگیری از این امر، ممکن است پزشک از شما بخواهد که در حین مصرف بورتزومیب، یک داروی ضد ویروسی (مانند آسیکلوویر یا acyclovir) را مصرف کنید.
در بیمارانی که میلوما پس از پیوند سلولهای بنیادی یا درمان اولیه بهبود یافته است، بورتزومیب نیز ممکن است برای درمان نگهدارنده برای طولانیتر کردن بهبودی تجویز شود.
کارفیلزومیب (Kyprolis) یک مهارکننده پروتئازوم جدیدتر است که میتواند برای درمان مولتیپل میلوما در بیمارانی که قبلاً با داروهای دیگری که مؤثر نبوده اند، درمان شده اند، استفاده شود. این دارو به صورت تزریق در ورید (IV)، اغلب در یک چرخه 4 هفته ای انجام میشود. برای جلوگیری از مشکلاتی مانند واکنشهای آلرژیک در طول انفوزیون، داروی استروئیدی دگزامتازون اغلب قبل از هر دوز در سیکل اول تجویز میشود.
عوارض جانبی شایع عبارتند از: خستگی، تهوع و استفراغ، اسهال، تنگی نفس، تب و شمارش خون پایین. شمارش خونی که بیشتر تحت تاثیر قرار میگیرد، شمارش پلاکتها (که میتواند باعث کبودی و خونریزی راحت تر شود) و تعداد گلبولهای قرمز خون (که میتواند منجر به خستگی، تنگی نفس و رنگ پریدگی شود) است. افرادی که از این دارو استفاده میکنند نیز میتوانند مشکلات جدی تری مانند ذات الریه، مشکلات قلبی و نارسایی کلیه یا کبد داشته باشند.
ایکسازومیب (Ninlaro) یک مهارکننده پروتئازوم است که یک کپسول خوراکی است که معمولاً یک بار در هفته به مدت 3 هفته و سپس یک هفته تعطیل میشود. این دارو معمولاً پس از آزمایش سایر داروها تجویز میشود.
عوارض جانبی شایع این دارو عبارتند از: تهوع و استفراغ، اسهال، یبوست، تورم در دست یا پا، کمردرد و کاهش تعداد پلاکت خون (که میتواند باعث کبودی و خونریزی راحت تر شود). این دارو همچنین میتواند باعث آسیب عصبی (نوروپاتی محیطی) شود که میتواند منجر به مشکلات بی حسی، گزگز یا حتی درد در دستها و پاها شود.
آنتی بادیهای مونوکلونال (Monoclonal antibodies)
آنتی بادیها پروتئینهایی هستند که توسط سیستم ایمنی بدن برای کمک به مبارزه با عفونتها ساخته میشوند.
نسخههای ساخته شده توسط انسان (آنتی بادیهای مونوکلونال) را میتوان برای حمله به یک هدف خاص، مانند پروتئینهای روی سطح سلولهای میلوما، طراحی کرد.
آنتی بادی علیه CD38
داراتوموماب (Darzalex) یک آنتی بادی مونوکلونال است که به پروتئین CD38 که روی سلولهای میلوما یافت میشود، میچسبد. تصور میشود که این کار هم مستقیماً سلولهای سرطانی را میکشد و هم به سیستم ایمنی کمک میکند تا به آنها حمله کند. این دارو عمدتاً در ترکیب با انواع دیگر داروها استفاده میشود، اگرچه میتواند به تنهایی در بیمارانی که قبلاً چندین درمان دیگر برای میلوم خود داشته اند نیز استفاده شود.
این دارو اغلب به صورت انفوزیون داخل ورید (IV) داده میشود. شکل جدیدتری از دارو، معروف به داراتوموماب و هیالورونیداز (Darzalex Faspro)، میتواند به صورت تزریق زیر جلدی (زیر پوستی)، معمولاً در ناحیه شکم در طی چند دقیقه انجام شود.
هر یک از انواع این دارو میتواند در برخی از افراد در حین تجویز یا طی چند ساعت پس از آن واکنش ایجاد کند که گاهی اوقات میتواند شدید باشد. علائم میتواند شامل سرفه، خس خس سینه، مشکل در تنفس، گرفتگی در گلو، آبریزش یا گرفتگی بینی، احساس سرگیجه یا سبکی سر، سردرد، بثورات پوستی و حالت تهوع باشد.
سایر عوارض جانبی میتواند شامل خستگی، حالت تهوع، کمردرد، تب و سرفه باشد. این دارو همچنین میتواند تعداد سلولهای خونی را کاهش دهد که میتواند خطر عفونت و خونریزی یا کبودی را افزایش دهد. Darzalex Faspro همچنین میتواند باعث ایجاد واکنشهایی مانند تورم، خارش و قرمزی در محل تزریق شود.
ایزاتوکسیماب (Sarclisa) آنتی بادی مونوکلونال دیگری است که به پروتئین CD38 روی سلولهای میلوما میچسبد. تصور میشود که این کار هم مستقیماً سلولهای سرطانی را میکشد و هم به سیستم ایمنی کمک میکند تا به آنها حمله کند. این دارو همراه با انواع دیگر داروهای میلوما، معمولاً پس از انجام حداقل 2 روش درمانی دیگر استفاده میشود. به صورت تزریق داخل ورید (IV) داده میشود.
این دارو میتواند در برخی افراد در حین مصرف یا در عرض چند ساعت پس از آن واکنش ایجاد کند که گاهی اوقات میتواند شدید باشد. علائم میتواند شامل سرفه، خس خس سینه، مشکل در تنفس، گرفتگی در گلو، لرز، احساس سرگیجه یا سبکی سر، سردرد، بثورات پوستی و حالت تهوع باشد.
شایع ترین عوارض جانبی این دارو شامل عفونتهای تنفسی (مانند سرما خوردگی یا ذات الریه) و اسهال است. این دارو همچنین میتواند تعداد سلولهای خونی را کاهش دهد:
- داشتن گلبولهای سفید بسیار کم میتواند خطر ابتلا به عفونتها را افزایش دهد.
- داشتن گلبولهای قرمز بسیار کم (کم خونی) میتواند باعث احساس خستگی و ضعف شود.
- داشتن تعداد بسیار کم پلاکت خون میتواند خطر خونریزی و کبودی را به راحتی افزایش دهد.
این دارو همچنین ممکن است خطر ابتلا به سرطان دوم را افزایش دهد.
آنتی بادی علیه SLAMF7
الوتوزوماب (Empliciti) یک آنتی بادی مونوکلونال است که به پروتئین SLAMF7 که روی سلولهای میلوما یافت میشود، میچسبد. تصور میشود که این به سیستم ایمنی کمک میکند تا به سلولهای سرطانی حمله کند. این دارو عمدتاً در بیمارانی استفاده میشود که قبلاً درمانهای دیگری برای میلوم خود داشته اند. به صورت تزریق داخل ورید (IV) داده میشود.
این دارو میتواند در برخی از افراد در حین مصرف یا طی چند ساعت پس از آن واکنش ایجاد کند که گاهی اوقات میتواند شدید باشد. علائم میتواند شامل تب، لرز، احساس سرگیجه یا سبکی سر، بثورات پوستی، خس خس سینه، مشکل در تنفس، گرفتگی در گلو، یا آبریزش یا گرفتگی بینی باشد.
سایر عوارض جانبی رایج این دارو عبارتند از: خستگی، تب، از دست دادن اشتها، اسهال، یبوست، سرفه، آسیب عصبی که منجر به ضعف یا بی حسی در دستها و پاها (نوروپاتی محیطی)، عفونتهای دستگاه تنفسی فوقانی و ذات الریه میشود.
درگیر کنندههای سلولهای T Bispecific (BiTEs)
برخی از آنتی بادیهای جدیدتر ساخته دست بشر برای اتصال به دو هدف مختلف طراحی شده اند. اینها به عنوان آنتی بادیهای دو اختصاصی (bispecific antibodies) شناخته میشوند.
به عنوان مثال میتوان به درگیر کنندههای سلولهای T (BiTEs) اشاره کرد که هنگامی که در بدن قرار میگیرند، بخشی از این آنتی بادیها به پروتئین CD3 روی سلولهای ایمنی به نام سلولهای T میچسبند. بخشی دیگر به پروتئین خاصی روی سلولهای میلوما میچسبد. این دو سلول را به هم نزدیک میکند که به سیستم ایمنی کمک میکند تا به سلولهای سرطانی حمله کند.
این داروها میتوانند گزینه ای برای درمان مولتیپل میلوما باشند، معمولاً پس از آزمایش چندین نوع داروی دیگر.
برای درمان مولتیپل میلوما میتوان از چندین BiTE استفاده کرد:
Teclistamab (Tecvayli) به پروتئین BCMA روی سلولهای میلوما میچسبد. این دارو به صورت انفوزیون داخل ورید (IV)، معمولاً هر چند روز یک بار در هفته اول و سپس یک بار در هفته تجویز میشود.
Elrenatamab (Elrexfio) نیز به پروتئین BCMA میچسبد. این دارو به صورت تزریق زیر پوستی (زیر جلدی)، معمولاً هر چند روز یک بار در هفته اول، سپس یک بار در هفته برای چند ماه و سپس هر 2 هفته یک بار تزریق میشود.
Talquetamab (Talvey) به پروتئین GPRC5D روی سلولهای میلوما (و برخی سلولهای دیگر) میچسبد. این دارو به صورت تزریق زیر پوستی (زیر جلدی)، معمولاً هر چند روز یک بار در هفته اول، سپس یک بار در هفته یا یک بار در هفته تجویز میشود.
از آن جایی که این داروها در ابتدا میتوانند عوارض جانبی جدی ایجاد کنند (به مباحث زیر مراجعه کنید)، با دوز پایین شروع میشود و ممکن است داروهای دیگری برای کمک به کاهش خطر عوارض جانبی به شما داده شود.
ممکن است لازم باشد یک یا دو روز پس از چند دوز اول در بیمارستان بمانید.
عوارض جانبی رایج این داروها عبارتند از:
- تب
- احساس خستگی بسیار
- سردرد
- حالت تهوع
- اسهال
- درد عضلات و مفاصل
- عفونتهای تنفسی (از جمله ذات الریه)
- تعداد کم سلولهای خونی
- بثورات پوستی
- مشکلات کبدی
این داروها همچنین میتوانند عوارض جانبی جدی تری ایجاد کنند، از جمله:
سندرم آزاد سازی سایتوکاین (Cytokine release syndrome یا CRS): این یک عارضه جانبی جدی است که در آن سلولهای T در بدن مواد شیمیایی (سایتوکاینها) را آزاد میکنند که سیستم ایمنی را تقویت میکنند. این اغلب در روز اول پس از درمان اتفاق میافتد و میتواند تهدید کننده زندگی باشد. علائم میتواند شامل تب و لرز بالا، احساس سرگیجه یا سبکی سر، مشکل در تنفس، فشار خون پایین، سردرد و ضربان قلب بسیار سریع باشد.
مشکلات سیستم عصبی: این داروها ممکن است بر سیستم عصبی تأثیر بگذارند که میتواند منجر به علائمی مانند سردرد، بی حسی یا گزگز در دستها یا پاها، احساس سرگیجه یا گیجی، مشکل در صحبت کردن یا درک چیزها، از دست دادن حافظه، الگوهای خواب غیرطبیعی، لرزش یا تشنج شود.
تیم مراقبتهای بهداشتی شما را از نزدیک برای علائم احتمالی CRS و مشکلات سیستم عصبی، به ویژه در طول و بعد از چند دوره درمانی اول، تحت نظر خواهند داشت. در صورت مشاهده هر یک از علائم بالا، حتماً فوراً با تیم مراقبتهای بهداشتی خود تماس بگیرید.
این داروها ممکن است علائم دیگری نیز ایجاد کنند. از تیم مراقبتهای بهداشتی خود بپرسید که باید مراقب چه چیزهایی باشید.
بازدارنده صادرات هسته ای (Nuclear export inhibitor)
هسته یک سلول بیشتر مواد ژنتیکی سلول (DNA) مورد نیاز برای ساخت پروتئینهایی را که سلول برای عملکرد و زنده ماندن استفاده میکند، در خود جای میدهد. پروتئینی به نام XPO1 به حمل پروتئینهای دیگر از هسته به قسمتهای دیگر سلول کمک میکند.
سلینکسور (Xpovio) دارویی است که به عنوان بازدارنده صادرات هسته ای شناخته میشود. با مسدود کردن پروتئین XPO1 کار میکند. هنگامی که سلول میلوما نتواند پروتئینها را از هسته خود منتقل کند، سلول میمیرد.
این دارو با دگزامتازون استفاده میشود:
- برای افرادی که میلوما با حداقل چندین داروی دیگر میلوما درمان شده و دیگر به آنها پاسخ نمیدهد، یا
- همراه با بورتزومیب برای بزرگسالانی که میلوم آنها در حداقل یک درمان دارویی دیگر رشد کرده است.
این دارو قرصی است که میتوان آن را در روز اول و سوم هر هفته یا هر دو هفته مصرف کرد.
عوارض جانبی رایج عبارتند از: تعداد کم پلاکتها، تعداد کم گلبولهای سفید خون، اسهال، تهوع، استفراغ، عدم احساس گرسنگی، کاهش وزن، سطح پایین سدیم خون و عفونتهایی مانند برونشیت یا ذات الریه.
استفاده از این داروها با هم برای درمان مولتیپل میلوما
اگرچه ممکن است از یک دارو برای درمان مولتیپل میلوما استفاده شود اما اغلب ترجیح داده میشود که حداقل از 2 یا 3 نوع دارو به صورت ترکیبی استفاده شود زیرا سرطان تمایل به پاسخ بهتری دارد. نمونههایی از ترکیباتی که ممکن است استفاده شوند عبارتند از:
- لنالیدومید (یا پومالیدومید یا تالیدومید) و دگزامتازون
- کارفیلزومیب (یا ایکسازومیب یا بورتزومیب)، لنالیدومید و دگزامتازون
- بورتزومیب (یا کارفیلزومیب)، سیکلوفسفامید و دگزامتازون
- الوتوزوماب (یا داراتوموماب)، لنالیدومید و دگزامتازون
- بورتزومیب، لیپوزومال دوکسوروبیسین و دگزامتازون
- الوتوزوماب، بورتزومیب و دگزامتازون
- ملفالان و پردنیزون (MP)، با تالیدومید یا بورتزومیب یا بدون آنها
- وین کریستین، دوکسوروبیسین (آدریامایسین) و دگزامتازون (به نام VAD)
- دگزامتازون، سیکلوفسفامید، اتوپوزید و سیس پلاتین (به نام DCEP)
- دگزامتازون، تالیدومید، سیس پلاتین، دوکسوروبیسین، سیکلوفسفامید و اتوپوزید (به نام DT-PACE)، با بورتزومیب یا بدون آن
- سلینکسور، بورتزومیب، دگزامتازون
انتخاب و دوز درمان دارویی به عوامل زیادی از جمله مرحله سرطان و سن فرد، عملکرد کلیه و سلامت کلی بستگی دارد. اگر برای پیوند سلولهای بنیادی برنامه ریزی شده باشد، اکثر پزشکان از استفاده از داروهای خاصی مانند ملفالان که میتواند به مغز استخوان آسیب برساند، اجتناب میکنند.
بیس فسفوناتها (Bisphosphonates) برای بیماریهای استخوانی
سلولهای میلوما میتوانند استخوانها را ضعیف کرده و حتی بشکنند. داروهایی به نام بیس فسفوناتها (Bisphosphonates) میتوانند با کند کردن این روند استخوانها را قوی نگه دارند. آنها همچنین میتوانند به کاهش درد در استخوان(های) ضعیف شده کمک کنند. گاهی اوقات، داروهای ضد درد مانند NSAIDها یا داروهای مخدر همراه با بیس فسفوناتها برای کمک به کنترل یا کاهش درد تجویز میشود. درد استخوان میتواند یک علامت دشوار برای درمان در طول و بعد از درمان میلوما باشد.
داروهایی که اغلب برای درمان مشکلات استخوانی در افراد مبتلا به میلوما استفاده میشود، بیس فسفوناتهای پامیدرونات (Aredia) و زولدرونیک اسید (Zometa) و داروی دنوزوماب (Xgeva، Prolia) هستند.
این داروها به صورت داخل وریدی (IV یا ورید) یا زیر جلدی (زیر پوستی) تجویز میشوند. اکثر بیماران در ابتدا یک بار در ماه تحت درمان قرار میگیرند اما ممکن است بعداً اگر خوب عمل کنند، کمتر تحت درمان قرار میگیرند. درمان با یکی از این داروها به جلوگیری از آسیب بیشتر استخوان و حوادث مرتبط با استخوانهای ضعیف مانند شکستگی، هیپرکلسمی (سطح کلسیم بالا) و فشرده سازی نخاع در بیماران مولتیپل میلوما کمک میکند.
این درمانها میتوانند یک عارضه جانبی نادر اما جدی به نام استئونکروز فک (osteonecrosis of the jaw یا ONJ) داشته باشند. بیماران از درد شکایت دارند و پزشکان متوجه میشوند که بخشی از استخوان فک مرده است. این میتواند منجر به زخم باز شود که بهبود نمییابد. همچنین میتواند منجر به از دست دادن دندان در آن ناحیه شود.
استخوان فک نیز ممکن است عفونی شود. پزشکان مطمئن نیستند که چرا این اتفاق میافتد یا بهترین روش پیشگیری از آن چیست اما انجام جراحی فک یا برداشتن دندان میتواند باعث ایجاد این مشکل شود. در حین مصرف هر یک از این داروها از انجام این روشها خودداری کنید.
یکی از راههای اجتناب از این روشهای دندانپزشکی، رعایت بهداشت دهان و دندان با نخ دندان کشیدن، مسواک زدن، اطمینان از تناسب مناسب دندانهای مصنوعی و انجام معاینات منظم دندان پزشکی است. هر گونه عفونت دندان یا لثه باید فوراً درمان شود. (به نظر نمیرسد پرکردن دندان، روشهای کانال ریشه و تاج دندان منجر به ONJ شود.) اگر ONJ رخ دهد، پزشک داروی استخوان را متوقف میکند.
پزشک ممکن است توصیه کند که قبل از شروع درمان، معاینه دندانپزشکی انجام دهید. به این ترتیب، هر گونه مشکل دندانی را میتوان قبل از شروع دارو برطرف کرد. آنها همچنین ممکن است مصرف مکملهای کلسیم و ویتامین D را در حین مصرف دارو برای کمک به استخوان سازی بدن شما توصیه کنند.
پیوند سلولهای بنیادی (Stem Cell Transplant) برای مولتیپل میلوما
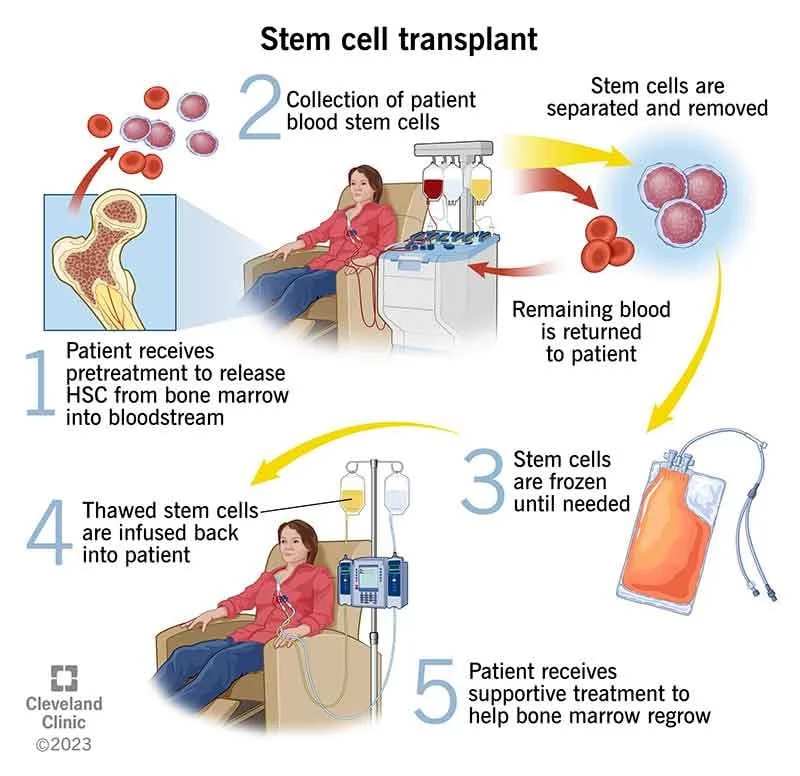
در پیوند سلولهای بنیادی، بیمار شیمی درمانی با دوز بالا دریافت میکند تا سلولهای مغز استخوان را از بین ببرد. سپس بیمار سلولهای بنیادی خون ساز جدید و سالم را دریافت میکند. هنگامی که پیوند سلولهای بنیادی برای اولین بار توسعه یافت، سلولهای بنیادی جدید از مغز استخوان به دست آمدند و بنابراین این پیوند به عنوان پیوند مغز استخوان شناخته شد. در حال حاضر، سلولهای بنیادی اغلب از خون (پیوند سلولهای بنیادی خون محیطی یا peripheral blood stem cell transplant) جمع آوری میشوند.
پیوند سلولهای بنیادی معمولا برای درمان مولتیپل میلوما استفاده میشود. قبل از پیوند، از درمان دارویی برای کاهش تعداد سلولهای میلوما در بدن بیمار استفاده میشود. (به مبحث درمان دارویی برای مولتیپل میلوما مراجعه کنید).
پیوند سلولهای بنیادی (SCT) میتواند اتولوگ یا آلوژنیک باشد.
پیوند اتولوگ (Autologous transplants)
برای پیوند سلولهای بنیادی اتولوگ، سلولهای بنیادی خود بیمار قبل از پیوند از مغز استخوان یا خون محیطی خارج میشوند. سلولها تا زمانی که برای پیوند مورد نیاز باشند، ذخیره میشوند. سپس، فرد مبتلا به میلوما تحت درمانهایی مانند شیمی درمانی با دوز بالا، گاهی اوقات با پرتو، برای از بین بردن سلولهای سرطانی قرار میگیرد. وقتی این کار کامل شد، سلولهای بنیادی ذخیره شده آنها از طریق ورید به خون آنها بازگردانده میشوند.
این نوع پیوند یک درمان استاندارد برای بیماران مبتلا به مولتیپل میلوما است. اگرچه پیوند اتولوگ میتواند باعث از بین رفتن میلوما برای مدتی (حتی سالها) شود اما سرطان را درمان نمیکند و اغلب میلوما عود میکند.
برخی از پزشکان توصیه میکنند که بیماران مبتلا به مولتیپل میلوما 2 پیوند اتولوگ با فاصله 6 تا 12 ماه انجام دهند. این روش پیوند پشت سر هم (tandem transplant) نامیده میشود. مطالعات نشان میدهد که این ممکن است به برخی از بیماران بیش از یک پیوند کمک کند. اشکال این است که عوارض جانبی بیشتری ایجاد میکند و در نتیجه میتواند خطرناک تر باشد.
پیوندهای آلوژنیک (Allogeneic transplants)
در پیوند سلولهای بنیادی آلوژنیک، بیمار سلولهای بنیادی خونساز را از فرد دیگری – اهداکننده – دریافت میکند. بهترین نتایج درمانی زمانی اتفاق میافتد که سلولهای اهدا کننده کاملاً با نوع سلول بیمار مطابقت داشته باشند و اهدا کننده ارتباط نزدیکی با بیمار، مانند برادر یا خواهر، داشته باشد.
پیوند آلوژنیک بسیار خطرناک تر از پیوند اتولوگ است اما ممکن است در مبارزه با سرطان بهتر باشد. به این دلیل که سلولهای پیوندی (اهدا کننده) ممکن است در واقع به تخریب سلولهای میلوما کمک کنند. این اثر پیوند در برابر تومور (graft vs. tumor effect) نامیده میشود.
در مطالعات انجام شده بر روی بیماران مولتیپل میلوما، افرادی که پیوند آلوژنیک دریافت کردند، اغلب در کوتاه مدت نسبت به افرادی که پیوند اتولوگ دریافت کردند، عملکرد بدتری داشتند. در این زمان، پیوند آلوژنیک به عنوان یک درمان استاندارد برای میلوما در نظر گرفته نمیشود اما ممکن است به عنوان بخشی از یک کارآزمایی بالینی انجام شود.
اثرات جانبی
عوارض جانبی اولیه پیوند سلولهای بنیادی (SCT) مشابه عوارض شیمی درمانی و پرتو درمانی است و فقط شدیدتر است. یکی از جدی ترین عوارض جانبی کاهش شمارش خون است که میتواند منجر به خطرات عفونتهای جدی و خونریزی شود.
جدی ترین عارضه جانبی پیوند آلوژنیک بیماری پیوند در مقابل میزبان (یا GVHD) است. این زمانی اتفاق میافتد که سلولهای ایمنی جدید (از اهدا کننده) بافتهای بیمار را خارجی ببینند و به آنها حمله کنند. GVHD میتواند هر بخشی از بدن را تحت تاثیر قرار دهد و میتواند تهدید کننده زندگی باشد.
CAR T-cell درمانی برای مولتیپل میلوما
گیرنده آنتی ژن کایمریک (Chimeric antigen receptor یا CAR) سلول T یک نوع ایمونوتراپی سرطان است. این به سیستم ایمنی بدن خود کمک میکند تا سلولهای سرطانی را پیدا کرده و به آنها حمله کند. همچنین گاهی اوقات از درمان با سلول T CAR به عنوان یک نوع ژن درمانی مبتنی بر سلول صحبت میشود زیرا شامل تغییر ژنهای داخل سلولهای ایمنی خاص برای کمک به آنها برای حمله به سرطان است.
برای انجام این درمان، سلولهای ایمنی به نام سلولهای T طی فرآیندی به نام لوکفرزیس (leukapheresis) از خون فرد گرفته میشوند. خون از طریق یک خط IV خارج میشود و به دستگاهی میرود که سلولهای T را خارج میکند. سپس خون باقی مانده به بدن باز میگردد. این فرآیند معمولاً چند ساعت طول میکشد و ممکن است نیاز به تکرار داشته باشد.
سلولهای T سپس منجمد شده و به آزمایشگاه فرستاده میشوند، جایی که از نظر ژنتیکی تغییر مییابند تا گیرندههای خاصی (به نام گیرندههای آنتی ژن کایمریک یا CAR) را روی سطح خود داشته باشند.
این گیرندهها به سلولهای T کمک میکنند تا به پروتئینهای روی سلولهای سرطانی بچسبند. سلولهای T سپس در آزمایشگاه تکثیر میشوند که معمولاً چندین هفته طول میکشد.
هنگامی که سلولهای CAR T آماده شدند، بیمار برای چند روز شیمی درمانی میشود تا به آماده سازی بدن کمک کند. سپس سلولهای CAR T دوباره به خون بیمار تزریق میشوند، جایی که میتوانند سلولهای سرطانی را جستجو کنند و به سیستم ایمنی کمک کنند تا به آنها حمله کند.
سلولهای CAR T برای مولتیپل میلوما
Idecabtagene vicleucel (ide-cel, Abecma) و ciltacabtagene autoleucel (cilta-cel, Carvykti) درمانهای CAR T-cell هستند که پروتئین BCMA را که در سلولهای میلوما یافت میشود، هدف قرار میدهند. هر یک از این درمانها را میتوان در بیمارانی که قبلاً چندین نوع درمان دیگر (معمولاً حداقل 4) برای مولتیپل میلوم خود دریافت کرده اند، استفاده کرد.
عوارض جانبی احتمالی
این درمانها میتوانند عوارض جانبی جدی یا حتی تهدید کننده زندگی داشته باشند، بنابراین باید در یک مرکز پزشکی که آموزشهای ویژهای برای استفاده از آنها دیده است، انجام شوند. تیم مراقبتهای بهداشتی شما تا چند هفته پس از دریافت سلولهای CAR T شما را از نزدیک زیر نظر خواهند داشت.
سندرم آزادسازی سایتوکاین (CRS): CRS زمانی رخ میدهد که سلولهای T مواد شیمیایی (سایتوکاینها) را آزاد کنند که سیستم ایمنی را تقویت میکند. CRS اغلب در عرض چند روز تا چند هفته پس از درمان رخ میدهد و در برخی موارد میتواند تهدید کننده زندگی باشد. علائم میتواند شامل موارد زیر باشد:
- تب و لرز بالا
- مشکل در تنفس
- تهوع، استفراغ و یا اسهال شدید
- احساس سرگیجه یا سبکی سر
- سردرد
- ضربان قلب سریع
- احساس خستگی بسیار
مشکلات سیستم عصبی: این درمان گاهی اوقات میتواند اثرات جدی بر روی سیستم عصبی داشته باشد که میتواند منجر به علائمی مانند موارد زیر گردد:
- سردرد
- تغییرات در هوشیاری
- سردرگمی یا آشفتگی
- تشنج
- لرزش یا تکان دادن (لرزش)
- مشکل در صحبت کردن و درک کردن
- از دست دادن تعادل
به دلیل خطر این عوارض جانبی، به شما توصیه میشود حداقل تا 8 هفته پس از درمان، رانندگی نکنید، با ماشین آلات سنگین کار نکنید یا فعالیتهای بالقوه خطرناک دیگری انجام ندهید.
سایر عوارض جانبی جدی: سایر عوارض جانبی جدی ممکن است شامل موارد زیر باشند:
- واکنشهای آلرژیک در حین انفوزیون (تزریق)
- سیستم ایمنی ضعیف
- افزایش خطر عفونتهای جدی
- تعداد کم سلولهای خونی که میتواند خطر عفونت، خستگی و کبودی یا خونریزی را افزایش دهد.
بسیار مهم است که هر گونه عوارض جانبی را فوراً به تیم مراقبتهای بهداشتی خود گزارش دهید زیرا اغلب داروهایی وجود دارند که میتوانند به درمان آنها کمک کنند.
درمانهای حمایتی (Supportive Treatments) برای بیماران مبتلا به مولتیپل میلوما
هدف درمان حمایتی به جای تلاش برای درمان سرطان، پیشگیری یا تسکین علائم است. هدف اصلی این نوع درمان، بهبود آسایش و کیفیت زندگی برای فردی است که مبتلا به سرطان تشخیص داده شده است بدون توجه به مرحله سرطان یا هدف درمان. همچنین ممکن است مراقبتهای حمایتی (supportive care) را بشنوید که تحت عنوان مراقبت تسکینی (palliative care)، مدیریت علائم یا مراقبت راحتی (comfort care) شناخته میشود.
ایمونوگلوبولین داخل وریدی (Intravenous immunoglobulin یا IVIG)
بیماران مبتلا به مولتیپل میلوما اغلب سطوح پایینی از آنتی بادیهای طبیعی (ایمونوگلوبولینها) مورد نیاز برای مبارزه با عفونت دارند. این میتواند منجر به مشکلات عفونت ریه و یا سینوس شود که مدام عود میکند.
سطح آنتی بادیها در خون بیمار قابل آزمایش است و اگر پایین باشد، آنتیبادیهای اهدا کنندگان را میتوان به داخل ورید (IV) تزریق کرد تا سطح آن را افزایش داده و از عفونت جلوگیری کند. آنتی بادیهای داده شده IVIG یا ایمونوگلوبولین داخل وریدی نامیده میشوند. IVIG اغلب در ابتدا یک بار در ماه تجویز میشود اما ممکن است بر اساس آزمایشهای خونی سطح آنتی بادی کمتر بتوان آن را تجویز کرد.
درمان کاهش تعداد سلولهای خونی
برخی از بیماران به دلیل مولتیپل میلوما یا درمان آن دچار کاهش تعداد گلبولهای قرمز خون (کم خونی) میشوند. ممکن است هنگام راه رفتن احساس خستگی، سبکی سر یا تنگی نفس کنند. کم خونی که باعث علائم میشود را میتوان با تزریق خون درمان کرد. اینها اغلب به صورت سرپایی داده میشوند.
Epoetin (Procrit) و Darbepoetin (Aranesp) داروهایی هستند که میتوانند به بهبود تعداد گلبولهای قرمز خون و کاهش نیاز به انتقال خون در برخی از بیمارانی که شیمی درمانی میشوند، کمک کنند اما این داروها بسیار کمتر مورد استفاده قرار میگیرند زیرا با بقای ضعیفتر در برخی از بیماران مبتلا به سرطانهای لنفوئیدی مانند مولتیپل میلوما مرتبط است.
پلاسمافرزیس (Plasmapheresis)
پلاسمافرزیس میتواند برای حذف پروتئین میلوما از خون استفاده شود. زمانی مفید است که پروتئینهای میلوم خاصی ساخته میشوند، خون را غلیظ کرده و در گردش خون اختلال ایجاد میکنند (به نام هیپر ویسکوزیته).
اغلب این روش از طریق یک کاتتر (لوله یا catheter) بزرگ که در ورید گردن، زیر استخوان ترقوه یا کشاله ران قرار میگیرد، انجام میشود. این کاتتر به دستگاه متصل میشود و خون به داخل دستگاه جریان مییابد. این دستگاه سلولهای خون را از پلاسمای خون (بخش مایع خون) جدا میکند و سپس سلولهای خون را همراه با محلول نمک یا پلاسمای اهدا کننده به بیمار برمیگرداند. پلاسمای حذف شده که حاوی پروتئین آنتی بادی غیرطبیعی ساخته شده توسط سلولهای میلوما است، دور ریخته میشود.
اگرچه پلاسمافرزیس سطح غیر طبیعی پروتئین را کاهش میدهد و میتواند علائم را برای مدتی تسکین دهد اما سلولهای میلوما را از بین نمیبرد. این بدان معناست که بدون درمان بیشتر، پروتئین دوباره ساخته میشود. به همین دلیل، پلاسمافرزیس اغلب با شیمی درمانی یا نوعی درمان دارویی دیگر برای از بین بردن سلولهای سازنده پروتئین دنبال میشود.
رویکردهای درمانی رایج
بسته به مرحله سرطان، اینکه آیا شما کاندید پیوند سلولهای بنیادی هستید یا نه و سایر عوامل، انواع مختلف درمان ممکن است به طور همزمان ترکیب شده یا پشت سر هم استفاده شوند.
گزینههای درمانی برای مولتیپل میلوما و سایر اختلالات سلولهای پلاسما
پلاسماسیتوماهای منفرد
اینها اغلب با پرتو درمانی درمان میشوند. اگر تومور پلاسماسل در استخوان نباشد، ممکن است با جراحی برداشته شود. شیمی درمانی (chemo) تنها در صورت ایجاد مولتیپل میلوما استفاده میشود.
مولتیپل میلوما اسمولدرینگ
بیماران میلوما اسمولدرینگ میتوانند سالها بدون درمان خوب عمل کنند. به نظر نمیرسد که برای بسیاری از بیماران، شروع زود هنگام درمان کمکی به طول عمر بیشتر آنها کند. این بیماران بدون شروع شیمی درمانی یا سایر درمانهای میلوما به دقت تحت نظر قرار میگیرند.
بر اساس میزان غیر طبیعی بودن سلولهای پلاسما در زیر میکروسکوپ و سطوح ایمونوگلوبولینها، برخی از بیماران مبتلا به مولتیپل میلوما اسمولدرینگ در معرض خطر بالایی برای پیشرفت به میلوم فعال هستند. در یک مطالعه، درمان این بیماران با لنالیدومید (Revlimid) و دگزامتازون قبل از بروز علائم یا مشکلات به آنها کمک کرد تا عمر طولانیتری داشته باشند.
میلوم فعال (علامت دار)
به بیماران مبتلا به میلوم فعال یا آمیلوئیدوز با زنجیره سبک اغلب ترکیبی از 2 یا 3 دارو داده میشود. داروهای انتخاب شده به سلامت بیمار (از جمله عملکرد کلیه آنها) و این که آیا پیوند سلولهای بنیادی برنامه ریزی شده است یا خیر، بستگی دارد.
اغلب، ترکیبی حاوی بورتزومیب، لنالیدومید و دگزامتازون استفاده میشود. ترکیبات حاوی بورتزومیب به ویژه در بیماران مبتلا به مشکلات کلیوی و کسانی که سلولهای میلوما حاوی برخی از ناهنجاریهای کروموزومی پرخطر هستند، مفید است.
بسیاری از ترکیبات دیگر نیز ممکن است در نظر گرفته شوند. اگر یک ترکیب دارویی از کار بیفتد (یا میلوما عود کند)، میتوان داروهای دیگر را امتحان کرد. برای اطلاعات بیشتر در مورد این داروها و برخی از ترکیبات رایج تر مورد استفاده، به مبحث درمان دارویی برای مولتیپل میلوما مراجعه کنید.
درمان بیماری استخوان (بیس فسفوناتها) اغلب همراه با شیمی درمانی آغاز میشود. اگر نواحی استخوان آسیب دیده همچنان علائم ایجاد کنند، ممکن است از پرتو درمانی استفاده شود.
بیماران مبتلا به مولتیپل میلوما نیز درمانهای حمایتی مانند تزریق خون برای درمان تعداد کم سلولهای خونی و آنتیبیوتیک و گاهی ایمونوگلوبولین داخل وریدی (IVIG) برای عفونتها را دریافت میکنند.
پیوند سلولهای بنیادی ممکن است بخشی از روند درمان باشد. گزینههای پیوند سلولهای بنیادی در مبحث پیوند سلولهای بنیادی برای مولتیپل میلوما مورد بحث قرار گرفته است.
به برخی از بیماران پس از پیوند، چرخههای درمانی اضافی داده میشود. این درمان تثبیتی (consolidation treatment) نامیده میشود و شانس پاسخ کامل را افزایش میدهد (که در آن همه علائم و نشانههای بیماری از بین میروند).
برخی از بیماران (حتی برخی که پیوند سلولهای بنیادی نداشته اند) ممکن است تحت درمان طولانی مدت با لنالیدومید یا بورتزومیب قرار گیرند. این به عنوان درمان نگهدارنده (maintenance treatment) شناخته میشود. این روش میتواند به تاخیر در بازگشت میلوما کمک کند اما همچنین میتواند در برخی افراد عوارض جانبی جدی ایجاد کند.
درمان با سلول T CAR ممکن است گزینه درمانی دیگری برای برخی افراد باشد، به خصوص اگر چندین درمان دیگر قبلاً امتحان شده باشد. این درمان به سیستم ایمنی بدن کمک میکند تا به سلولهای سرطانی حمله کند. در حالی که میتواند برای بسیاری از افراد بسیار موثر باشد، میتواند عوارض جانبی بسیار جدی نیز ایجاد کند.
اگر درمانهای سرطان از کار بیفتند
درمانهای سرطان میتواند به جلوگیری از رشد یا گسترش سرطان کمک کند اما گاهی اوقات درمان به خوبی جواب نمیدهد یا از کار میافتد.
شاید مدتی پیش درمان به پایان رسیده و در ابتدا موفقیت آمیز باشد اما سرطان برگشته است یا شاید یکی از انواع درمان سرطان از کار افتاده باشد و سرطان به رشد خود ادامه دهد. اگر این اتفاق بیفتد، پزشک ممکن است بگوید سرطان شما پیشرفت کرده است. ممکن است گزینههای درمانی دیگری وجود داشته باشد یا نباشد اما زمانی که بسیاری از درمانهای مختلف آزمایش شده اند و دیگر سرطان را کنترل نمیکنند، زمان آن رسیده است که مزایا و خطرات ادامه آزمایش درمانهای جدید را بسنجیم.
تصمیم گیری برای ادامه درمان سرطان
در اینجا نکاتی وجود دارد که باید هنگام تصمیم گیری برای ادامه درمان سرطان در نظر بگیرید:
به تیم مراقبت از سرطان خود اعتماد کنید
صحبت با پزشک و تیم مراقبت از سرطان خود و اعتماد به آنها برای صادق بودن، باز بودن و حمایت کردن، بسیار مهم است. اگر به پزشکانی که مواردی را به شما توصیه میکنند، اعتماد کنید، در تصمیم گیریهای درمانی اطمینان بیشتری خواهید داشت. این بدان معناست که ارتباطات بخش کلیدی مراقبت شما از تشخیص در سراسر درمان و فراتر از آن است.
سعی کنید از پرسیدن سوالاتی از پزشک و تیم مراقبت از سرطان خودداری کنید، “چه کار میکنید؟” یا “اگر شما جای من بودید، آیا درمان دیگری را امتحان میکردید؟” درعوض، سعی کنید سوالاتی مانند “لطفاً میتوانید همه گزینههای ممکن را به من بگویید؟” و “بر اساس تجربه خود در مورد درمان نوع سرطان من چه چیزی را توصیه میکنید؟” را بپرسید.
صحبت کردن با عزیزانتان
در مورد سرطان و اخباری که به شما داده شده است، با عزیزان خود باز باشید. افکار، احساسات و پیشنهادات آنها را بررسی کنید. با آنها در مورد گزینههایی که به شما داده شده است، همراه با تصمیماتی که گرفته اید یا میخواهید اتخاذ کنید، صحبت کنید. اگر احساس میکنید به نظرات آنها نیاز دارید، بپرسید. اگر نه، قاطع باشید که دوست دارید خودتان تصمیم بگیرید.
فکر کردن به نظر دوم
برخی از بیماران یا عزیزانشان هنگام تصمیم گیری در مورد ادامه درمان سرطان ممکن است بخواهند نظر دومی را دریافت کنند. حتی زمانی که به پزشک و تیم مراقبت از سرطان خود اعتماد کامل دارید، ممکن است خواستار این باشید که آیا پزشک دیگری میتواند چیز دیگری یا اطلاعات بیشتری به من ارائه دهد. طبیعی است که به صحبت کردن با شخص دیگری فکر کنید و اگر تصمیم به گرفتن نظر دیگری دارید، پزشک باید از شما حمایت کند. به یاد داشته باشید که تیم مراقبت از سرطان از شما میخواهد که در مورد تصمیماتی که میگیرید مطمئن باشید.
اگر درمان دیگری در دسترس باشد
اگر سرطانی دارید که به رشد خود ادامه میدهد یا پس از یک نوع درمان عود میکند، ممکن است درمان دیگری همچنان به کوچک شدن سرطان کمک کند یا حداقل آن را به اندازه کافی کنترل کند تا به شما کمک کند طولانی تر زندگی کنید و احساس بهتری داشته باشید. کارآزماییهای بالینی همچنین ممکن است فرصتهایی را برای آزمایش درمانهای جدیدتر که میتوانند مفید باشند، ارائه دهد.
اگر میخواهید تا زمانی که میتوانید به درمان ادامه دهید، مهم است که در مورد احتمال فواید درمان بیشتر (و این که چه فایدهای ممکن است داشته باشد)، در مقایسه با خطرات و عوارض جانبی احتمالی فکر کنید. پزشک شما میتواند به تخمین میزان احتمال پاسخ سرطان به درمانی که ممکن است در نظر داشته باشید، کمک کند.
به عنوان مثال، پزشک ممکن است بگوید که درمان بیشتر ممکن است در حدود 1 در 100 شانس موثر داشته باشد. اگر این طرح را انتخاب میکنید، داشتن انتظارات واقع بینانه مهم است. فواید احتمالی، خطرات، عوارض جانبی، هزینهها، برنامه درمان و ویزیتها و تأثیر آن بر کیفیت زندگی باید همیشه مورد توجه و بحث قرار گیرد.
وقتی فردی درمانهای مختلف را امتحان کرده و سرطان همچنان در حال رشد است، حتی درمانهای جدیدتر ممکن است دیگر مفید نباشند. این احتمالاً سختترین بخش تجربه سرطان شما خواهد بود – اگر درمانهای زیادی را پشت سر گذاشته اید و دیگر هیچ چیز کار نمیکند. در برخی مواقع ممکن است لازم باشد در نظر داشته باشید که درمان بیشتر احتمالاً سلامت شما را بهبود نمیبخشد یا نتیجه یا بقای شما را تغییر نمیدهد.
درمان در این شرایط گاهی به عنوان مراقبت بیهوده (futile care) شناخته میشود. باز هم، مهم است که به تیم مراقبت از سرطان خود اعتماد کنید و در این دوران سخت در مورد همه گزینهها با عزیزان خود صحبت کنید و در مورد ادامه درمان تصمیم بگیرید.
چه چیز دیگری میتواند انجام شود:
مراقبت تسکینی (Palliative care)
چه درمان را ادامه دهید یا نه، کارهایی وجود دارد که میتوانید برای کمک به حفظ یا بهبود کیفیت زندگی خود انجام دهید. مهم این است که تا جایی که میتوانید احساس خوبی داشته باشید.
حتماً در مورد علائمی که ممکن است داشته باشید، مانند حالت تهوع یا درد، بپرسید و آنها را درمان کنید. مراقبت تسکینی میتواند مورد استفاده قرار گیرد، چه در حال درمان سرطان باشید یا نه. این روش در هر مرحله از بیماری شما قابل استفاده است. مراقبت تسکینی برای کمک به کاهش علائم و عوارض جانبی استفاده میشود.
مراقبت از آسایشگاهی (Hospice care)
اگر تصمیم به توقف درمان گرفته شود، در برخی مواقع، ممکن است از مراقبتهای آسایشگاهی بهره مند شوید. در پایان عمر، مراقبت آسایشگاهی بر کیفیت زندگی شما و کمک به مدیریت علائم خود تمرکز میکند. مراقبت آسایشگاهی به جای بیماری، فرد را درمان میکند و بر کیفیت زندگی شما تمرکز میکند تا طول آن.
در حالی که دریافت مراقبت آسایشگاهی به معنای پایان درمانهایی مانند شیمی درمانی و پرتو درمانی است، به این معنا نیست که نمیتوانید برای مشکلات ناشی از سرطان یا سایر بیماریها خود را درمان کنید. در آسایشگاه تمرکز مراقبت شما بر این است که زندگی را تا حد امکان به طور کامل داشته باشید و در این زمان سخت تا آنجا که میتوانید احساس خوبی داشته باشید.
امیدوار ماندن
امید شما برای زندگی بدون سرطان ممکن است چندان روشن نباشد اما هنوز امیدی برای لحظات خوب با خانواده و دوستان وجود دارد – اوقاتی که پر از شادی و معنا هستند. توقف در این زمان در درمان سرطان به شما این فرصت را میدهد که دوباره روی مهم ترین چیزهای زندگی خود تمرکز کنید. اکنون ممکن است زمانی باشد که کارهایی را انجام دهید که همیشه میخواستید انجام دهید و از انجام کارهایی که دیگر نمیخواهید انجام دهید، دست بردارید. اگرچه سرطان ممکن است خارج از کنترل شما باشد، هنوز انتخابهایی وجود دارد که میتوانید انجام دهید.
دومین سرطان بعد از مولتیپل میلوما
بازماندگان سرطان ممکن است تحت تأثیر تعدادی از مشکلات سلامتی قرار گیرند اما اغلب بزرگترین نگرانی آنها مواجهه مجدد با سرطان است. اگر سرطان پس از درمان بازگردد، عود (recurrence) نامیده میشود.
اما برخی از بازماندگان سرطان ممکن است بعداً به سرطان جدید و نامرتبط مبتلا شوند. این سرطان دوم (second cancer) نامیده میشود. مهم نیست که چه نوع سرطانی داشته اید، حتی پس از زنده ماندن از سرطان اول، همچنان ممکن است به سرطان (جدید) دیگری مبتلا شوید.
متأسفانه، درمان سرطان به این معنی نیست که نمیتوانید سرطان دیگری بگیرید. افرادی که سرطان داشته اند، هنوز هم میتوانند به همان انواع سرطانهایی مبتلا شوند که سایر افراد به آنها مبتلا میشوند. در واقع، انواع خاصی از سرطان و درمانهای سرطان را میتوان با خطر بالاتر ابتلا به سرطانهای دوم مرتبط دانست.
بازماندگان مولتیپل میلوما میتوانند به هر نوع سرطان دوم مبتلا شوند اما خطر ابتلا به موارد زیر را افزایش میدهند:
- لوسمی حاد میلوئیدی (Acute myeloid leukemia یا AML)
- سندرم میلودیسپلاستیک (Myelodysplastic syndrome یا MDS)
پیگیری پس از درمان مولتیپل میلوما
بیماران مبتلا به مولتیپل میلوما باید به طور منظم به پزشک خود مراجعه کنند. درمان اغلب این سرطان را بهبود نمیدهد اما میتواند باعث پسرفت یا از بین رفتن آن برای مدتی شود. اگر سرطان عود کند یا بدتر شود، درمان ممکن است دوباره شروع شود. در مورد علائم یا مشکلات جدید به پزشک خود اطلاع دهید زیرا ممکن است ناشی از میلوما یا یک بیماری جدید یا سرطان دوم باشد.
آیا میتوانم خطر ابتلا به سرطان دوم را کاهش دهم؟
اقداماتی وجود دارد که میتوانید برای کاهش خطر و سالم ماندن تا حد امکان انجام دهید. به عنوان مثال، بازماندگان مولتیپل میلوما باید تمام تلاش خود را برای دوری از محصولات دارای تنباکو و دود آن انجام دهند زیرا سیگار کشیدن خطر ابتلا به بسیاری از سرطانها را افزایش میدهد.
برای کمک به حفظ سلامتی، بازماندگان مولتیپل میلوما باید موارد زیر را رعایت کنند:
- به وزن سالم برسید و در آن بمانید.
- فعالیت بدنی خود را حفظ کنید و زمان نشستن یا دراز کشیدن را محدود کنید.
- از یک الگوی تغذیه سالم پیروی کنید که شامل مقدار زیادی میوه، سبزیجات و غلات کامل باشد و از مصرف گوشت قرمز و فرآوری شده، نوشیدنیهای شیرین و غذاهای بسیار فرآوری شده محدود یا اجتناب شود.
- الکل ننوشید. اگر مشروب میخورید، بیش از 1 نوشیدنی در روز برای زنان یا 2 نوشیدنی در روز برای مردان مصرف نکنید.
این مراحل همچنین ممکن است خطر برخی دیگر از مشکلات سلامتی را کاهش دهد.
چه چیزی در تحقیقات مولتیپل میلوما وجود دارد؟
تحقیقات مهمی در مورد مولتیپل میلوما در بیمارستانهای دانشگاهی، مراکز پزشکی و سایر موسسات در سراسر جهان انجام میشود. هر سال، دانشمندان اطلاعات بیشتری در مورد عوامل ایجاد کننده این بیماری و چگونگی بهبود روند درمان پیدا میکنند. بسیاری از داروهای جدید در حال آزمایش هستند.
محققان دریافته اند که بافتهای پشتیبان مغز استخوان و سلولهای استخوانی فاکتورهای رشدی تولید میکنند که رشد سلولهای میلوما را افزایش میدهند. به نوبه خود، سلولهای میلوما موادی تولید میکنند که باعث میشود سلولهای استخوانی دچار تغییراتی شوند که باعث ضعیف شدن استخوانها میشوند. این اکتشافات به محققان کمک میکند تا داروهای جدیدی را برای مسدود کردن این فاکتورهای رشد، کاهش سرعت سرطان و کاهش تخریب استخوان بسازند.
مولتیپل میلوما اسمولدرینگ
حتی اگر بیشتر بیماران مبتلا به مولتیپل میلوما اسمولدرینگ در معرض خطر کمی برای تبدیل شدن به میلوم فعال هستند، بیماران خاصی با ویژگیهایی وجود دارند که آنها را در معرض خطر بیشتری برای ابتلا به میلوم فعال قرار میدهد. تحقیقات جدید نشان میدهد که درمان این بیماران زودتر از انتظار برای علائم، ممکن است شروع میلوم فعال را به تأخیر بیندازد و همچنین ممکن است بقا را بهبود بخشد.
حداقل بیماری باقی مانده
حداقل بیماری باقی مانده (Minimal residual disease) اصطلاحی است که زمانی استفاده میشود که مقادیر بسیار کمی از سلولهای سرطانی میلوما پس از درمان همچنان در مغز استخوان وجود دارند. به نظر میرسد بیمارانی که پس از درمان هیچ سلول سرطانی در آنها باقی نمانده است نسبت به بیمارانی که هنوز مقادیر بسیار کمی از سلولهای سرطانی دارند، نرخ بقای بهتری دارند.
فناوریهای جدید در حال کار برای یافتن یک سلول میلوما در یک میلیون سلول طبیعی هستند. مطالعات همچنین به دنبال این هستند که آیا خلاص شدن از هر سلول سرطانی میلوما (بدون حداقل بیماری باقی مانده) باید یک هدف درمانی باشد یا خیر.
درمان با سلول T با گیرنده آنتی ژن کایمریک (CAR)
سیستم ایمنی بدن شما کمک میکند تا تمام موادی که به طور معمول در بدن شما یافت میشود را پیگیری کند. هر ماده جدیدی که سیستم ایمنی آن را تشخیص نمیدهد، زنگ خطر را به صدا در میآورد و باعث میشود سیستم ایمنی به آن حمله کند.
درمان با سلولهای T گیرنده آنتی ژن کایمریک (CAR T-cell therapy) یک روش نویدبخش جدید برای جذب سلولهای ایمنی به نام سلولهای T (نوعی گلبول سفید) برای مبارزه با سرطان با تغییر آنها در آزمایشگاه است تا بتوانند سلولهای سرطان را پیدا کرده و از بین ببرند. مطالعات اخیر نشان داده است که درمان با سلولهای T CAR با پروتئین BCMA حتی در بیماران میلوما که قبلاً با بسیاری از داروها درمان شده اند، بسیار امیدوار کننده است.
همچنین بخوانید:
- نوروبلاستوما (Neuroblastoma) چیست؟ علائم، تشخیص، پیشگیری و درمان
- استئوسارکوم (Osteosarcoma) چیست؟ علائم، تشخیص، پیشگیری و درمان
- سارکوم بافت نرم چیست؟ انواع، علائم، تشخیص و درمان
- سرطان تیروئید (Thyroid Cancer) چیست؟ علائم، تشخیص و درمان
- تومورهای استرومال دستگاه گوارش (Gastrointestinal Stromal Tumors) چیست؟ علائم، تشخیص و درمان
مترجم: فاطمه فریادرس




دل درد ناشی از مصرف قرص لنولما رو چگونه درمان کنیم
از پزشک خود مشورت بگیرید تا دچار تداخل دارویی نشوید
باسلام پدرم با علایم درد کمر مراجعه کردند به پزشک و به علت اینکه استخوان ستون فقرات شکستگی پیدا کرد بود تخت عمل جراحی قرار گرفتند و متوجه شدن که پلاسماستیو منفرد دارند ولی چون که قبلاً نمونه برداری و آزمایش خون مشکل نداشتن دکتر تحت نظر گرفتن و رادیوتراپی انجام دادن ولی در جواب پاتولوژی سلول زنده دیده شده راهنمایی میفرمایید،لازم به ذکر است رادیوتراپی و نمونه برداری قبل از عمل ستون فقرات بوده است باتشکر
با توجه به شرایط پیچیدهای که برای پدر شما توصیف کردید، موقعیتی که با آن روبرو هستید به درک دقیق و پیگیریهای پزشکی نیاز دارد.
سلام وقت بخیر
من حدود یک سالی است که درگیر بیماری mm شده ام و 15جلسه رادیوتراپی و 18 جلسه کموتراپی شده ام و به شدت درد پاها و ضعف پاها را دارم که الان منتظر پیوند مغز استخوان هستم .
سئوالم اینه که این درد پاها آیا با پیوند خوب میشوند یا نه ؟
پیوند مغز استخوان میتواند به کنترل بیماری مالتیپل میلوما و بهبود علائم مربوط به آن کمک کند. با این حال، بهبود درد و ضعف پاها به عوامل مختلفی بستگی دارد و ممکن است نیاز به اقدامات مکمل مانند فیزیوتراپی و مصرف داروهای مسکن داشته باشد. مشاوره با پزشک معالج و پیگیری دقیق توصیههای او برای مدیریت علائم و بهبود کیفیت زندگی بسیار مهم است.
سلام داروی تخصصی برای میلوما از نوع بنس جونز وجود داره ممنون میشم راهنمایی بفرمائید
درمان میلوما معمولاً چند جانبه است و به عوامل مختلفی بستگی دارد. بهترین راهکار این است که با یک هماتولوژیست یا متخصص سرطان مشورت کنید تا بر اساس وضعیت خاص شما، درمان مناسب تعیین شود. این متخصصان میتوانند بهترین ترکیب داروها و روشهای درمانی را برای مدیریت و کنترل بیماری پیشنهاد دهند.
سلام ایا کسی که بیماری مولتیپل میلونا داره با خوردن قرص لنالیدوماید باید حتما اسپرین مصرف کنه یا نه؟
سلام با پزشک خود مشورت کنید