مقدمهای بر ویروس نیپا
- ویروس نیپا (NiV) یک پاتوژن زئونوز منتقله از خفاش است که متعلق به پارامیکسو ویروسها است.
- اولین بار در سال 1998 در مالزی شناسایی شد. با این حال، هیچ موردی در مالزی از سال 1999 شناسایی نشده است.
- این ویروس مسئول چندین شیوع در مناطق جنوب و جنوب شرق آسیا است.
- خفاشهای میوه پتروپوس مخزن اصلی پاتوژن هستند که میتوانند منجر به ایجاد بیماری در انسان و خوک شوند.
- شیوع ویروس مالزی – سنگاپور با تماس با خوکها همراه بود در حالی که شیوع هند و بنگلادش با مصرف شیره خرما خام آلوده شده با خفاشهای میوه همراه بود.
- این ویروس باعث بیماری شدید عصبی و تنفسی میشود که بسیار عفونی است و از طریق حیوانات آلوده و سایر افراد آلوده منتقل میشود.
- با توجه به مرگ و میر بالا، انتقال و در دسترس نبودن درمان و واکسن مؤثر علیه ویروس، به عنوان پاتوژن سطح 4 ایمنی زیستی (BSL 4) در نظر گرفته میشود.
ساختار ویروس نیپا (NiV)
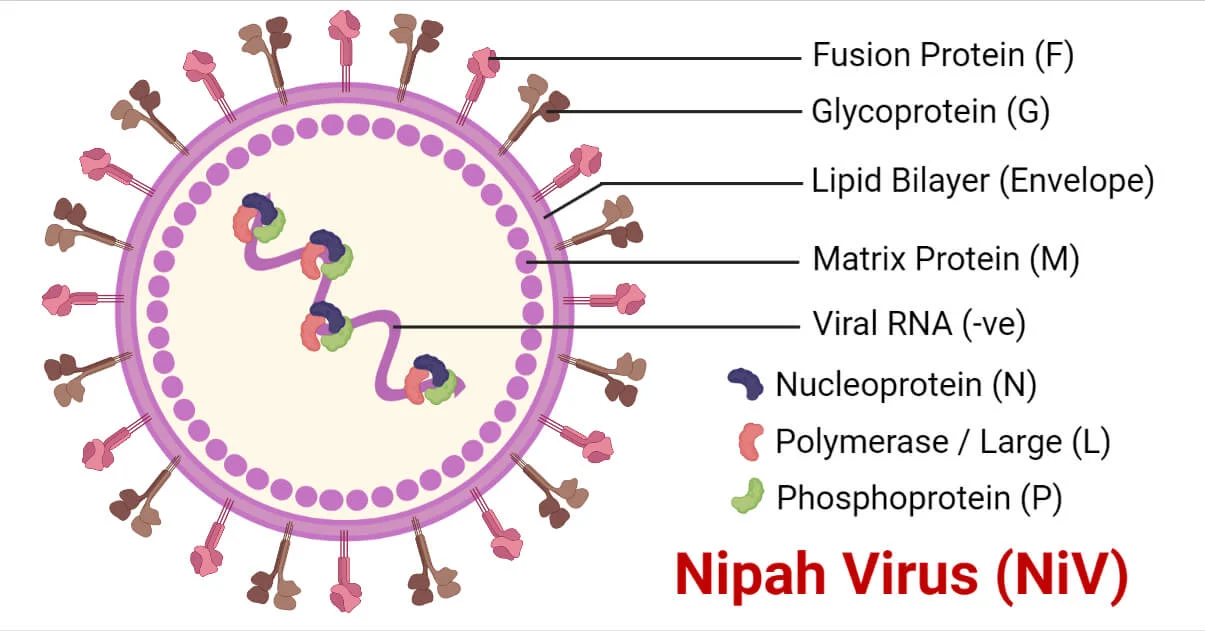
- ویروس نیپا یک ویروس پوششی است که متعلق به خانواده Paramyxoviridae است.
- از یک ژنوم RNA سوی منفی، تکرشتهای با نوکلئوکپسید مارپیچ تشکیل شده است.
- نوکلئوکپسید، فسفو پروتئین و پلیمراز طولانی، ریبونوکلئوپروتئین ویروسی را تشکیل میدهند.
- نوکلئوکپسید توسط پروتئین ماتریکس تعبیه شده با پروتئینهای همجوشی و گلیکوپروتئینها احاطه شده است که به صورت اسپایک بیرون زده و مسئول اتصال سلولی و ورود به سلول میزبان هستند.
- به طور متوسط، NiV بزرگتر از پارامیکسوویروسهای معمولی با اندازههای مختلف از 40 تا 1900 نانومتر است.
- این ویروس همچنین با سایر پارامیکسوویروسها در داشتن انکلوزیونهای سیتوپلاسمی مشبک نزدیک به شبکه آندوپلاسمی متفاوت است.
- این ویروس شباهت نزدیکی به ویروس هند را (HeV) دارد و تنها تفاوتهای فراساختاری جزئی دارد و همچنین در آزمایشهای سرولوژیکی مختلف واکنش متقاطع قابلتوجهی را نشان میدهد.
- دو سویه؛ سویههای مالزیایی (MY) و بنگلادش (BD) تقریباً 92٪ شباهت توالی دارند؛ اما تفاوتهایی در بیماریزایی و انتقال آنها دیده میشود.
ساختار ژنوم ویروس نیپا (NiV)
- ژنوم NiV متشکل از یک RNA با سوی منفی و تکرشتهای با اندازه ژنوم تقریباً 18.2 kbp است.
- این شش پروتئین ساختاری را کد میکند. نوکلئوپروتئین (N)، فسفو پروتئین (P)، پروتئین ماتریکس (M)، پروتئین فیوژن (F)، گلیکوپروتئین پیوست (G) و پروتئین بزرگ یا پروتئین RNA پلیمراز (L).
- ژن P همچنین سه پروتئین غیرساختاری را با ویرایش RNA (پروتئینهای V و W) یا یک چارچوب باز متناوب (پروتئین C) کد میکند.
اپیدمیولوژی ویروس نیپا (NiV)
- اولین شیوع ویروس نیپا در سال 1998-1999 در مالزی-سنگاپور گزارش شد.
- از سپتامبر 1998 تا ژوئن 1999، 94 بیمار که تماس نزدیک با جمعیت خوکی را گزارش کردند، با آنسفالیت ویروسی شدید تشخیص داده شد که انتقال مستقیم ویروس از خوکها به انسان را نشان میداد.
- در سنگاپور و مالزی، 246 بیمار مبتلا به انسفالیت تب ناشی از ویروس نیپا بین سالهای 1998 و 1999 گزارش شدند. میزان مرگ و میر انسانی تقریباً 40 درصد بود.
- شیوع دوم در منطقه مهرپور بنگلادش و شهر سیلیگوری در بنگال غربی هند در سال 2001 در یک منطقه جغرافیایی غیر همجوار گزارش شد.
- به طور کلی، تا سال 2010، 9 مورد شیوع NiV در بنگلادش گزارش شده است.
- شیوع دیگری در بنگلادش در سال 2011 در مجموع 15 مورد مرگ ناشی از عفونت ویروس نیپا را گزارش کرد.
- بررسیهای اپیدمیولوژیک نشان داد که گردش ویروس نیپا در آسیا، آفریقا و اقیانوس آرام جنوبی باعث شیوع پراکنده از طریق انتقال انسان به انسان و انسان و دام میشود.
- این بیماری طی دو دهه گذشته منجر به مرگ صدها انسان شده و تهدیدی بزرگ برای انسانها و همچنین حیوانات اهلی ایجاد کرده است.
انتقال ویروس نیپا (NiV)
ویروس نیپا میتواند از طرق زیر به افراد منتقل شود:
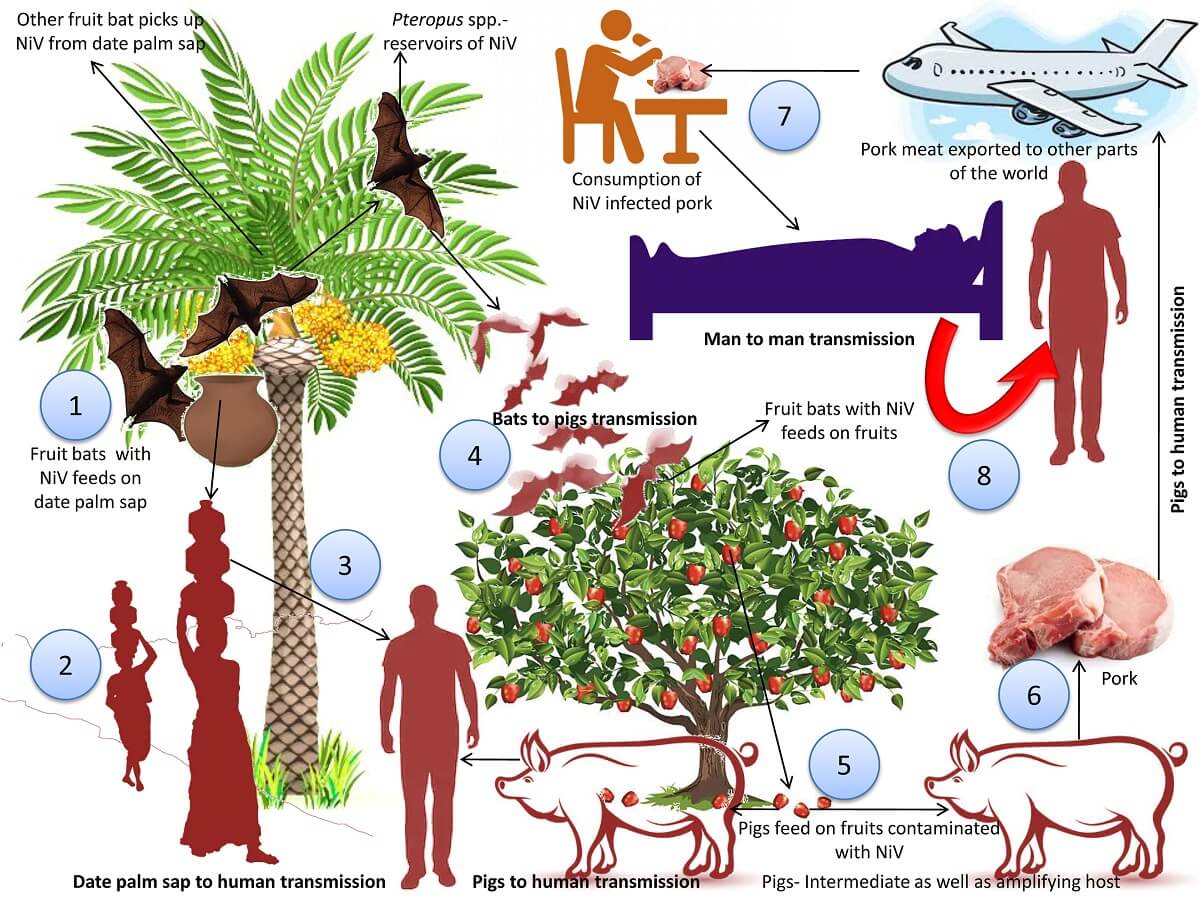
- تماس مستقیم با حیوانات آلوده؛ مانند خفاش یا خوک یا مایعات بدن آنها مانند خون، ادرار، بزاق و غیره.
- مصرف محصولات غذایی آلوده که توسط حیوانات آلوده، آلوده شدهاند (مانند شیره خرما یا میوههای آلوده به خفاشهای میوه آلوده)
- تماس نزدیک با فرد آلوده به NiV یا مایع بدن او (مانند قطرات بینی یا تنفسی، ادرار یا خون)
- در طول اولین شیوع مالزی – سنگاپور، عفونتهای انسانی ناشی از تماس مستقیم با خوکهای آلوده یا مایعات بدن آنها بود.
- محتملترین منبع عفونت در طی شیوعهای بعدی در بنگلادش و هند از طریق مصرف میوهها و محصولات میوهای (مانند آب خرما خام) آلوده به بزاق خفاشهای میوهای آلوده رخ میدهد.
- در طول شیوع بعدی ویروس نیپا در بنگلادش و هند، مشاهده شد که NiV مستقیماً از طریق تماس نزدیک و مایعات و ترشحات بدن از انسان به انسان سرایت میکند.
- انتقال انسان به انسان نیز در بسیاری از اعضای خانواده و مراقبان بیماران مبتلا گزارش شده است.
تکثیر ویروس نیپا (NiV)
پیوست/اتصال
ویروس از طریق گلیکوپروتئین G ویروسی با گیرنده B2 به سلول میزبان خود متصل میشود و سپس غشای ویروسی با غشای میزبان ادغام میشود.
نفوذ و بیوسنتز
ژنوم RNA منفی به عنوان الگویی برای رونویسی mRNA ویروسی عمل میکند که بیشتر به پروتئینهای ویروسی ترجمه میشود. vRNA همچنین به عنوان الگویی برای سنتز cRNA(+) عمل میکند که بیشتر به عنوان الگوی سنتز vRNA عمل میکند. پروتئینهای ویروسی در سیگنالدهی اینترفرون نیز عمل میکنند. پروتئینهای F نیز در سلولها اندوسیتوز شده و بالغ میشوند.
مونتاژ
مونتاژ در درجه اول توسط پروتئین M انجام میشود و N، P، C، M، F و G در ویریونها گنجانده میشوند.
آزادسازی
ویریونها از طریق غشای میزبان حاوی پروتئینهای G در سطح آن جوانه زده و از سلول آزاد میشوند.
پاتوژنز ویروس نیپا (NiV)
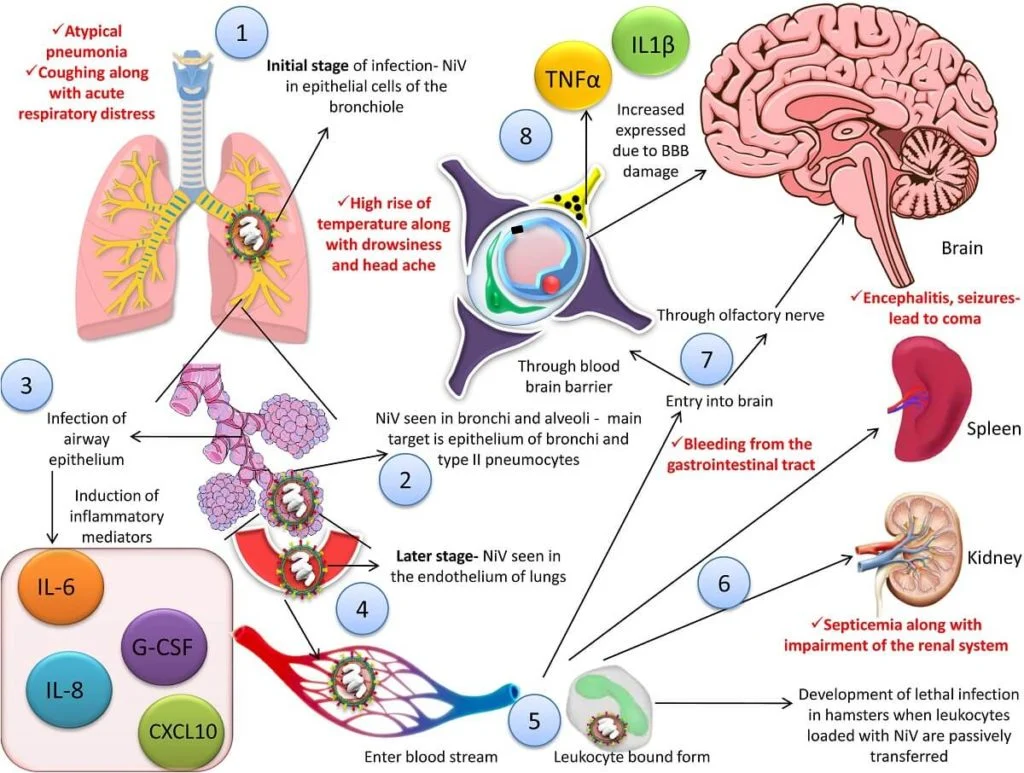
- ویروس نیپا از طریق دهان و بینی وارد میزبان میشود و باعث عفونت میشود.
- مکان دقیق تکثیر اولیه در انسان هنوز به وضوح مشخص نشده است.
- با این حال، بافتهای لنفاوی و تنفسی به دلیل غلظت بالای آنتیژن موجود در آنها در طول عفونت، مکانهای بالقوه تکثیر اولیه در نظر گرفته میشوند.
- آنتیژنهای ویروسی که میتوانند در برونشها و آلوئولها شناسایی شوند، تولید سایتوکینهای التهابی را القا میکنند که در نهایت میتواند منجر به بیماری مشابه سندرم دیسترس تنفسی حاد (ARDS) شود.
- سپس ویروس در مرحله بعدی بیماری به سلولهای اندوتلیال ریهها منتشر میشود.
- ویرمی (ویرمیا) اولیه منجر به گسترش ویروس و به دنبال آن تکثیر ثانویه در اندوتلیوم میشود.
- گلیکوپروتئین G ویروسی به گیرنده افرین-B2 در اندوتلیوم و همچنین ریهها، جفت، پروستات، عروق خونی و بافتهای مختلف دیگر متصل میشود.
- Ephrin-B2 بین طبقات مختلف حیوانات با شباهتهای تقریباً 95-96٪ در خفاشها و خوکها به شدت حفظ و نگهداری میشود که طیف گستردهای از میزبانهای مرتبط با ویروس نیپا را توضیح میدهد.
- ویروس از طریق گردش خون هماتوژن و یا از طریق اعصاب بویایی به سیستم عصبی مرکزی حمله میکند.
- این امر سد خونی مغزی (BBB) را مختل میکند و IL-1β را همراه با فاکتور نکروز تومور (TNF)-α بیان میکند که منجر به تظاهرات عصبی در طول عفونت میشود.
- این ویروس از پاسخ ایمنی ذاتی فرار میکند که منجر به کشندگی بالا میشود.
- محصولات ژن P نیز فعالیت اینترفرون را مهار میکنند.
- گونههای مختلف ویروس NiV به طور جداگانه با مخازن خود تکامل یافتهاند که تفاوتهای مشاهده شده در بیماریزایی و ویژگیهای اپیدمیولوژیک آن را توضیح میدهد.
تظاهرات بالینی ویروس نیپا (NiV)
عفونت ویروس نیپا میتواند تظاهرات خفیف تا شدید، از جمله آنسفالیت و در نهایت مرگ را ایجاد کند.
دوره نهفتگی ویروس معمولاً بین 4 تا 14 روز است. با این حال، دوره نهفتگی طولانی مدت 45 روز نیز گزارش شده است. علائم کلی در مرحله اولیه عفونت عبارتاند از:
- تب
- سردرد
- سرفه
- گلودرد
- مشکل در تنفس
- میالژی (درد عضلانی)
- استفراغ
علائم شدید نیز ممکن است به دنبال داشته باشد که میتواند به تدریج در عرض 24-48 ساعت به کما منجر شود. علائم ممکن است شامل موارد زیر باشد:
- آشفتگی و سرگردانی
- خواب آلودگی
- گیجی
- تشنج
- کما
- تورم مغز (آنسفالیت)
- برخی از بیماران اختلال عملکرد ساقه مغز مانند رفلکس غیرطبیعی چشم عروسکی، رفلکس مردمک، تغییرات وازوموتور، تشنج، و تکانهای میوکلونیک را نشان میدهند.
یکی از ویژگیهای بارز عفونت ویروس نیپا شامل عود یا آنسفالیت دیررس است که برخی از آنها ماهها یا سالها پس از عفونت حاد رخ میدهد.
برخی از بیماران همچنین دچار تظاهرات روانپزشکی از جمله افسردگی، تغییرات شخصیتی، عدم تمرکز و از دست دادن حافظه کلامی و یا بصری میشوند.
تفاوت در تظاهرات بالینی نیز بین سویههای مختلف در طول شیوع در مالزی و هند مشاهده شد.
بیماری تنفسی مانند سرفه، دیسترس تنفسی و ذاتالریه غیرمعمول در 70 درصد بیماران همراه با نرخ مرگ و میر بالاتر از 70 درصدی در شیوع بیماری در هند و بنگلادش در مقایسه با شیوع در مالزی مشاهده شد که در آن درگیری تنفسی قابل توجهی مشاهده نشد و میزان مرگ و میر نسبتاً کمتری در حدود 40 درصد داشت.
تشخیص ویروس نیپا (NiV)
- نمونه برای آزمایش سرولوژی باید 10-14 روز پس از شروع جمعآوری شود که ممکن است شامل سواب گلو، ادرار، خون و یا CSF برای تشخیص باشد.
- نمونه باید در آزمایشگاه BSL-4 پردازش شود.
- با این حال، میتوان آن را پس از غیرفعالسازی ویروس از طریق تابش نمونه در آزمایشگاه BSL-2 نیز پردازش کرد.
PCR
NiV RNA را میتوان از طریق Real-Time PCR (RT-PCR) از ترشحات تنفسی، ادرار یا CSF تشخیص داد. این تکنیک از حساسیت و تخصص بالایی برخوردار است. روش مبتنی بر پروب TaqMan ژن N را تشخیص میدهد و حساسیت بالاتری دارد در حالی که روش مبتنی بر SYBR Green ناحیه متفاوتی از ژن N را تشخیص میدهد؛ اما حساسیت کمتری دارد و همچنین HeV را نیز تشخیص میدهد.
ایمونوهیستوشیمی
طیف گستردهای از بافتهای تثبیت شده با فرمالین از مکانهای مختلف از جمله مغز، ریه، طحال، کلیه و غدد لنفاوی را میتوان برای ایمونوهیستوشیمی استفاده کرد. سرم انسان در حال بهبودی قبلاً برای ایمونوهیستوشیمی استفاده میشد که اکنون با سرم خرگوش در برابر NiV جایگزین شده است.
جداسازی ویروس
جداسازی ویروس از نمونه باید در آزمایشگاه BSL-4 انجام شود و رده سلولی انتخابی رده سلولی Vero است. اثرات سیتوپاتیک در عرض 3 روز با تشکیل سینسیتیوم توسط NiV مشاهده میشود که بزرگتر از آن است که توسط HeV ایجاد میشود که به تمایز بین این دو کمک میکند.
الایزا
این رایجترین روش سرولوژیکی برای تشخیص عفونت NiV است. برای تشخیص IgG و IgM استفاده میشود. آنتیبادیهای IgM در 50 درصد بیماران در روز اول بیماری قابل تشخیص هستند، در حالی که 100 درصد بیماران پس از 18 روز IgG مثبت نشان میدهند. IgG برای چندین ماه ادامه دارد.
تست خنثی سازی سرم
این تست باید در آزمایشگاه BSL-4 انجام شود، اما به عنوان تست استاندارد طلایی برای تشخیص عفونت NiV در نظر گرفته میشود. سلولهای Vero با سرمهای آزمایشی انکوبه شده با ویروس آلوده میشوند و برای اثرات سیتوپاتیک در 3 روز مشاهده میشوند.
درمان ویروس نیپا
- درمان عفونت ویروس نیپا به درمان حمایتی و مدیریت آنسفالیت حاد محدود میشود.
- درمان حمایتی میتواند شامل تجویز داروهای ضدتشنج، درمان عفونت ثانویه، تهویه مکانیکی و توانبخشی باشد.
- سه عامل دارویی برای درمان احتمالی NiV مورد بررسی قرار گرفته است که شامل ریباویرین، آنتیبادیهای مونوکلونال m102.4 و فاویپیراویر میباشد.
پیشگیری و کنترل NiV
با توجه به محدود بودن درمانهای موجود برای عفونت NiV، پیشگیری از این بیماری باید از اولویت بالایی برخوردار باشد.
علیرغم اینکه یکی از پاتوژنهای اولویتدار سازمان جهانی بهداشت با نرخ مرگ و میر بالا است، هنوز هیچ واکسنی که برای عفونت NiV برای استفاده انسانی مؤثر و دارای مجوز باشد، وجود ندارد. با این حال، واکسنهایی علیه ویروس نیپا که توسط واکسنهای بهداشت عمومی، دانشگاه توکیو و دانشگاه آکسفورد تولید شدهاند، در حال آزمایشهای بالینی هستند و برنامههایی برای آزمایش ایمنی و اثربخشی آنها در چند سال آینده وجود دارد.
برخی از اقدامات پیشگیرانه برای این بیماری عبارتاند از:
- مداخلات برای جلوگیری از آلوده شدن حیوانات مزرعه به ویروس با جلوگیری از خوردن میوههای آلوده شده به ویروس از طریق خفاشهای میوه.
- مزارع نباید نزدیک درختان میوهای باشند که خفاشها را جذب میکنند
- باید از مصرف شیرههای آلوده خودداری شود
- نصب موانع فیزیکی برای جلوگیری از دسترسی خفاشها به درختان
- نمونهها باید در کابینتهای ایمنی زیستی مناسب با حداقل مراحل تشکیل آئروسل نگهداری شوند.
- بیماران یا حیوانات مزرعه مشکوک به عفونت NiV باید فوراً قرنطینه شوند
- در مناطق پرخطر بیماری، بیمارستانها و مراکز بهداشتی درمانی باید برای غربالگری و مدیریت مناسب شیوع احتمالی آماده باشند.
- قبل و بعد از دست زدن به نمونهها و یا تماس با بیمار باید شستن دستها و اقدامات بهداشتی مناسب انجام شود.
همچنین بخوانید:
مترجم: مریم محجوب