اطلاعیه:
اطلاعات ارائهشده در این وبسایت صرفاً برای اهداف آموزشی، مطالعه و اطلاعات عمومی است. اطلاعات ارائهشده در این وبسایت نباید برای مشاوره پزشکی، تشخیص یا درمان استفاده شود. اگر حال شما خوب نیست، لطفاً با پزشک، دکتر یا متخصصان مراقبتهای بهداشتی واجد شرایط مشورت کنید
مقدمهای بر ویروس HMPV
ویروس متاپنوموویروس انسانی (HMPV) ویروسی است که باعث عفونت حاد دستگاه تنفسی، عمدتاً در کودکان، سالمندان و افرادی که سیستم ایمنی ضعیفی دارند، میشود. علائم آن مشابه سرماخوردگی معمولی است، اما میتواند عفونتهای تنفسی مانند ذاتالریه و برونشیولیت (Bronchiolitis) ایجاد کند.
{توضیحات: برونشیولیت یک التهاب است که در لولههای هوایی کوچک (برونکوئیولها) در ریهها ایجاد میشود. این بیماری معمولاً در کودکان زیر دو سال شایع است، اما ممکن است در بزرگسالان نیز رخ دهد، به ویژه در کسانی که شرایط خاصی مانند آسم یا بیماریهای ریوی مزمن دارند.}
این ویروس اولین بار توسط برنادت جی. ون دن هوگن (Bernadette J. van den Hoogen) و همکارانش از ۲۸ کودک در هلند در سال ۲۰۰۱ شناسایی شد. HMPV متعلق به خانوادهی Pneumoviridae و جنس Metapneumovirus است.
محل زندگی متاپنوموویروس انسانی (HMPV)
- متاپنوموویروس انسانی (HMPV) عمدتاً انسانها را آلوده می کند و مخزن حیوانی شناخته شدهای ندارد.
- HMPV ویروسی است که دستگاه تنفسی فوقانی و تحتانی از جمله بینی، گلو و ریه ها را آلوده میکند.
- معمولاً کودکان خردسال، سالمندان و افراد دارای نقص ایمنی را تحت تاثیر قرار میدهد.
- HMPV یک بیماری فصلی است که معمولاً در زمستان و اوایل بهار، مشابه RSV و آنفلوآنزا رخ میدهد.
- HMPV میتواند چندین ساعت روی سطوح زنده بماند که ممکن است باعث انتقال غیر مستقیم شود
ساختار ویروس HMPV
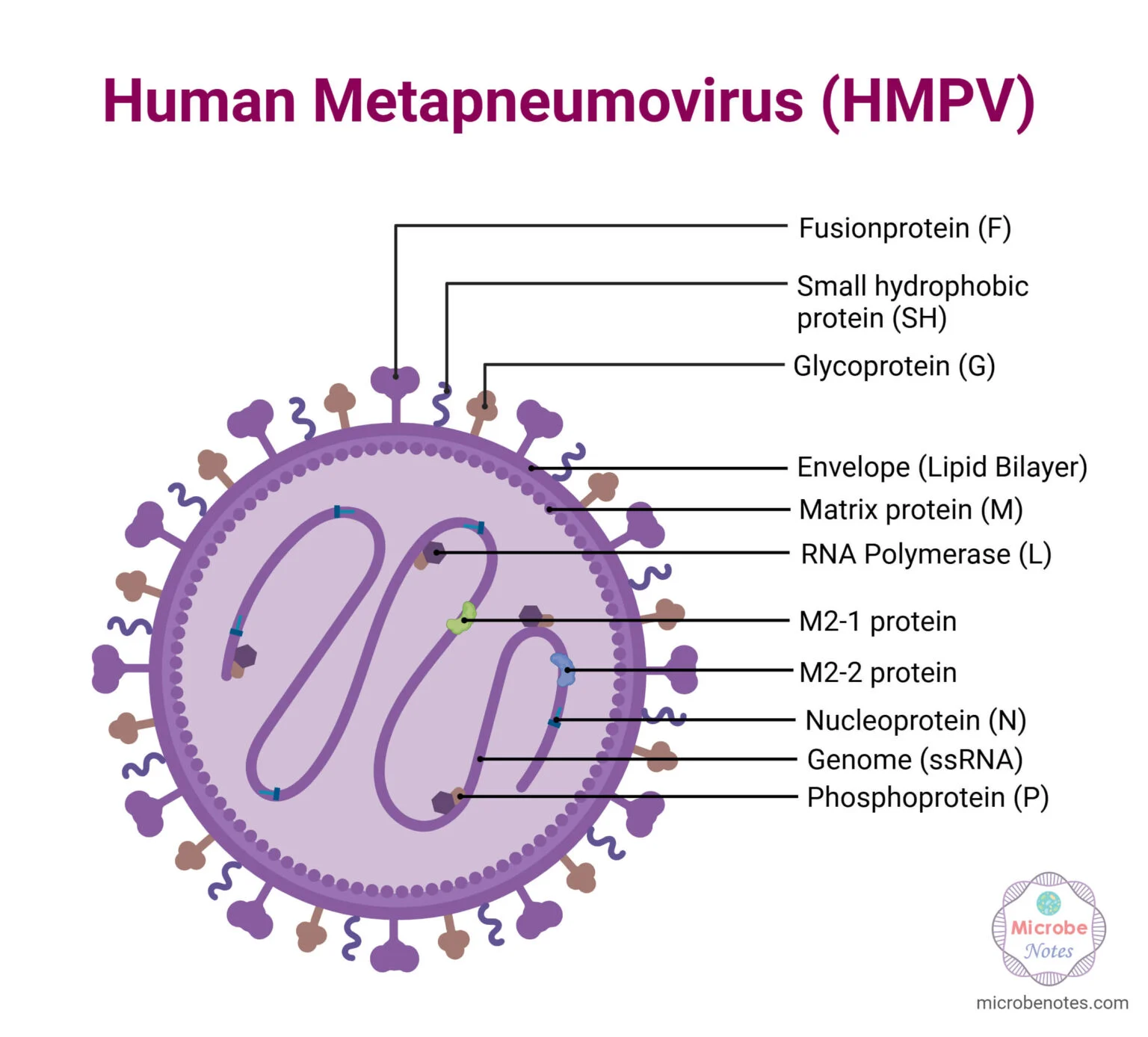
- ویروس متاپنوموویروس انسانی (HMPV) یک ویروس RNA تکرشتهای با قطبیت منفی (-ssRNA) و دارای پوشش است که شکل چندشکلی (پلئومورفیک) دارد.
{ توضیحات مترجم: قطبیت منفی (Negative sense) در مورد RNA به این معناست که رشته RNA در یک ویروس نمیتواند مستقیماً برای تولید پروتئینها مورد استفاده قرار گیرد. به عبارت دیگر، RNA با قطبیت منفی، به طور مستقیم قابل ترجمه به پروتئینها نیست و ابتدا باید به RNA با قطبیت مثبت (Positive sense RNA) تبدیل شود تا بتواند توسط ریبوزومهای سلولی به پروتئین تبدیل شود. }
- این ویروس قطری بین 150 تا 600 نانومتر دارد.
- ساختار HMPV شامل یک پوشش خارجی (دولایه لیپیدی (Lipid bilayer) ) با سه گلیکوپروتئین سطحی غشایی است: پروتئین همجوشی (F)، گلیکوپروتئین (G) و پروتئین هیدروفوب کوچک (SH). این گلیکوپروتئینها به صورت برجستگیهایی به طول تقریبی 13 تا 17 نانومتر دیده میشوند.
- پروتئین همجوشی (F) و گلیکوپروتئین (G) نقش مهمی در ورود ویروس به غشای سلول میزبان و آغاز عفونت (چرخه همانندسازی) ایفا میکنند.
- پروتئین ماتریکس (M) در سطح داخلی پوشش خارجی (دولایه لیپیدی (Lipid bilayer)) قرار دارد. این پروتئین M به عنوان یک پل بین پوشش و نوکلئوکپسید عمل میکند.
ژنوم متاپنوموویروس انسانی (HMPV)
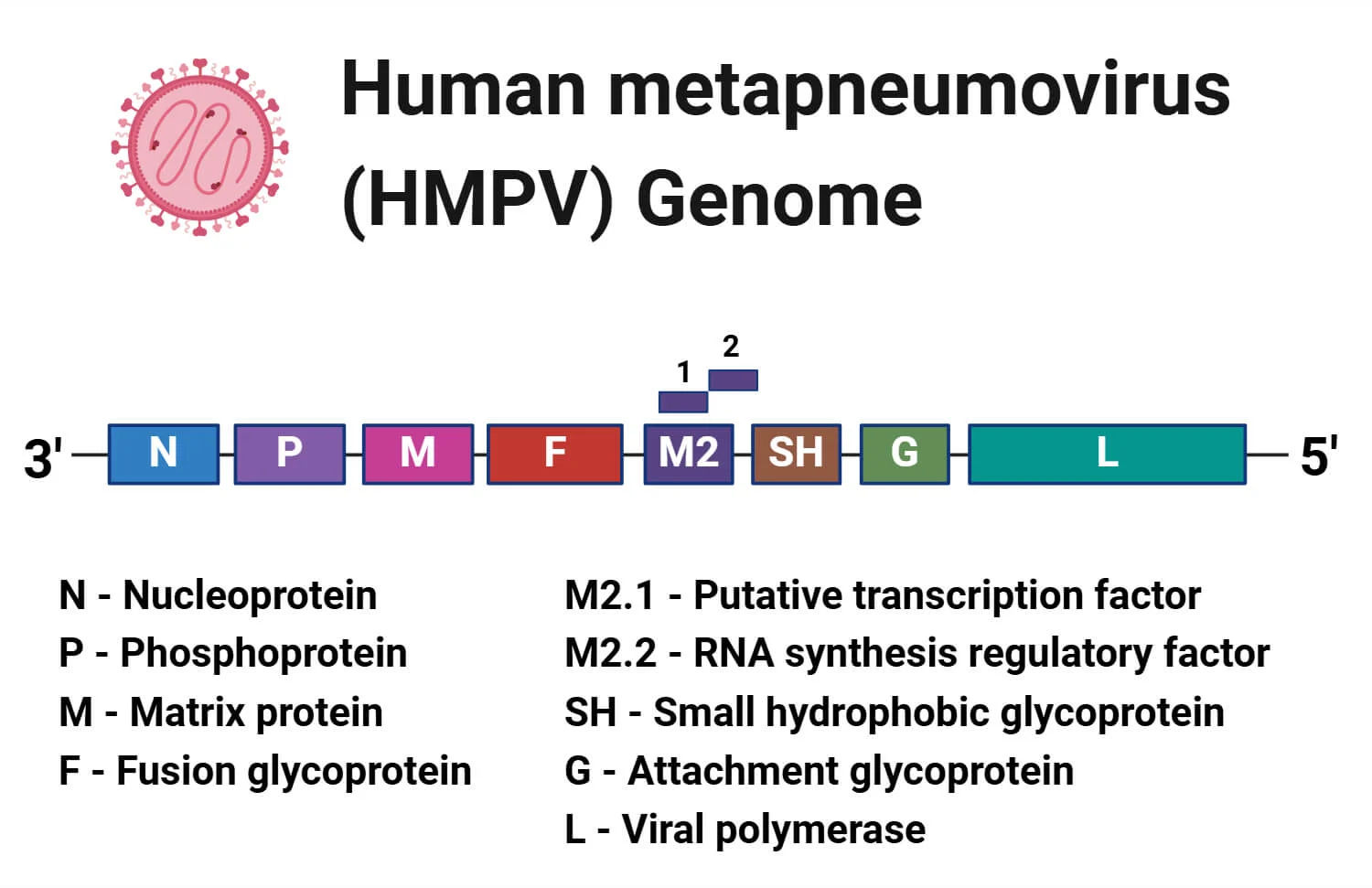
- ژنوم HMPV شامل RNA تکرشتهای با قطبیت منفی (-ssRNA) است و هشت ژن دارد که برای نه پروتئین کد میکنند.
- اندازه ژنوم آن 13.2 کیلوباز است.
- ترتیب ژنها در ژنوم (از انتهای 3′ به 5′) به صورت N–P–M–F–M2–SH–G–L است.
- پروتئینها عبارتند از:
- نوکلئوپروتئین (پروتئین N): در تشکیل نوکلئوکپسید نقش دارد.
- فسفوپروتئین(پروتئین P): در تکثیر ویروسی و فرایند رونویسی دخیل است.
- پروتئین ماتریکس (پروتئین M): در مونتاژ و جوانهزنی ویروس مشارکت دارد.
- گلیکوپروتئین همجوشی (پروتئین F): در فرایند همجوشی ویروس با غشای سلول میزبان کمک میکند.
- فاکتور رونویسی احتمالی (پروتئین M2-1): در تنظیم فرایند رونویسی دخالت میکند.
- فاکتور تنظیمی سنتز RNA (پروتئین M2-2): در تنظیم فرایند رونویسی نقش دارد.
- گلیکوپروتئین هیدروفوب کوچک (پروتئین SH): عملکرد آن به طور دقیق مشخص نیست؛ ممکن است در تعامل ویروس-میزبان موثر باشد.
- گلیکوپروتئین اتصال (پروتئین G): در اتصال ویروس به سلول میزبان دخالت میکند.
- پلیمرار ویروسی ( پروتئین L): در تکثیر ویروسی و فرایند رونویسی نقش دارد.
- تحلیل کل ژنوم HMPV نشان داد که ویروس در دو ژنوتیپ A و B وجود دارد (Barbara Huck et al. 2006).
-
- بر اساس تغییرات توالی در گلیکوپروتئینهای اتصال (G) و همجوشی (F)، این دو ژنوتیپ به زیردستههای A1، A2، B1 و B2 تقسیم میشوند.
- زیردسته A2 دوباره به A2a و A2b تقسیم میشود.
- زیردسته A2b در دو فصل متوالی (2002–2003 و 2003–2004) با شیوع بالایی شناسایی شد و 30 درصد از نمونههای ژنوتیپی را تشکیل میدهد. این زیردسته به دلیل ویژگیهای ژنتیکی خود و سهم بالا در چرخه ویروس بهطور خاص برجسته است
- زیردسته A2b از نظر تنوع ژنتیکی بالاترین میزان تغییر را نشان داده و بین 97.1% تا 99.8% شباهت نوکلئوتیدی در توالی ژن F دارد، که نشاندهنده پیچیدگی تکاملی آن است
- مطالعات فیلوژنتیکی با استفاده از روشهای Neighbor-Joining و Maximum Likelihood، زیردسته A2b را بهعنوان یک کلاد مجزا تأیید کردهاند. این تمایز با بوتاسترپ بالای 98% اعتبار یافته است
- ژنوتیپ A، بهویژه زیردسته A2، در مقایسه با ژنوتیپ B در کشورهای مختلف مانند آلمان و ژاپن غالبتر است. این پراکندگی جغرافیایی نشان میدهد که زیردسته A2b میتواند یک عامل مهم در اپیدمیولوژی جهانی HMPV باشد
- توزیع فصلی HMPV نشان داده است که این ویروس، از جمله زیردسته A2b، در فصول خاصی مانند بهار و اوایل تابستان به اوج میرسد و همزمان با کاهش شیوع ویروس سنسیشیال تنفسی (Respiratory Syncytial Virus ) (RSV) اتفاق میافتد. این ارتباط فصلی میتواند الگوهای رقابتی بین این دو ویروس را نشان دهد
- اخیراً واریانتهای منحصر به فرد HMPV با تکرار 180 نوکلئوتیدی (nt-dup) در ژن G و تکرار 111 نوکلئوتیدی (nt-dup) در ژن G گزارش شده است (Zhibo Xie et al. 2021).
تکثیر ویروس متاپنوموویروس انسانی (HMPV)
تکثیر ویروس متاپنوموویروس انسانی (HMPV) در سیتوپلاسم سلولهای میزبان، عمدتاً در سلولهای اپیتلیال دستگاه تنفسی رخ میدهد.
- اتصال: ویروس با کمک گلیکوپروتئین (G) به سلول میزبان متصل میشود. گلیکوپروتئین (G) حاوی ناحیه هیدروفوبی است که به عنوان یک پپتید سیگنال غیرقابل برش و یک لنگر غشایی (membrane anchor) عمل میکند و به اتصال ویروس کمک میکند.
- همجوشی و ورود: همجوشی HMPV با غشای پلاسمایی میزبان با کمک پروتئین همجوشی (F) انجام میشود. پروتئین همجوشی (F) توانایی اتصال به سلولهای میزبان از طریق اینتگرین αvβ1 با استفاده از موتیف آرژنین-گلیسین-آسپارتات (RGD) را دارد. همجوشی HMPV در pH اسیدی انجام میشود. سپس، ریبونوکلئوپروتئین ویروسی (RNP) که حاوی RNA ویروسی با قطبیت منفی (vRNA ژنوم) است، وارد سیتوپلاسم میزبان میشود.
- رونویسی و ترجمه: نوکلئوپروتئین (پروتئین N)، فسفوپروتئین (پروتئین P) و پلیمرار ویروسی (پروتئین L) از vRNA جدا شده و به یکدیگر متصل میشوند تا کمپلکس پلیمرار تشکیل دهند. پلیمرار RNA وابسته به RNA ویروسی، RNA ویروسی با قطبیت منفی (vRNA) را به RNA پیامرسان (mRNA) رونویسی میکند. سپس این mRNAها توسط ماشینری ریبوزومی میزبان ترجمه میشوند تا پروتئینهای ویروسی لازم برای تکثیر و مونتاژ تولید شوند.
- تکثیر: زمانی که پروتئینهای ویروسی کافی تولید شد، تکثیر ژنوم ویروسی رخ میدهد.
- مونتاژ: ژنومهای ویروسی جدید که از تکثیر تولید شدهاند توسط نوکلئوپروتئینها احاطه میشوند و کمپلکسهای ریبونوکلئوپروتئینی تشکیل میدهند. ریبونوکپسید با پروتئین ماتریکس (M) تحت غشای پلاسمایی میزبان تعامل دارد، جایی که گلیکوپروتئینهای ویروسی (F، G و SH) حمل و در غشا جاسازی میشوند.
- جوانهزنی و آزادسازی: ویریونهای مونتاژ شده از غشای سلول میزبان از طریق کمپلکس ESCRT جوانه میزنند و ویریون آزاد میشود.
اپیدمیولوژی ویروس HMPV
- HMPV تمام گروههای سنی را در سراسر جهان آلوده میکند، با شدت بیشتر در کودکان کوچک، بزرگسالان مسن و افراد دارای سیستم ایمنی ضعیف.
- بیشتر کودکان تا سن 5 سالگی به HMPV مبتلا میشوند.
- عفونت HMPV معمولاً در زمستان و اوایل بهار رخ میدهد.
- افزایش بروز HMPV گزارش شده است با افزایش فاصله از خط استوا (Medscape)
- مطالعهای که در کلینیک واکسیناسیون Vanderbilt در نشویل، یک کلینیک مراقبتهای اولیه انجام شد، نشان داد که HMPV مسئول 12٪ از موارد بیماریهای حاد دستگاه تنفسی در کودکان سالم در یک کلینیک سرپایی در ایالات متحده بود (John V Williams et al. 2007).
- هنگامی که عفونت در دوران کودکی رخ میدهد، احتمال عفونتهای مجدد در طول زندگی بسیار زیاد است.
علائم عفونت HMPV
علائم معمولاً 3 تا 6 روز (دوره نهفتگی) پس از مواجهه با ویروس ظاهر میشوند و معمولاً 2 تا 5 روز طول میکشند. علائم شبیه به سرماخوردگی هستند.
علائم شایع عفونت HMPV
- سرفه
- تب
- آبریزش بینی
- احتقان بینی
- گلودرد
- خستگی
- بثورات جلدی
علائم شدید عفونت HMPV
- خس خس سینه
- مشکل در تنفس
- برونکوئیولیت
- برونشیت
- پنومونی
- تشدید آسم یا بیماری انسدادی مزمن ریوی (COPD)
- عفونتهای گوش
- خرخر
انتقال ویروس متاپنوموویروس انسانی (HMPV)
HMPV از یک فرد به فرد دیگر از طریق:
- تماس شخصی و نزدیک با قطرات/هوازی از یک فرد آلوده.
- سرفه، عطسه، تف.
- تماس مستقیم از طریق دست دادن، بغل کردن، بوسیدن یا لمس فرد آلوده.
- لمس اشیاء یا سطوح مانند دستگیره درها، دستمالها، وسایل، تلفنها، اسباببازیها و غیره که حاوی ویروسها هستند و سپس لمس دهان، بینی یا چشمها.
عوامل خطر عفونت HMPV
HMPV خطر بیشتری برای گروههای خاص به شرح زیر دارد:
- کودکان کوچک زیر 5 سال
- بزرگسالان بالای 65 سال
- افرادی با سیستم ایمنی ضعیف، مانند افراد مبتلا به HIV/AIDS، درمانهای سرطان، پیوند اعضا یا بیماریهای مزمن
- افرادی با شرایط مزمن تنفسی مانند آسم و بیماری انسدادی مزمن ریوی (COPD)
- نوزادان نارس که ممکن است ریهها و سیستم ایمنی ناقص داشته باشند، آنها را نسبت به عفونتهای HMPV آسیبپذیرتر میکند.
پاتوژنز عفونت HMPV
HMPV دستگاه تنفسی را آلوده میکند و باعث عفونتها، التهاب و آسیب به اپیتلیوم مجاری تنفسی میشود.
پاسخ ایمنی میزبان
- HMPV با استفاده از مکانیزمهای خاص، با سیستم ایمنی ذاتی میزبان تداخل میکند.
- ویروس با تنظیم گیرندههای شناسایی الگو، مانند گیرندههای مشابه اسید رتینوئیک، گیرندههای مشابه ژن، و سایر مولکولهای سیگنالدهی، پاسخهای سلولی را تضعیف میکند.
- عفونتهای HMPV ممکن است منجر به پاسخ ایمنی حداقلی و دیرهنگام و فعالیت تأخیری سلولهای T سیتوتوکسیک شود که باعث اختلال در پاکسازی ویروس در عفونت اولیه میشود.
- عفونت با فعالیت سلولهای دندریتیک تداخل میکند و فعالسازی سلولهای T خاص آنتیژن را کاهش میدهد.
- بنابراین، پاکسازی ویروس کامل نمیشود و احتمال عفونت مجدد افزایش مییابد.
- تکثیر سلولهای T خاص آنتیژن محدود شده و تولید ایمنی درازمدت مختل میشود.
- عفونت HMPV سیگنالدهی سلولی وابسته به گیرندههای مشابه اسید رتینوئیک را القا میکند.
- عفونت HMPV تولید اینترفرونهای نوع I و نوع III که مسئول دفاع ضدویروسی هستند را مهار میکند

موسین 19 (Mucin 19)
- تولید مخاط ویژگی رایج در عفونت HMPV است، اما نقش آن در پاتوژنز و پاسخ ایمنی ناشی از HMPV به طور عمده ناشناخته است.
- موسیینها جزء اصلی مخاط هستند و میتوانند بر نحوه پاسخ میزبان به عفونتها تأثیر بگذارند.
- موسیین 19 عمدتاً در دستگاه تنفسی زمانی که با HMPV آلوده میشود بیان میشود.
- موسیین 19 پاسخ ایمنی به HMPV و پاتوژنز ناشی از HMPV را فعال میکند.
التهاب
- عفونت HMPV باعث آزادسازی کمیکاینها و سایتوکاینها میشود که منجر به نفوذ سلولهای ایمنی و التهاب میشود.
- عفونت HMPV تغییرات التهابی ریه را در موشهای BALB/c و رتهای پنبهای القا کرده و باعث افزایش سطح اینترلوکینها (IL-2، IL-8، IL-4)، اینترفرون (IFN-α)، پروتئین التهابی ماکروفاژ 1α و پروتئینهای شیمیوتاکتیک مونوسیت در مایع شستشوی برونکوآلوئولار و ریهها میشود.
- این تغییرات باعث نفوذ و التهاب پیرامون رگها و پیرامون برونشیولها میشود.
آسیب بافتی
- اثرات سیتوپاتیک ویروسی منجر به آسیب به اپیتلیوم تنفسی میشود.
- تشکیل ماکروفاژهای حاوی فوم و هموسیدرین داخل آلوئولی، سلولهای محو، آسیب به آلوئولها و بیماری غشای هیالین در عفونت HMPV مشاهده میشود.
بازیابی
- سیستم ایمنی بدن در نهایت عفونت را کنترل کرده و پاکسازی میکند.
- در برخی موارد، عفونت میتواند در افرادی که عوامل خطر دارند، شدیدتر باشد. در این حالت، بهبود ممکن است طولانیتر شود.
تظاهرات بالینی عفونت HMPV
ویروس متاپنوموویروس انسانی (HMPV) باعث عفونتهای دستگاه تنفسی فوقانی و بیماریهای دستگاه تنفسی تحتانی میشود. تظاهرات بالینی HMPV بستگی به عوامل مختلفی مانند سن، شرایط سلامتی و وضعیت ایمنی افراد دارد.
عفونتهای دستگاه تنفسی فوقانی
- سرفه مزمن همراه با تولید مخاط
- آبریزش بینی یا گرفتگی بینی
- درد گلو
- تب ملایم تا متوسط، سردرد
- احساس خستگی یا کسالت
عفونتهای دستگاه تنفسی تحتانی
- خس خس سینه: صدای سوت تیز هنگام تنفس
- تنگی نفس یا مشکل در تنفس
- کشش قفسه سینه
- تشدید آسم و COPD :HMPV شدت آسم و COPD را افزایش میدهد
تظاهرات بالینی شدید
- برونشیولیت (Bronchiolitis): این یک عفونت شایع ریه است که توسط ویروسها در کودکان و نوزادان ایجاد میشود. در این حالت، التهاب راههای هوایی کوچک (برونکوئیولها) در ریهها رخ میدهد که باعث مشکل در تنفس میشود. این بیماری باعث تورم و تولید مخاط در برونکوئیولها میشود.
- برونشیت (Bronchitis): این التهاب راههای هوایی در ریهها (پوشش لولههای برونشیال) است. این بیماری میتواند حاد یا مزمن باشد.
- پنومونی (Pneumonia): این التهاب ریهها است که بر روی کیسههای هوایی کوچک به نام آلوئول تأثیر میگذارد. کیسههای هوایی با مخاط یا چرک پر میشوند.
عفونتهای ثانویه
- بیماریهای سیستم عصبی مرکزی: برخی مطالعات نشان دادهاند که عفونت HMPV میتواند باعث بیماریهای سیستم عصبی مرکزی (CNS) مانند تشنج و انسفالیت شود (John C Arnold et al. 2009).
- اتیت میانه: یک مطالعه نشان میدهد که 50٪ از کودکان مبتلا به عفونت HMPV تشخیص اتیت میانه دریافت کردهاند (John V Williams et al. 2007).
تشخیص ویروس متاپنوموویروس انسانی (HMPV)
تشخیص معمولاً از طریق معاینه فیزیکی، تاریخچه بیمار و آزمایشهای آزمایشگاهی انجام میشود. آزمایشهای آزمایشگاهی برای تأیید وجود ویروس متاپنوموویروس انسانی (HMPV) در بدن انجام میشوند.
- ارزیابیهای بالینی
- ارزیابی عوامل خطر: گرفتن تاریخچه سلامت بیمار.
- ارزیابی علائم: برخی از علائم مانند سرفه، تب، احتقان بینی و تنگی نفس برای اهداف اولیه بررسی میشوند.
- آزمایشهای آزمایشگاهی
-
- نمونهبرداری
نمونهها از دستگاه تنفسی فوقانی (معمولاً از بینی یا گلو) با استفاده از مکش جمعآوری میشوند. در صورت شرایط شدید، شستشوی برونکوآلوئولار یا برونکوسکوپی ممکن است انجام شود. - کشت ویروس
خطوط سلولی مختلفی مانند سلولهای Vero، HEp-2، Hep G2، 293 و LLC-MK2 برای رشد و جداسازی HMPV استفاده میشوند.
- نمونهبرداری
- شناسایی آنتیژن
آنتیژن HMPV با استفاده از آنتیبادی ضد-HMPV در آزمایشهای ایمونوفلورسانس مستقیم یا ELISA شناسایی میشود. این روش حساسیت کمتری نسبت به روشهای مولکولی مانند PCR دارد.
-
- تشخیص مولکولی
تکنیکهای PCR مانند واکنش زنجیرهای پلیمراز رونویسی معکوس (RT-PCR)، RT-PCR واقعیزمان و RT-PCR چندگانه (mRT-PCR) میتوانند برای تشخیص دقیق HMPV استفاده شوند. mRT-PCR مزیت بیشتری نسبت به آزمایشهای ایمونوفلورسانس دارد، زیرا میتواند عفونتهای مشترک غیرقابل شناسایی را حتی با بار ویروسی پایین شناسایی کند. - رادیوگرافی قفسه سینه
رادیوگرافی قفسه سینه ممکن است به شناسایی هایپراعتفاع، ضخیم شدن پریبرونکوئیولار یا نفوذهایی که نشاندهنده برونکوئیولیت یا پنومونی است، کمک کند.
- تشخیص مولکولی
درمان ویروس HMPV
- در حال حاضر، هیچ درمان ضدویروسی خاصی برای درمان HMPV وجود ندارد.
- درمان بر تسکین علائم و ارائه مراقبتهای حمایتی متمرکز است.
- افراد مبتلا میتوانند از داروهای بدون نسخه مانند مسکنها، ضداحتقانها و ضدسرفهها استفاده کنند.
- داروهایی مانند استامینوفن یا ایبوپروفن میتوانند برای کاهش تب و تسکین دردهای بدنی استفاده شوند.
- اگر مشکل تنفسی داریم، میتوان از درمان اکسیژن استفاده کرد.
- میتوان از دستگاه مرطوبکننده هوا استفاده کرد یا دوش آب گرم گرفت تا گلودرد و سرفه تسکین یابد و همچنین مایعات زیادی برای هیدراته نگه داشتن بدن نوشید.
- مایعات IV میتوانند برای هیدراته نگه داشتن بدن استفاده شوند.
- استروئیدها میتوانند التهاب را کاهش دهند و ممکن است برخی از علائم را تسکین دهند.
- بیشتر افراد در عرض 7 تا 10 روز از عفونت HMPV بهبود مییابند.
- با این حال، برخی از مطالعات در مورد امکان استفاده از ریباویرین، ایمونوگلوبولین، مهارکنندههای همجوشی و RNAهای کوچک مداخلهگر برای درمان و کنترل عفونت HMPV انجام شده است (Swagatika Panda et al. 2014).
آیا به آنتیبیوتیک برای درمان عفونت HMPV نیاز داریم؟
نه، نیازی به استفاده از آنتیبیوتیک برای درمان عفونت HMPV نداریم. از آنجا که آنتیبیوتیکها فقط برای باکتریها موثر هستند، برای ویروس متاپنوموویروس انسانی (HMPV) کارایی ندارند. اما اگر فرد به طور همزمان دچار پنومونی باکتریایی (عفونت ثانویه) شود، آنتیبیوتیکها میتوانند برای درمان هرگونه عفونت ثانویه مانند پنومونی باکتریایی تحت نظر پزشک استفاده شوند.
واکسنها برای عفونت HMPV
- در حال حاضر، تا ژانویه 2025، هیچ واکسن خاصی برای پیشگیری از HMPV وجود ندارد.
- چندین کاندیدای واکسن علیه HMPV در مدلهای حیوانات جونده و نخستیهای غیرانسان آزمایش شدهاند (Marie-Ève Hamelin et al. 2007).
- برخی از واکسنها و آزمایشات بالینی که در حال توسعه هستند به شرح زیر هستند:
- واکسن مبتنی بر mRNA، mRNA-1653 از مدرنا (https://trials.modernatx.com/study/?id=mRNA-1653-P102)
- mRNA-1345 و mRNA-1365 از مدرنا (https://trials.modernatx.com/study/?id=mRNA-1365-P101)
- ALVR106: درمان T سل چندویروسی از آلوریر (https://clinicaltrials.gov/study/NCT04933968)
پیشگیری و کنترل عفونت HMPV
- شستن دستها به طور صحیح و مکرر.
- اجتناب از لمس چشمها، بینی یا دهان با دستان نشسته.
- اجتناب از تماس نزدیک با افرادی که بیمار هستند.
- پوشاندن دهان و بینی هنگام سرفه و عطسه.
- استفاده از ماسک بینی و دهان.
- اجتناب از به اشتراک گذاشتن فنجانها و وسایل با دیگران.
- تمیز کردن و ضدعفونی کردن سطوح.
- در صورت بیماری، در خانه بمانید.
- مراکز بهداشتی باید دستورالعملهای پیشگیری و کنترل عفونت را برای مدیریت بیماران مشکوک یا تایید شده به HMPV دنبال کنند.
- مقامات بهداشتی عمومی باید فعالیتهای HMPV را نظارت کرده و اطلاعات به موقع به عموم مردم ارائه دهند.

جدول اطلاعات ویروس HMPV
| ویژگی | ویروس متاپنوموویروس انسانی (HMPV) | ویروس SARS-CoV-2 |
| خانواده ویروسی | پارامیکسوویریدی | کوروناویرایدی |
| اندازه | 150–600 نانومتر (nm) | 60-140 نانومتر (nm) |
| ساختار ژنتیکی | RNA تکرشتهای با قطبیت منفی (-ssRNA) | RNA تکرشتهای با قطبیت مثبت (+ssRNA) |
| انتقال | عمدتاً از طریق قطرات تنفسی؛ تماس با سطوح آلوده. | عمدتاً از طریق قطرات تنفسی، آئروسولها و تماس با سطوح آلوده. |
| دوره نهفتگی | تقریباً 3-6 روز. | تقریباً 2-14 روز. |
| علائم | ملایم: آبریزش بینی، گلودرد، سرفه، تب. متوسط: سرفه مداوم، خسخس سینه، خستگی. شدید: برونشیت، برونکوئیولیت، پنومونی، بهویژه در نوزادان، بزرگسالان مسن و افراد با سیستم ایمنی ضعیف. | ملایم تا متوسط: تب، سرفه خشک، خستگی، از دست دادن حس چشایی یا بویایی. شدید: مشکل در تنفس، درد قفسه سینه، سردرگمی؛ میتواند منجر به سندرم دیسترس تنفسی حاد (ARDS) و نارسایی چند ارگان، بهویژه در بزرگسالان مسن و افراد با شرایط سلامتی زمینهای شود. |
| شدت | معمولاً ملایم تا متوسط؛ موارد شدید میتواند در گروههای پرخطر رخ دهد. | از بدون علامت تا شدید؛ خطر ابتلا به بیماری شدید و مرگومیر نسبت به HMPV بیشتر است. |
| فصلگذاری | شیوعهای اولیه در زمستان؛ امواج بعدی در طول سال رخ میدهد. | شیوعهای اولیه در زمستان؛ امواج بعدی در طول سال رخ داده است. |
| تشخیص | واکسن خاصی در حال حاضر موجود نیست؛ تحقیقات در حال انجام است. | – آزمایش RT-PCR
–آزمایشهای آنتیژن –سرولوژی برای آنتیبادیها. |
| درمان | مراقبت حمایتی؛ درمان ضدویروسی خاصی موجود نیست. | – موارد ملایم: مراقبت حمایتی
– موارد شدید: ستری شدن، درمان با اکسیژن، درمانهای ضدویروسی (مانند رمدسیویر)، کورتیکواستروئیدها. |
| واکسنها | چندین واکسن در سطح جهانی توسعه یافته و تجویز شدهاند (مانند واکسنهای mRNA و واکسنهای وکتور ویروسی) | چندین واکسن در سطح جهانی توسعه یافته و تجویز شدهاند (مانند واکسنهای mRNA، واکسنهای وکتور ویروسی) |
| اقدامات پیشگیرانه | – بهداشت دستها
–آداب تنفسی –اجتناب از تماس نزدیک با افراد آلوده –ضدعفونی کردن سطوح. |
–بهداشت دستها
– استفاده از ماسک – فاصلهگذاری فیزیکی –واکسیناسیون – ضدعفونی کردن سطوح. |
| تأثیر جهانی | باعث شیوعهای فصلی میشود و معمولاً تأثیر جهانی کمتری دارد. | از بدون علامت تا شدید: تب، سرفه خشک، خستگی، از دست دادن حس چشایی یا بویایی
شدید: مشکل در تنفس، درد قفسه سینه، سردرگمی؛ میتواند منجر به سندرم دیسترس تنفسی حاد (ARDS) و نارسایی چند ارگان، بهویژه در بزرگسالان مسن و افراد با شرایط سلامتی زمینهای شود. |
همچنین بخوانید:
- ویروس چیست؟ پیدایش، ساختار، زیستگاه، شکل و اندازه
- 28 تفاوت باکتری و ویروس به همراه مثال
- مروری بر ویروس های انکوژنیک
- ویروس زیکا
مترجم: محمد صادق محمودی لرد




