اطلاعات عمومی، دستهبندی نشده
پیوند کووالانسی چیست؟
مقدمه ای بر پیوند کووالانسی
یک پیوند کووالانسی با اشتراک مساوی الکترونها از هر دو اتم شرکتکننده تشکیل میشود. به جفت الکترونهای شرکتکننده در این نوع پیوند، جفت مشترک یا جفت پیوند میگویند. پیوندهای کووالانسی را پیوندهای مولکولی نیز مینامند. اشتراک جفتهای پیوند تضمین میکند که اتمها در لایه بیرونی خود که شبیه اتمهای گازهای نجیب هستند، به آرایش پایدار میرسند.
پیوند کووالانسی چیست؟
عناصری که انرژی یونیزاسیون بسیار بالایی دارند قادر به انتقال الکترون نیستند و عناصری که تمایل پایینی به الکترون دارند هم نمیتوانند الکترون را جذب کنند. اتمهای چنین عناصری تمایل دارند الکترونهای خود را با اتمهای عناصر دیگر یا با اتمهای دیگر همان عنصر به اشتراک بگذارند، به گونهای که هر دو اتم در لایه ظرفیتی مربوطه خود، به کانفیگوراسیون هشتایی رسیده و در نتیجه پایدار میشوند. چنین ارتباطی از طریق اشتراک
جفت الکترون بین انواع مختلف یا یکسان به عنوان پیوند کووالانسی شناخته میشود.

پیوند کووالانسی را میتوان به دو روش به دست آورد:
۱. به اشتراکگذاری الکترونها بین اتمهایی از یک نوع به عنوان مثال؛ تشکیل H2، Cl2، O2 و غیره.
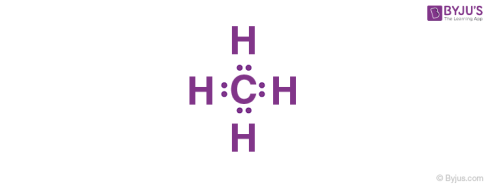
۲. اشتراک الکترونها بین انواع مختلفی از اتمها به عنوان مثال؛ تشکیل CH4، H2O، NH3 و غیره.
پیوند کووالانسی در اتم کربن
با توجه به کانفیگوراسیون الکترونی کربن، برای پایدار شدن باید ۴ الکترون به دست آورد یا از دست بدهد، که غیرممکن به نظر می رسد؛ زیرا:
- کربن نمیتواند ۴ الکترون بگیرد تا C4- ایجاد شود، زیرا برای ۶ پروتون سخت است که ۱۰ الکترون را نگه دارند، بنابراین اتم ناپایدار میشود.
- کربن قادر به از دست دادن ۴ الکترون نیست تا به C4+ تبدیل شود، زیرا برای حذف ۴ الکترون به مقدار زیادی انرژی نیاز دارد و همچنین C4+ تنها ۲ الکترون دارد که توسط پروتون حفظ میشود، که دوباره باعث ناپایداری میگردد.
کربن نمی تواند الکترون بگیرد یا اهدا کند، بنابراین برای رسیدن به نزدیکترین آرایش پایدار گاز نجیب خود، الکترون را به اشتراک میگذارد تا یک پیوند کووالانسی تشکیل دهد.
ویژگیهای پیوند کووالانسی
اگر ظرفیت طبیعی یک اتم با اشتراک یک جفت الکترون منفرد بین اتمها پر نشود، اتم ها ممکن است بیش از یک جفت الکترون را بین خود به اشتراک بگذارند. برخی از خواص پیوند کووالانسی عبارتند از:
- پیوند کووالانسی منجر به تشکیل الکترونهای جدید نمیشود. بلکه پیوند فقط آنها را به صورت جفت درمیآورد.
- آنها پیوندهای شیمیایی بسیار قدرتمندی بین اتمها هستند.
- یک پیوند کووالانسی معمولاً حاوی انرژی حدود ۸۰ کیلوکالری در هر مول (کیلوکالری / مول) است.
- پیوندهای کووالانسی به ندرت پس از تشکیل، خود به خود میشکنند.
- پیوندهای کووالانسی جهتدار هستند که در آن اتمهایی که به یکدیگر متصل میشوند جهت گیریهای خاصی را نسبت به یکدیگر نشان میدهند.
- اکثر ترکیبات دارای پیوند کووالانسی، نقطه ذوب و نقطه جوش نسبتاً کمی دارند.
- ترکیبات با پیوند کووالانسی معمولاً آنتالپی تبخیر و همجوشی کمتری دارند.
- ترکیباتی که به وسیله پیوند کووالانسی تشکیل میشوند، به دلیل فقدان الکترونهای آزاد، الکتریسیته را هدایت نمیکنند.
- ترکیبات کووالانسی در آب محلول نیستند.
قانون Octet یا هشتایی چیست؟
همه اتمها به جز گازهای نجیب کمتر از هشت الکترون در لایه ظرفیت خود دارند. به عبارت دیگر، لایههای ظرفیت این اتمها آرایش پایدار ندارند. بنابراین، آنها با هم یا با اتمهای دیگر ترکیب میشوند تا به آرایش الکترونی پایدار خود برسند.
از این رو، «تمایل اتمهای عناصر مختلف برای دستیابی به آرایش پایدار هشتایی الکترونها در لایه ظرفیتی خود دلیل ترکیب شیمیایی است» و «اصل رسیدن به حداکثر هشت الکترون در لایه ظرفیتی اتمها قانون هشتگانه یا هشتایی یا اکتت نامیده میشود.»
لوئیس نمادهای سادهای را برای نشان دادن الکترونهای موجود در لایه بیرونی اتم به نام الکترونهای ظرفیت معرفی نمود. این نمادها به نمادهای نقطه الکترون و ساختار ترکیب به نام ساختار نقطه لوئیس معروف هستند.
شرایط رسم ساختارهای نقطه لوئیس
- اشتراک یک جفت الکترون بین اتمها منجر به تشکیل پیوندهای کووالانسی میشود.
- در طول تشکیل پیوند، هر پیوند از دو الکترون تشکیل شده است که هر یک از الکترونها توسط اتمهای درگیر در پیوند تشکیل شدهاند.
- با اشتراک متقابل الکترونها، هر اتم در لایه ظرفیت خود به آرایش هشتایی میرسد.
ساختارهای نقطهای الکترونی مولکولهای کووالانسی با توجه به قانون هشتایی رسم میشوند. طبق این قانون، تمام اتمهای موجود در مولکول دارای هشت الکترون در لایه ظرفیت خود هستند به جز اتم هیدروژن. هیدروژن تنها دو الکترون خواهد داشت زیرا تنها دو الکترون اولین لایه خود را برای رسیدن به آرایش پایدار هلیوم کامل میکنند.
بنابراین عناصر گروه ۱۷ مانند کلر یک الکترون مشترک دارند تا به اکتت پایدار دست یابند. عناصر گروه ۱۶مانند O و S دو الکترون مشترک دارند. عناصر گروه ۱۵ هم به سه الکترون نیاز دارند و غیره.
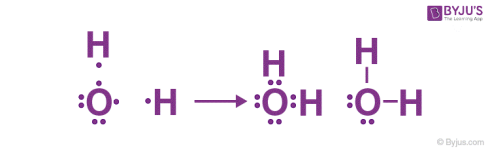
به عنوان مثال، اتم اکسیژن که دارای شش الکترون در لایه ظرفیتی خود است، آرایش هشتایی خود را با به اشتراک گذاشتن دو الکترون خود با دو اتم هیدروژن برای تشکیل یک مولکول آب کامل میکند.
انواع پیوندهای کووالانسی
بسته به تعداد جفت الکترونهای به اشتراک گذاشته شده، انواع پیوند کووالانسی را میتوان به موارد زیر طبقهبندی کرد:
- پیوند کووالانسی یگانه
- پیوند کووالانسی دوگانه
- پیوند کووالانسی سه گانه
پیوند کووالانسی یگانه

پیوند یگانه زمانی تشکیل میشود که فقط یک جفت الکترون بین دو اتم شرکتکننده به اشتراک گذاشته شود. با یک خط تیره (-) نشان داده میشود. اگرچه این شکل از پیوند کووالانسی چگالی کمتری دارد و ضعیفتر از پیوند دوگانه و سهگانه است، اما پایدارترین است.
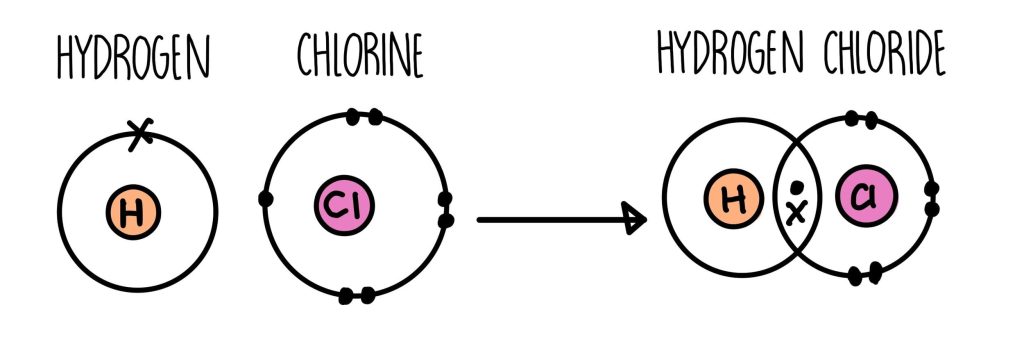
به عنوان مثال، مولکول HCL دارای یک اتم هیدروژن با یک الکترون لایه ظرفیت و یک اتم کلر با هفت الکترون لایه ظرفیت است. در این حالت یک پیوند یگانه بین هیدروژن و کلر با اشتراکگذاری یک الکترون تشکیل میگردد.
پیوندهای دوگانه
پیوند دوگانه زمانی تشکیل میگردد که دو جفت الکترون بین دو اتم شرکتکننده به اشتراک گذاشته شود. با دو خط تیره (=) نشان داده میشود. پیوندهای کووالانسی دوگانه بسیار قویتر از پیوند یگانه هستند، اما پایداری کمتری دارند.
مثال: مولکول دیاکسیدکربن، یک اتم کربن با شش الکترون ظرفیت و دو اتم اکسیژن با چهار الکترون ظرفیت دارد. کربن برای تکمیل آرایش اکتت خود، دو الکترون ظرفیت خود را با یک اتم اکسیژن و دو الکترون با اتم اکسیژن دیگر به اشتراک میگذارد. هر اتم اکسیژن، دو الکترون خود را با کربن به اشتراک میگذارد و بنابراین دو پیوند دوگانه در CO2 وجود دارد.
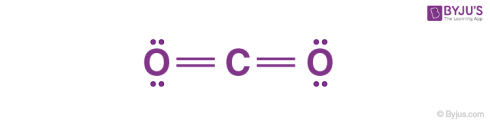
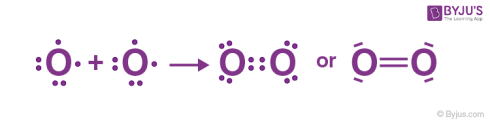
مولکول اکسیژن: در تشکیل مولکول اکسیژن، هر اتم اکسیژن دارای شش الکترون در لایه ظرفیت خود است. هر اتم برای تکمیل حالت اکتت خود به دو الکترون دیگر نیاز دارد. بنابراین اتمها هر کدام دو الکترون به اشتراک گذاشته تا مولکول اکسیژن را تشکیل دهند. از آنجایی که دو جفت الکترون به اشتراک گذاشته شدهاند، یک پیوند دوگانه بین دو اتم اکسیژن تشکیل میگردد.
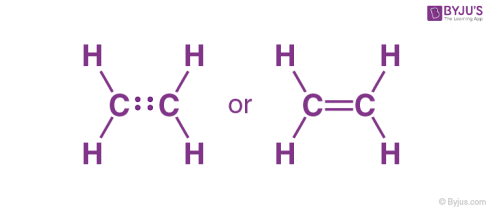
مولکول اتیلن: در اتیلن، هر اتم کربن دو الکترون ظرفیت خود را با دو اتم هیدروژن و دو الکترون باقیمانده را با اتم کربن دیگر به اشتراک میگذارد. بنابراین یک پیوند دوگانه بین اتمهای کربن تشکیل میشود.
پیوند سه گانه
پیوند سه گانه زمانی تشکیل میشود که سه جفت الکترون بین دو اتم شرکتکننده به اشتراک گذاشته شود. پیوندهای کووالانسی سه گانه با سه خط تیره (≡) نشان داده شده و ناپایدارترین نوع پیوندهای کووالانسی هستند. مثلاً:
در تشکیل یک مولکول نیتروژن، هر اتم نیتروژن با داشتن پنج الکترون لایه ظرفیت، سه الکترون را برای تشکیل سه جفت الکترون به اشتراک میگذارند. بنابراین، یک پیوند سه گانه بین دو اتم نیتروژن تشکیل میشود.

پیوند کووالانسی قطبی
این نوع پیوند کووالانسی در جایی تشکیل میشوند که اشتراک نابرابر الکترونها به دلیل تفاوت در الکترونگاتیوی اتمهای شرکت کننده در پیوند وجود دارد. اتم الکترونگاتیوتر، کشش قویتری برای الکترونها خواهد داشت. اختلاف الکترونگاتیو بین اتمها بیشتر از صفر و کمتر از ۲.۰ است. در نتیجه، جفت الکترونهای به اشتراک گذاشته شده به آن اتم نزدیکتر خواهند شد.
به عنوان مثال، مولکولها در نتیجه وجود پتانسیل الکترواستاتیک نامتعادل، پیوند هیدروژنی تشکیل میدهند. در این حالت، اتم هیدروژن با اتم الکترونگاتیو فلوئور، هیدروژن یا اکسیژن برهمکنش میکند.
پیوند کووالانسی غیرقطبی
این نوع پیوند کووالانسی زمانی تشکیل میگردد که بین اتمها سهم یکسانی از الکترونها وجود داشته باشد. اختلاف الکترونگاتیوی بین دو اتم صفر است. هر جا که اتمهای ترکیب شونده میل الکترونی مشابهی داشته باشند (عناصر دو اتمی) رخ میدهد.
به عنوان مثال، پیوند کووالانسی غیرقطبی در مولکولهای گاز مانند گاز هیدروژن، گاز نیتروژن و غیره یافت میشود.
قطبیت پیوندهای کووالانسی
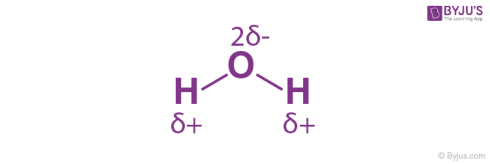
مشاهده شده که در پیوندهای سیگما بین دو اتم مختلف، ابر الکترونی همیشه به اتم (شرکتکننده در پیوند) با الکترونگاتیوی بیشتر نزدیکتر است. به همین دلیل یک دوقطبی دائمی در پیوند ایجاد شده و یک پیوند کووالانسی قطبی تشکیل شده است.
تصویری که قطبیت پیوندهای کووالانسی در یک مولکول آب را توصیف میکند در بالا ارائه شده است. گفته شده که اتم با الکترونگاتیوی بیشتر دارای بار جزئی منفی و اتم با الکترونگاتیوی کمتر دارای بار جزئی مثبت در پیوند کووالانسی قطبی است.
تفاوت بین پیوندهای کووالانسی و یونی
پیوندهای کووالانسی در مقابل پیوندهای یونی
پیوندهای کووالانسی و پیوندهای یونی از انواع پیوندهای اتمی هستند. این پیوندها از نظر خواص و ساختار متفاوت میباشند. پیوندهای کووالانسی شامل جفت الکترونهایی است که توسط دو اتم، در یک جهت ثابت به هم متصل میشوند. در حالی که پیوند بین دو یون را پیوند یونی مینامند.
پیوند کووالانسی بین دو اتم غیرفلزی رخ میدهد که با اشتراکگذاشتن جفت الکترون بین اتمها و سایر پیوندهای کووالانسی با اختلاف الکترونگاتیوی بیشتر از ۲.۰ (<۲.۰) مشخص میگردد. در صورت تشکیل پیوند کووالانسی، یونهای چند اتمی تشکیل میشوند. در حالی که پیوند یونی در نتیجه جاذبه الکترواستاتیکی بین یونهای دارای بار مخالف تشکیل میگردد.
پیوندهای کووالانسی در مقابل پیوندهای یونی
| پیوندهای یونی | پیوندهای کووالانسی |
| این نوع پیوند بین فلز و نافلز ایجاد میشود. | یک پیوند کووالانسی بین دو نافلز الکترونگاتیو مشابه تشکیل میشود. |
| پیوندهای یونی شکل مشخصی ندارند. |
پیوندهای تشکیل شده از پیوند کووالانسی شکل معینی دارند. |
| نقطه ذوب و نقطه جوش بالا | نقطه ذوب و نقطه جوش پایین |
| قطبیت بالا و اشتعالپذیری کمتر | قطبیت کم و قابلیت اشتعالپذیری بالا |
| در دمای اتاق، پیوندهای یونی حالت جامد دارند. | پیوندهای کووالانسی در دمای اتاق در حالت مایع یا گاز هستند. |
| مثال: کلرید سدیم، اسید سولفوریک | مثال: متان، اسید هیدروکلریک |
وجود پیوند بین دو عنصر را می توان با محاسبه مقدار الکترونگاتیویته بین دو اتم تعیین نمود.
| میزان الکترونگاتیویته | نوع پیوند |
| ۱.۹-۰.۵ | پیوند کووالانسی قطبی |
| ۰.۴-۰ | پیوند کووالانسی غیرقطبی |
| ۴-۲.۴ | پیوند یونی |
حل مسئله:
۱. کدام یک از ترکیبات زیر دارای پیوند کووالانسی و یونی است؟
- NaOH
- NaBr
- NaNC
- NaCN
پاسخ: گزینه c، یک پیوند کووالانسی بین اتم N و C و پیوند یونی بین یون Na+ و یون NC– وجود دارد.
۲. یک پیوند شیمیایی بین دو اتم که در یک جفت الکترون مشترک است…
- پیوند یونی
- پیوند یگانه
- پیوند دوگانه
- پیوند سه گانه
پاسخ: گزینه b

۳. کدام یک از ترکیبات زیر دارای پیوند کووالانسی قطبی و غیرقطبی است؟
- NH4Br
- H2O2
- CH4
- HF
پاسخ: گزینه b، در H2O2، اختلاف الکترونگاتیوی بین اتم o و H ۱.۴ است، پیوند O – H قطبی است. اختلاف الکترونگاتیوی بین پیوند O و O صفر است، بنابراین پیوند O – O غیرقطبی است.
خلاصه
یک پیوند کووالانسی با اشتراک مساوی الکترونها از هر دو اتم شرکتکننده تشکیل میشود. به جفت الکترونهای شرکتکننده در این نوع پیوند، جفت مشترک یا جفت پیوند میگویند. پیوندهای کووالانسی را پیوندهای مولکولی نیز مینامند.
همچنین بخوانید:
منابع