تکنیک ها
تست لیزین آیرون آگار (تست LIA): روش، کاربردها و تفسیر
مقدمهای بر تست LIA
لیزین آیرون آگار (LIA)، ارگانیسمها را به منظور شناخت توانایی دآمینه کردن لیزین یا دکربوکسیلات لیزین آزمایش میکند. دآمیناسیون لیزین یک فرایند هوازی است که در اسلنت محیط رخ میدهد. لیزین دکربوکسیلاسیون یک فرایند بی هوازی است که در عمق و قسمت پایین محیط (بات) رخ میدهد.
اساس تست لیزین آیرون آگار
لیزین آیرون آگار حاوی لیزین، پپتون، مقدار کمی گلوکز، سیترات آمونیوم فریک و تیوسولفات سدیم است. محیط دارای اسلنت هوازی و بات بی هوازی است.
هنگامی که گلوکز تخمیر میشود، بات محیط (قسمت عمیق)، اسیدی (زرد) میشود. اگر ارگانیسم لیزین دکربوکسیلاز تولید کند، کاداورین تشکیل میشود. کاداورین اسیدهای آلی تشکیل شده در اثر تخمیر گلوکز را خنثی میکند و قسمت بات محیط به حالت قلیایی (بنفش) باز میگردد.
اگر دکربوکسیلاز تولید نشود، بات اسیدی (زرد) باقی میماند. اگر دآمیناسیون اکسیداتیو لیزین اتفاق بیفتد، ترکیبی تشکیل میشود که در حضور سیترات آمونیوم فریک و یک کوآنزیم، فلاوین مونوکلئوتید، رنگ شرابی بر روی اسلنت ایجاد میکند. اگر دآمیناسیون رخ ندهد، اسلنت LIA ، بنفش باقی میماند. بروموکرزول بنفش یک نشانگر pH است و در pH 5.2 یا کمتر به رنگ زرد و در pH 6.8 یا بالاتر به رنگ بنفش است.

محیط کشت تست لیزین آیرون آگار
لیزین آیرون آگار یا LIA ، یک محیط متمایز است که برای تشخیص و تمایز باکتریهایی که قادر به کربوکسیله کردن لیزین و یا تولید سولفید هیدروژن هستند از سایر باکتریها استفاده میشود.
هضم آنزیمی ژلاتین (۵ گرم)، عصاره مخمر (۳ گرم)، دکستروز (۱ گرم)، ال – لیزین (۱۰ گرم)، سیترات آمونیوم آهن (۰٫۵ گرم)، تیوسولفات سدیم (۰٫۰۴ گرم)، بروموکرزول بنفش (۰٫۰۲ گرم) آگار (۱۳٫۵ گرم)، در ۱۰۰۰ میلی لیتر، pH 6.7 .
پپتون و عصاره مخمر مواد مغذی ضروری را فراهم میکنند. دکستروز منبع کربوهیدرات قابل تخمیر است. سیترات آمونیوم فریک و تیوسولفات سدیم شاخصهای تشکیل H2S هستند. در کشتهایی که سولفید هیدروژن تولید میشود، تولید سولفید آهن باعث سیاه شدن محیط میشود.
روش تست لیزین آیرون آگار
- محیط کشت لولهای، استریل و شیبدار است بهطوریکه یک اسلنت (شیب) کوتاه و بات عمیق تشکیل میشود.
- با یک سوزن مستقیم تلقیح، LIA را با دو بار ضربه زدن از مرکز محیط به پایین لوله و سپس رگه زدن اسلنت تلقیح کنید.
- لوله را محکم ببندید و در دمای ۳۵-۳۷ درجه سانتیگراد در هوای محیط به مدت ۱۸ تا ۲۴ ساعت انکوبه کنید.
- بین ۱۸ تا ۲۴ و ۴۰ تا ۴۸ ساعت، رشد و تغییرات رنگ در بات و اسلنت لوله و سیاه شدن رأس اسلنت را بررسی کنید.
نتایج مورد انتظار
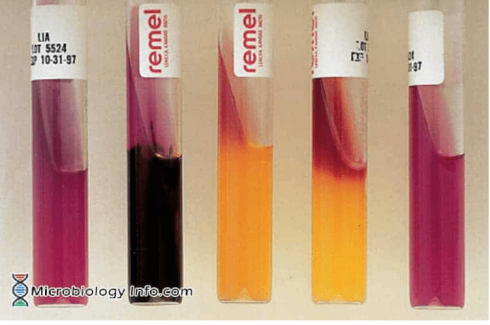
لیزین آیرون آگار (LIA)
A: اسلنت قلیایی / بات قلیایی (K/K)
B: اسلنت قلیایی / بات قلیایی، H2S مثبت(K/K H2S+)
C: اسلنت قلیایی / بات اسیدی (K/A)
D: اسلنت قرمز/ بات اسیدی (R/A)
E: لوله بدون تلقیح
لیزین دکربوکسیلاسیون (تشخیص داده شده در بات):
تست مثبت: اسلنت بنفش/ بات بنفش (قلیایی)، واکنش بات ممکن است با تولید H2S پوشانده شود.
تست منفی: اسلنت بنفش/بات زرد (اسید)، فقط تخمیر گلوکز
دآمیناسیون لیزین (تشخیص داده شده در اسلنت):
تست مثبت: اسلنت قرمز
تست منفی: اسلنت بنفش باقی میماند
تولید H2S:
تست مثبت: رسوب سیاه
تست منفی: بدون ایجاد رنگ سیاه
تولید گاز: با وجود حباب یا ترک در محیط نشان داده میشود
کاربردهای تست LIA
- این آزمایش به جهت تمایز باسیلهای گرم منفی بر اساس دکربوکسیلاسیون یا دآمیناسیون لیزین و تشکیل سولفید هیدروژن (H2S) استفاده میشود.
- از یک محیط حساس برای تشخیص سالمونلاهای تخمیر کننده لاکتوز و غیر تخمیرکننده لاکتوز استفاده میکند.
- لیزین آیرون آگار در روشهای استاندارد برای آزمایش سالمونلا در نظر گرفته شده است.
محدودیتهای تست LIA
- توصیه میشود برای شناسایی کامل، آزمایشات بیوشیمیایی، ایمونولوژیکی، مولکولی یا طیف سنجی جرمی روی کلنیهای حاصل از کشت خالص انجام شود.
- ضربه و تلقیح قسمت بات محیط کشت امر مهمی است. عدم این کار موجب ابطال این آزمایش میشود.
- LIA در تشخیص سولفید هیدروژن در مقایسه با سایر محیطهای حاوی آهن، مانند سولفید ایندول متحرک (SIM) و TSIA ، چندان حساس نیست.
- Proteus sp. که سولفید هیدروژن تولید میکند، محیط را سیاه نمیکند.
- گونهها یا سویههای خاصی ممکن است واکنشهای تأخیری ایجاد کنند یا به طور کامل در تخمیر کربوهیدرات به روش ذکر شده موفق نباشند.
- تولید گاز با ارگانیسمهایی غیر از سیتروباکتر، ممکن است نامنظم یا متوقف شود.
مطالعه بیشتر:
آگار ستریماید (Cetrimide Agar): ترکیب، اساس، کاربردها، آماده سازی و مورفولوژی کلنی
تست کلیگر آیرون آگار (تست KIA): اساس، محیط کشت، روش، نتایج، موارد استفاده
مترجم: مریم محجوب




سلام خسته نباشید من چند روز پیش یک باکتری داشتم و روی افتراقی بردم شیب و عمق لایزین زرد رنگ بود البته بدون گاز و سولفید هیدروژن تا به حال همچین موردی ندیدم اگر امکان دارد راهنمایی بفرمایید ممنون
نتایج شیب و عمق زرد بدون تولید گاز و H2S در محیط لایزین آیرون آگار نشاندهنده تخمیر گلوکز است، اما برای شناسایی دقیقتر باکتری نیاز به تستهای بیوشیمیایی بیشتر و مشاوره با متخصص میکروبشناسی دارید.
محیط لیزین دکربوکسیلازآگار،آیا نیاز به پارافین داره
بله روی محیط باید با حداقل یک میلی لیتر روغن استریل پوشانده بشه
ممنون از شما ،موفق و پیروز باشید
منظور از بات در اینجا چیست
سلام،
همانطور که در مطلب ذکر شده:
لیزین دکربوکسیلاسیون یک فرایند بی هوازی است که در عمق و قسمت پایین محیط (بات) رخ میدهد.
منظور از بات عمق و قسمت پایین محیط است
سلام
خداقوت
دلیل ایجاد رنگ قرمز روی زرد در محیط کشت لیزین آیرون آگار چیست؟
سلام،
به دلیل تولید آمونیاک و قلیایی شدن محیط کشت است