مقدمهای بر لوسمی حاد میلوئیدی یا AML
سرطان زمانی شروع میشود که سلولها در بخشی از بدن شروع به رشد خارج از کنترل میکنند. انواع مختلفی از سرطان وجود دارد. سلولهای تقریباً در هر قسمت از بدن میتوانند به سرطان تبدیل شوند.
لوسمیها (Leukemias) سرطانهایی هستند که از سلولهایی شروع میشوند که به طور معمول به انواع مختلف سلولهای خونی تبدیل میشوند. اغلب، لوسمی در اشکال اولیه گلبولهای سفید (white blood cells) شروع میشود اما برخی از لوسمیها در انواع دیگر سلولهای خونی هم آغاز میشوند. انواع مختلفی از لوسمی وجود دارد که عمدتاً بر اساس حاد بودن (سریع الرشد بودن) یا مزمن (رشد کندتر) و اینکه در کدام یک از سلولهای میلوئیدی یا سلولهای لنفاوی شروع میشوند، تقسیم میگردند.
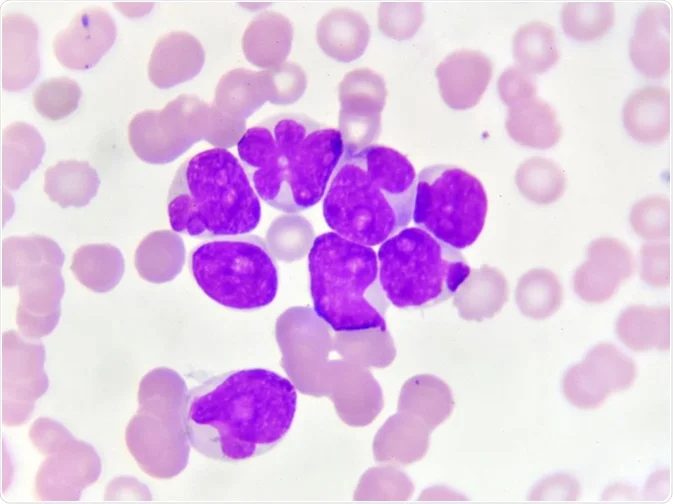
لوسمی حاد میلوئیدی (AML) از مغز استخوان (بخش داخلی نرم برخی از استخوانها، جایی که سلولهای خونی جدید ساخته میشود) شروع میشود اما اغلب به سرعت به داخل خون نیز منتقل میشود. این نوع سرطان گاهی اوقات میتواند به سایر قسمتهای بدن از جمله غدد لنفاوی، کبد، طحال، سیستم عصبی مرکزی (مغز و نخاع) و بیضهها نیز سرایت کند.
اغلب، AML از سلولهایی که به گلبولهای سفید (غیر از لنفوسیتها) تبدیل میشوند، ایجاد میشود اما گاهی اوقات AML در انواع دیگر سلولهای خون ساز نیز بوجود میآید. انواع مختلف AML در زیرگروههای لوسمی میلوئیدی حاد (AML) و عوامل موثر در آینده بیمار مورد بحث قرار گرفته است.
لوسمی حاد میلوئیدی (AML) نامهای بسیار دیگری نیز دارد؛ از جمله لوسمی حاد میلوسیتی (acute myelocytic leukemia)، لوسمی حاد میلوژن (acute myelogenous leukemia)، لوسمی حاد گرانولوسیتی (acute granulocytic leukemia) و لوسمی حاد غیر لنفوسیتی (acute non-lymphocytic leukemia).
مغز استخوان، خون و بافت لنفاوی طبیعی
برای درک لوسمی، دانستن اطلاعاتی در مورد خون و سیستم لنفاوی به شما کمک میکند.
مغز استخوان (Bone marrow)
مغز استخوان بخش داخلی نرم برخی از استخوانها است. از سلولهای خون ساز، سلولهای چربی و بافتهای حمایت کننده تشکیل شده است. بخش کوچکی از سلولهای سازنده خون را سلولهای بنیادی خون (blood stem cells) تشکیل میدهند.
در داخل مغز استخوان، سلولهای بنیادی خون به سلولهای خونی جدید تبدیل میشوند. در طی این فرآیند، سلولها یا به لنفوسیت (نوعی گلبول سفید) یا سایر سلولهای خون ساز تبدیل میشوند که از انواع سلولهای میلوئیدی (myeloid cells) هستند. سلولهای میلوئیدی میتوانند به گلبولهای قرمز، گلبولهای سفید (به غیر از لنفوسیتها) یا پلاکت تبدیل شوند. این سلولهای میلوئیدی آنهایی هستند که در AML به شکلی غیر طبیعی هستند.
انواع سلولهای خونی
3 نوع اصلی سلولهای خونی وجود دارد:
- گلبولهای قرمز خون (RBCs) اکسیژن را از ریهها به تمام بافتهای دیگر بدن حمل میکنند و دی اکسید کربن را به ریهها برمیگردانند تا از بدن خارج شود.
- پلاکتها در واقع قطعات سلولی هستند که توسط نوعی سلول مغز استخوان به نام مگاکاریوسیت (megakaryocyte) ساخته میشوند. پلاکتها در توقف خونریزی مهم هستند. آنها به بستن منافد رگهای خونی ناشی از بریدگی یا کبودی کمک میکنند.
- گلبولهای سفید (WBC) به بدن در مبارزه با عفونتها کمک میکنند.
WBCها انواع مختلفی دارند:
- گرانولوسیتها WBCهای بالغی هستند که از میلوبلاستها (myeloblasts)، نوعی سلول خون ساز در مغز استخوان، ایجاد میشوند. گرانولوسیتها دارای گرانولهایی هستند که به صورت لکههایی در زیر میکروسکوپ ظاهر میشوند. این گرانولها حاوی آنزیمها و سایر موادی هستند که میتوانند میکروبها مانند باکتریها را از بین ببرند. 3 نوع گرانولوسیت – نوتروفیلها (neutrophils)، بازوفیلها (basophils) و ائوزینوفیلها (eosinophils) – با اندازه و رنگ گرانولهایشان متمایز میشوند.
- مونوسیتها WBCهایی هستند که از مونوبلاستهای خون ساز در مغز استخوان ایجاد میشوند. پس از حدود یک روز گردش خون، مونوسیتها (Monocytes) وارد بافتهای بدن میشوند تا به ماکروفاژ (macrophages) تبدیل شوند که میتواند با احاطه و هضم کردن برخی میکروبها را از بین ببرد. ماکروفاژها همچنین به لنفوسیتها کمک میکنند تا میکروبها را بشناسند و برای مبارزه با آنها آنتی بادی بسازند.
- لنفوسیتها WBCهای بالغی هستند که از لنفوبلاستها در مغز استخوان ایجاد میشوند. لنفوسیتها سلولهای اصلی هستند که بافت لنفاوی – بخش عمدهای از سیستم ایمنی – را تشکیل میدهند. بافت لنفاوی در غدد لنفاوی، تیموس (یک اندام کوچک در پشت استخوان سینه)، طحال، لوزهها و آدنوئیدها (adenoids) یافت میشود و در سراسر سیستم گوارشی و تنفسی و مغز استخوان پراکنده است. 2 نوع اصلی لنفوسیتها سلولهای B و سلولهای T هستند.
آمارهای کلیدی برای لوسمی میلوئید حاد (AML)
برآوردهای انجمن سرطان آمریکا برای لوسمی در ایالات متحده برای سال 2022 عبارتند از:
- حدود 60650 مورد جدید سرطان خون لوسمی ( همه انواع گوناگون) و 24000 مرگ ناشی از سرطان خون لوسمی (همه انواع گوناگون)
- حدود 20050 مورد جدید لوسمی میلوئیدی حاد (AML) که بیشتر در بزرگسالان خواهد بود.
- حدود 11540 مرگ ناشی از AML که تقریباً همه آن در بزرگسالان خواهد بود.
AML یکی از شایع ترین انواع لوسمی در بزرگسالان است. با این حال، AML به طور کلی نسبتاً نادر است و تنها حدود 1 درصد از همه سرطانها را تشکیل میدهد.
AML به طور کلی بیماری افراد مسن است و بروز آن قبل از 45 سالگی غیر معمول است. میانگین سنی افراد در اولین تشخیص AML حدود 68 سال است. اما AML همچنان میتواند در کودکان نیز رخ دهد.
AML در بین مردان کمی بیشتر از زنان شایع است اما میانگین خطر ابتلا به AML در طول زندگی در هر دو جنس حدود نصف 1 درصد است.
علائم و نشانههای لوسمی میلوئید حاد (AML)
لوسمی حاد میلوئیدی (AML) میتواند علائم و نشانههای مختلفی را ایجاد کند. برخی از آنها با انواع خاصی از AML شایع تر هستند.
علائم عمومی
افراد مبتلا به AML اغلب چندین علامت غیر اختصاصی (عمومی) دارند. این موارد میتواند شامل موارد زیر باشد:
- کاهش وزن
- خستگی
- تب
- تعریق شبانه
- از دست دادن اشتها
اینها فقط علائم AML نیستند. اغلب آنها توسط چیزی غیر از سرطان خون ایجاد میشوند.
علائم ناشی از وجود تعداد کم سلولهای خونی
بسیاری از علائم و نشانههای AML نتیجه کمبود سلولهای خونی طبیعی است که زمانی اتفاق میافتد که سلولهای لوسمی، سلولهای خون ساز طبیعی در مغز استخوان را از بین میبرند. در نتیجه، افراد به اندازه کافی گلبولهای قرمز طبیعی، گلبولهای سفید و پلاکت خون ندارند. این کمبودها در آزمایش خون خود را نشان میدهند و همچنین میتوانند علائمی را ایجاد کنند.
علائم کاهش تعداد گلبولهای قرمز خون (کم خونی یا anemia)
گلبولهای قرمز اکسیژن را به تمام سلولهای بدن میرسانند. کمبود گلبولهای قرمز میتواند باعث بروز موارد زیر شود:
- خستگی (fatigue)
- ضعف
- احساس سرما
- احساس سرگیجه یا سبکی سر
- سردرد
- پوست رنگ پریده
- تنگی نفس
علائم کاهش تعداد گلبولهای سفید خون
عفونتها میتوانند به دلیل کمبود گلبولهای سفید طبیعی (لکوپنی یا leukopenia)، به ویژه کمبود گلبولهای سفید ضد عفونت به نام نوتروفیلها (وضعیتی به نام نوتروپنی یا neutropenia) رخ دهند. افراد مبتلا به AML ممکن است به عفونتهایی مبتلا شوند که به نظر از بین نمیروند یا ممکن است یکی پس از دیگری دچار عفونت شوند. تب اغلب همراه با عفونت است.
اگرچه افراد مبتلا به AML ممکن است به دلیل داشتن تعداد زیاد سلولهای سرطانی خون، تعداد گلبولهای سفید خون بالایی داشته باشند اما این سلولها نمیتوانند مانند گلبولهای سفید طبیعی در برابر عفونت از فرد محافظت کنند.
علائم کاهش پلاکت خون
پلاکتها به طور معمول به توقف خونریزی کمک میکنند. کمبود پلاکت خون (به نام ترومبوسیتوپنی یا thrombocytopenia) میتواند منجر به ایجاد موارد زیر شود:
- کبودی (یا لکههای کوچک قرمز یا بنفش) روی پوست
- خونریزی بیش از حد
- خونریزیهای مکرر یا شدید بینی
- خونریزی لثه
- پریودهای سنگین (خونریزی قاعدگی) در زنان
علائم ناشی از تعداد زیاد سلولهای لوسمی
سلولهای سرطانی موجود در AML (به نام بلاست) بزرگتر از گلبولهای سفید معمولی هستند و در عبور از رگهای خونی کوچک مشکل بیشتری دارند. اگر تعداد تجمعات بسیار زیاد شود، این سلولها میتوانند رگهای خونی را مسدود کنند و رسیدن گلبولهای قرمز طبیعی (و اکسیژن) به بافتها را سخت کنند. به این پدیده لکوستاز (leukostasis) میگویند.
لکوستاز نادر است اما یک وضعیت اورژانسی پزشکی است که نیاز به درمان و رسیدگی فوری دارد. برخی از علائم این وضعیت مانند علائمی است که در سکته مغزی مشاهده میشود و عبارتند از:
- سردرد
- ضعف در یک طرف بدن
- لکنت زبان
- گیجی
- خواب آلودگی
هنگامی که رگهای خونی در ریهها تحت تاثیر قرار میگیرند، افراد ممکن است دچار تنگی نفس شوند. رگهای خونی در چشم نیز میتوانند تحت تأثیر قرار گیرند و منجر به تاری دید یا حتی از دست رفتن بینایی شوند.
اختلالات مربوط به خونریزی و لخته شدن
بیماران مبتلا به نوع خاصی از AML به نام لوسمی حاد پرومیلوسیتیک (acute promyelocytic leukemia یا APL) ممکن است مشکلاتی در خونریزی و لخته شدن خون داشته باشند. آنها ممکن است خونریزی بینی داشته باشند که متوقف نمیشود یا بریدگی که خونریزی آن بند نمیآید. آنها همچنین ممکن است دچار تورمی ناشی از یک لخته خون به نام ترومبوز ورید عمقی (DVT) یا درد قفسه سینه و تنگی نفس ناشی از لخته خون در ریه (به نام آمبولی ریوی یا PE) نیز شوند.
درد استخوان یا مفصل
برخی از افراد مبتلا به AML درد استخوان یا درد مفاصل ناشی از تجمع سلولهای لوسمی در این نواحی دارند.
تورم در شکم
سلولهای لوسمی ممکن است در کبد و طحال انباشته شده و بزرگتر شوند. این اتفاق ممکن است به صورت پری یا تورم شکم مشاهده شود. دندههای پایینی معمولاً این اندامها را میپوشانند اما وقتی آنها بزرگ میشوند، پزشک میتواند این وضعیت را حس کند.
علائم ناشی از لوسمی گسترش یافته
روی پوست پخش شود
اگر سلولهای لوسمی به پوست سرایت کنند، میتوانند تودهها یا لکههایی را ایجاد کنند که ممکن است شبیه زوائد معمولی باشند. تودهای شبیه تومور از سلولهای AML در زیر پوست یا سایر قسمتهای بدن، کلروما (chloroma)، سارکوم گرانولوسیتی (granulocytic sarcoma) یا سارکوم میلوئیدی (myeloid sarcoma) نامیده میشود. به ندرت، AML ابتدا به صورت کلروما و بدون وجود سلولهای لوسمی در مغز استخوان ظاهر میشود.
به لثهها گسترش یابد
انواع خاصی از AML ممکن است به لثهها سرایت کند و باعث تورم، درد و خونریزی شود.
به سایر اندامها منتقل شود
در موارد غیر رایج، سلولهای لوسمی میتوانند به اندامهای دیگر گسترش یابند. انتشار به مغز و نخاع میتواند علائمی مانند:
- سردرد
- ضعف
- تشنج
- استفراغ
- مشکل در تعادل
- بی حسی صورت
- تاری دید
در موارد نادر AML میتواند به چشمها، بیضهها، کلیهها یا سایر اندامها نیز سرایت کند.
بزرگ شدن غدد لنفاوی
به ندرت، AML میتواند به غدد لنفاوی (مجموعههای سلولهای ایمنی به اندازه لوبیا در سراسر بدن) گسترش یابد و آنها را بزرگتر کند. گرههای آسیب دیده در گردن، کشاله ران، نواحی زیر بغل یا بالای استخوان ترقوه ممکن است به صورت تودههایی در زیر پوست احساس شوند.
اگرچه هر یک از علائم و نشانههای بالا ممکن است ناشی از AML باشد اما آنها میتواند ناشی از وجود عوامل دیگری نیز باشد. با این حال، اگر هر یک از این مشکلات را دارید، به خصوص اگر از بین نرفتند یا در حال بدتر شدن هستند، مهم است که به پزشک مراجعه کنید تا بتوان علت را پیدا و در صورت نیاز آن را درمان کرد.
چه چیزی باعث لوسمی میلوئید حاد (AML) میشود؟
برخی از افراد مبتلا به لوسمی میلوئید حاد (AML) دارای یک یا چند عامل خطرزا شناخته شده هستند اما بسیاری از آنها چنین عواملی را ندارند. حتی زمانی که فردی دارای یک یا چند عامل خطرزا باشد، تشخیص اینکه آیا واقعاً این عوامل باعث بروز سرطان شده است یا خیر، بسیار سخت است.
تغییرات خاصی در DNA سلولهای طبیعی مغز استخوان میتواند باعث تبدیل آنها به سلولهای سرطان خون شود. DNA درون سلولهای ما ژنهای ما را میسازد که عملکرد سلولهای ما را کنترل میکنند. ما تمایل داریم شبیه والدین خود باشیم زیرا آن ها منبع DNA ما هستند. اما ژنهای ما بر چیزی بیشتر از ظاهر ما تأثیر میگذارند.
برخی از ژنها زمان رشد سلولهای ما، تقسیم برای ساختن سلولهای جدید و مرگ در زمان مناسب را کنترل میکنند:
- ژنهایی که به رشد، تقسیم یا زنده ماندن سلولها کمک میکنند، انکوژن (oncogenes) نامیده میشوند.
- ژنهایی که به کنترل تقسیم سلولی کمک میکنند یا باعث مرگ سلولها در زمان مناسب میشوند، ژنهای سرکوب کننده تومور (tumor suppressor genes) نامیده میشوند.
DNA داخل هر سلول به صورت رشتههای طولانی به نام کروموزوم است. هر بار که یک سلول به 2 سلول جدید تقسیم میشود، باید یک کپی جدید از کروموزومهای خود بسازد. این فرآیند کامل نیست و ممکن است خطاهایی در آن رخ دهد که بر ژنهای درون کروموزومها تأثیر بگذارد.
سرطانها (از جمله AML) میتوانند در اثر جهش (تغییرات) ایجاد شوند که انکوژنها را فعال کرده یا ژنهای سرکوب کننده تومور را خاموش میکنند. به عنوان مثال، تغییرات در ژنهای خاصی مانند FLT3، c-KIT و RAS در سلولهای AML رایج است. این نوع تغییرات میتوانند سلولهای مغز استخوان را از بالغ شدنی که به طور معمول رخ میدهد، دور کنند یا به رشد خارج از کنترل سلولها کمک کنند.
جهش در بسیاری از ژنهای مختلف را میتوان در AML یافت اما تغییرات بزرگتر در یک یا چند کروموزوم نیز رایج است. اگرچه این تغییرات شامل قطعات بزرگتری از DNA است اما اثرات آنها احتمالاً به دلیل وجود تغییراتی فقط در یک یا چند ژن است که در آن قسمت از کروموزوم وجود دارد. چندین نوع تغییر کروموزوم ممکن است در سلولهای AML یافت شود:
- جابجاییها (Translocations) رایج ترین نوع تغییر کروموزومی هستند. جابجایی به این معنی است که بخشی از یک کروموزوم جدا شده و به کروموزوم دیگری متصل میشود. نقطهای که در آن شکستگی رخ میدهد میتواند بر ژنهای مجاور تأثیر بگذارد – برای مثال، میتواند انکوژنها را روشن کند یا ژنهایی مانند RUNX1 و RARa را که معمولاً به بلوغ سلولهای خونی کمک میکنند، خاموش کند.
- حذف (Deletions) زمانی رخ میدهد که بخشی از کروموزوم از بین برود. این پدیده میتواند منجر به از دست رفتن ژنی شود که به کنترل رشد سلول کمک میکند (ژن سرکوب کننده تومور).
- وارونگی (Inversions) زمانی اتفاق میافتد که بخشی از کروموزوم بچرخد، بنابراین در این حالت، ترتیب توالی معکوس میشود. این پدیده میتواند منجر به از دست دادن یک ژن (یا ژنها) شود زیرا سلول دیگر نمیتواند دستور العملهای آن را بخواند (مثل تلاش برای خواندن یک کتاب از آخر به اول).
- اضافه شدن (Addition) یا همانند سازی (duplication) به این معنی است که یک کروموزوم یا بخشی از یک کروموزوم به شکل اضافی وجود دارد. این پدیده میتواند منجر به ایجاد کپیهای بیش از حد از ژنهای خاصی در سلول شود. اگر یک یا چند مورد از این ژنها انکوژن باشند، این اتفاق میتواند مشکل ساز باشد.
انواع مختلفی از AML وجود دارد و موارد مختلف AML میتوانند تغییرات ژنی و کروموزومی متفاوتی داشته باشد که برخی از آنها شایع تر از سایرین هستند. پزشکان در تلاش هستند تا دریابند که چرا این تغییرات رخ میدهد و چگونه هر یک از آنها ممکن است منجر به ایجاد سرطان خون شود. به عنوان مثال، برخی از آنها در نوعی از لوسمی که پس از شیمی درمانی برای سرطان دیگری رخ میدهد، شایع تر هستند.
به نظر میرسد برخی تغییرات بیشتر از سایرین بر وضعیت آتی (چشم انداز) فرد تأثیر میگذارند. برای مثال، برخی تغییرات ممکن است بر سرعت رشد سلولهای لوسمی یا احتمال پاسخگویی آنها به درمان تأثیر بگذارد.
تغییرات ژنی ارثی در مقابل اکتسابی
برخی از افراد مبتلا به انواع خاصی از سرطان، جهشهای DNA را از والدین به ارث بردهاند که خطر ابتلا به این بیماری را در آنها افزایش میدهد. اگرچه گاهی اوقات ممکن است این اتفاق در AML رخ دهد، مانند سندرمهای ژنتیکی که در عوامل خطرزا برای لوسمی حاد میلوئید (AML) مورد بحث قرار گرفتهاند، جهشهای ارثی علت شایع AML نیستند.
بیشتر تغییرات DNA مربوط به AML در طول زندگی فرد رخ میدهد، نه اینکه قبل از تولد به ارث برده شود. برخی از این تغییرات اکتسابی ممکن است دلایل بیرونی مانند تشعشعات یا مواد شیمیایی سرطانزا داشته باشند اما در بیشتر موارد دلیل وقوع آنها مشخص نیست. بسیاری از این تغییرات ژنی احتمالاً فقط رویدادهای تصادفی هستند که گاهی اوقات در داخل سلول اتفاق میافتند، بدون اینکه علت خارجی داشته باشند. به نظر میرسد که با افزایش سن این تغییرات ژنی بیشتر اتفاق میافتند که ممکن است به توضیح اینکه چرا AML معمولاً در افراد مسن رخ میدهد، کمک کند.
لوسمی حاد میلوئیدی (AML) انواع و عوامل پیش بینی کننده
برای اکثر انواع سرطانها، تعیین مرحله (وسعت) سرطان بسیار مهم است. مرحله بندی بر اساس اندازه تومور اصلی و میزان گسترش سرطان است. این کار میتواند در پیش بینی چشم انداز یک فرد و تصمیم گیری در مورد روند درمان وی مفید باشد.
از سوی دیگر، لوسمی حاد میلوئیدی (AML)، معمولاً تومور ایجاد نمیکند. این نوع سرطان به طور کلی در سراسر مغز استخوان شایع است و در برخی موارد به سایر اندامها مانند کبد و طحال نیز گسترش یافته است. بنابراین AML مانند اکثر سرطانهای دیگر مرحله بندی نمیشود. چشم انداز فرد مبتلا به AML در عوض به اطلاعات دیگری مانند نوع فرعی AML (تعیین شده توسط آزمایشات آزمایشگاهی)، سن بیمار و سایر نتایج آزمایشات آزمایشگاهی بستگی دارد.
دانستن نوع فرعی AML میتواند بسیار مهم باشد زیرا گاهی اوقات هم بر دیدگاه بیمار و هم بر انتخاب بهترین درمان تأثیر میگذارد. برای مثال، زیرگروه لوسمی پرومیلوسیتیک حاد (APL) اغلب با استفاده از داروهایی درمان میشود که با داروهایی که برای سایر زیرگروههای AML استفاده میشوند، متفاوت هستند. اگر مطمئن نیستید که کدام زیرگروه AML را دارید، از پزشک خود در مورد این مسئله و اینکه چگونه ممکن است بر درمان شما تأثیر بگذارد سؤال کنید.
دو سیستم اصلی که برای طبقه بندی AML به زیر گروهها استفاده شدهاند، طبقهبندی فرانسوی-آمریکایی-بریتانیایی (FAB) و طبقه بندی جدیدتر سازمان بهداشت جهانی (WHO) هستند.
طبقه بندی فرانسوی-آمریکایی-بریتانیایی (FAB) AML
در دهه 1970، گروهی از متخصصان لوسمی فرانسوی، آمریکایی و انگلیسی، AML را بر اساس نوع سلولی که سرطان خون از آن ایجاد میشود و میزان بالغ بودن سلولها، به زیرگروههای M0 تا M7 تقسیم کردند. این روش تا حد زیادی بر اساس قیافه سلولهای لوسمی پس از رنگ آمیزی معمولی در زیر میکروسکوپ بود.
زیر گروههای M0 تا M5 همگی در اشکال نابالغ گلبولهای سفید شروع میشوند. M6 AML در اشکال بسیار نابالغ گلبولهای قرمز شروع میشود، در حالی که M7 AML در اشکال نابالغ سلولهایی که پلاکتها را میسازند، شروع میشود.
طبقه بندی AML سازمان جهانی بهداشت (WHO)
سیستم طبقه بندی FAB میتواند مفید باشد اما بسیاری از عواملی را که امروزه بر وضعیت پیش روی بیمار (چشمانداز) تأثیر میگذارند، در نظر نمیگیرد. سیستم سازمان جهانی بهداشت (WHO) که اخیراً در سال 2016 به روز شده است، شامل برخی از این عوامل موثر بر طبقه بندی بهتر AML میشود.
سیستم WHO AML را به چند گروه تقسیم میکند:
AML با ناهنجاریهای ژنتیکی خاص (تغییرات ژنی یا کروموزومی)
- AML با جابجایی بین کروموزومهای 8 و 21 [(8;21)t]
- AML با جابجایی یا وارونگی در کروموزوم 16 [(16;16) tیا (16)inv]
- APL با ژن فیوژن PML-RARA
- AML با جابجایی بین کروموزومهای 9 و 11 [(9;11)t]
- AML با جابهجایی بین کروموزومهای 6 و 9 [t(6:9)]
- AML با جابجایی یا وارونگی در کروموزوم 3 [(3;3) tیا inv(3)]
- AML (مگاکاریوبلاستیک یا megakaryoblastic) با جابهجایی بین کروموزومهای 1 و 22 [t(1:22)]
- AML با ژن همجوشی BCR-ABL1 (BCR-ABL)*
- AML با ژن NPM1 جهش یافته
- AML با جهش دو آللی ژن CEBPA (یعنی جهش در هر دو نسخه از ژن)
- AML با ژن RUNX1 جهش یافته*
*این نوع هنوز یک “نوع موقت” است، به این معنی که هنوز مشخص نیست که آیا شواهد کافی مبنی بر اینکه این نوع یک گروه منحصر به فرد است وجود دارد یا خیر.
AML مربوط به شیمی درمانی یا پرتو درمانی قبلی
AML هایی که به طور دیگری مشخص نشدهاند (اینها شامل مواردی از AML میشوند که در یکی از گروههای بالا قرار نمیگیرند و مشابه طبقه بندی FAB هستند.)
- AML با حداقل تمایز (FAB M0)
- AML بدون بلوغ (FAB M1)
- AML با بلوغ (FAB M2)
- لوسمی میلومونوسیتی (myelomonocytic) حاد (FAB M4)
- لوسمی حاد مونوبلاستیک یا مونوسیتیک (monoblastic/monocytic) (FAB M5)
- لوسمی اریتروئید (erythroid) خالص (FAB M6)
- لوسمی مگاکاریوبلاستیک (megakaryoblastic) حاد (FAB M7)
- لوسمی بازوفیلیک (basophilic) حاد
- پانمیلوز (panmyelosis) حاد همراه با فیبروز
سارکوم میلوئید (Myeloid sarcoma) (همچنین به عنوان سارکوم گرانولوسیتی یا کلروما (chloroma) نیز شناخته میشود)
Myeloid proliferations مرتبط با سندرم داون
لوسمیهای حاد تمایز نیافته و دو فنوتیپی کاملاً AML نیستند، بلکه لوسمیهایی هستند که هم ویژگیهای لنفوسیتی و هم میلوئیدی دارند. گاهی اوقات به آنها لوسمیهای حاد فنوتیپ مختلط (mixed phenotype acute leukemias یا MPAL) گفته میشود.
عوامل پیش بینی کننده AML
نوع فرعی AML میتواند در کمک به تعیین وضعیت پیش روی (چشم انداز) فرد مهم باشد. اما عوامل دیگری نیز میتوانند بر این موضوع تأثیر بگذارند که چرا برخی از بیماران مبتلا به AML چشم انداز بهتری نسبت به دیگران دارند. به اینها عوامل پیش بینی کننده (prognostic factors) میگویند. فاکتورهای پیش بینی کننده به پزشکان کمک میکنند تا خطر و احتمال عود کردن لوسمی را در افراد پس از درمان تعیین کنند و بنابراین مشخص شود که آیا باید تحت درمان کم و بیش فشردهتری قرار گیرند یا خیر. برخی از این موارد عبارتند از:
ناهنجاریهای کروموزومی (سیتوژنتیک یا cytogenetic)
سلولهای AML میتوانند انواع مختلفی از تغییرات کروموزومی را داشته باشند که برخی از آنها میتوانند بر وضعیت فرد در آینده تأثیر بگذارند. موارد ذکر شده در زیر برخی از رایج ترین آنها هستند اما بسیاری دیگر نیز وجود دارند. همه لوسمیها این ناهنجاریها را ندارند. بیمارانی که AML آنها هیچ یک از این موارد را ندارند، معمولاً آیندهای بین دو حالت مطلوب و نامطلوب دارند.
ناهنجاریهای مطلوب:
- جابجایی بین کروموزومهای 8 و 21 (بیشتر در بیماران مبتلا به M2 دیده میشود)
- جابجایی یا وارونگی کروموزوم 16
- جابجایی بین کروموزومهای 15 و 17 (بیشتر در بیماران مبتلا به M3 دیده میشود)
ناهنجاریهای نامطلوب:
- حذف (از دست دادن) بخشی از کروموزوم 5 یا 7
- جابجایی یا وارونگی کروموزوم 3
- جابجایی بین کروموزومهای 6 و 9
- جابجایی بین کروموزومهای 9 و 22
- ناهنجاریهای کروموزوم 11 (در نقطه q23)
- از دست دادن یک کروموزوم، بنابراین سلول تنها 1 کپی به جای 2 کپی طبیعی دارد (معروف به مونوزومی یا monosomy)
- تغییرات پیچیده (آنهایی که شامل 3 کروموزوم یا بیشتر هستند)
جهشهای ژنی
افرادی که سلولهای لوسمی آنها دارای جهشهای ژنی خاصی هستند ممکن است آینده بهتر یا بدتری داشته باشند.
برای مثال، افراد مبتلا به AML که دارای جهش در ژن FLT3 هستند، چشم انداز ضعیفتری دارند، اگرچه داروهای جدیدی که سلولهای دارای این ژن غیرطبیعی را هدف قرار میدهند ممکن است به نتایج بهتری منجر شوند. جهش در ژنهای TP53، RUNX1 و ASXL1 نیز با چشم انداز بدتری مرتبط است.
از سوی دیگر، به نظر میرسد افرادی که سلولهای سرطانی خون آنها تغییراتی در ژن NPM1 دارند (و هیچ ناهنجاری دیگری ندارند) آینده بهتری نسبت به افراد بدون این تغییر دارند. تغییرات در هر دو نسخه از ژن CEBPA نیز با داشتن نتیجه بهتر مرتبط است.
نشانگرهای روی سلولهای سرطانی خون
اگر سلولهای لوسمی پروتئین CD34 و یا P-گلیکوپروتئین (محصول ژن MDR1) را روی سطح خود داشته باشند، با چشم انداز بدتری مرتبط هستند.
سن
به طور کلی، افراد بالای 60 سال به خوبی افراد جوان تر عمل نمیکنند. برخی از این موارد ممکن است به این دلیل باشد که این افراد به احتمال زیاد ناهنجاریهای کروموزومی نامطلوب دارند. آنها گاهی اوقات وضعیت پزشکی دیگری نیز دارند که میتواند انجام روندهای شیمی درمانی شدیدتر را برایشان سخت کند.
تعداد گلبولهای سفید
تعداد بالای گلبولهای سفید خون (> 100000 در هر میلی متر مکعب) در زمان تشخیص با چشم انداز بدتری مرتبط است.
اختلالات خونی قبلی که منجر به AML میشوند
داشتن یک اختلال خونی قبلی مانند سندرم میلودیسپلاستیک (myelodysplastic syndrome) با چشم انداز بدتری مرتبط است.
AML مرتبط با روند درمان
اگر AML پس از درمان سرطان دیگری ایجاد شود، با چشم انداز بدتری مرتبط است.
عفونت
داشتن یک عفونت سیستمیک (خونی) در هنگام تشخیص با چشم انداز بدتری مرتبط است.
وجود سلولهای لوسمی در سیستم عصبی مرکزی
سرطان خونی که به ناحیه اطراف مغز و نخاع گسترش یافته است میتواند به سختی درمان شود زیرا اکثر داروهای شیمی درمانی نمیتوانند به آن ناحیه برسند.
وضعیت AML پس از درمان
اینکه لوسمی چقدر خوب (و با چه سرعتی) به درمان پاسخ میدهد نیز بر چشم انداز طولانی مدت تأثیر میگذارد. پاسخهای اولیه بهتر با نتایج بلند مدت بهتر مرتبط هستند.
بهبودی (بهبود کامل) معمولاً به این صورت تعریف میشود که پس از درمان هیچ اثری از بیماری (NED) وجود نداشته باشد. این بدان معناست که مغز استخوان حاوی کمتر از 5 درصد سلولهای بلاست است، تعداد سلولهای خونی در محدوده طبیعی است و هیچ علامت یا نشانهای از لوسمی وجود ندارد.
بهبود کامل مولکولی به این معنی است که هیچ اثری از سلولهای سرطانی خون در مغز استخوان وجود ندارد؛ حتی در صورت استفاده از آزمایشهای بسیار حساس، مانند PCR (واکنش زنجیرهای پلیمراز).
حداقل بیماری باقی مانده (MRD) اصطلاحی است که پس از درمان زمانی که سلولهای سرطانی خون را نمیتوان در مغز استخوان با استفاده از آزمایشهای استاندارد (مانند مشاهده سلولها در زیر میکروسکوپ) یافت اما آزمایشهای حساستر (مانند فلوسیتومتری یا PCR) نشان میدهند که هنوز سلولهای سرطانی خون در مغز استخوان وجود دارند.
بیماری فعال (Active disease) به این معنی است که یا شواهدی وجود دارد که نشان میدهد لوسمی هنوز در طول درمان وجود دارد یا اینکه بیماری پس از درمان عود کرده است (relapsed). برای اینکه یک بیماری عود کرده باشد، باید بیش از 5 درصد سلولهای بلاست در مغز استخوان وجود داشته باشد.
عوامل خطرزا برای لوسمی میلوئیدی حاد (AML)
یک عامل خطرزا چیزی است که بر شانس ابتلا به بیماری مانند سرطان تأثیر میگذارد. سرطانهای مختلف عوامل خطرزای متفاوتی دارند. برخی از عوامل خطرزا مانند سیگار کشیدن را میتوان تغییر داد. سایر موارد، مانند سن یا سابقه خانوادگی فرد، قابل تغییر نیستند.
اما داشتن یک عامل خطر آفرین یا حتی چندین عدد از این عوامل، همیشه به این معنا نیست که فرد به این بیماری مبتلا میشود. همچنین بسیاری از افراد بدون داشتن هیچ عامل خطر شناخته شده ای به سرطان مبتلا میشوند.
برخی از عوامل خطرزا شناخته شده برای لوسمی میلوئید حاد (AML) وجود دارد.
پیر شدن
AML میتواند در هر سنی رخ دهد اما با افزایش سن افراد شایع تر میشود.
مرد بودن
AML در مردان شایع تر از زنان است. دلیل این امر مشخص نیست.
سیگار کشیدن
تنها عامل خطر مرتبط با سبک زندگی ثابت شده برای AML سیگار کشیدن است. بسیاری از مردم میدانند که سیگار با سرطانهای ریه، دهان و گلو مرتبط است اما تعداد کمی از مردم میدانند که میتواند بر سلولهایی که در تماس مستقیم با دود تنباکو نیستند نیز تأثیر بگذارد. مواد سرطانزای موجود در دود تنباکو توسط ریهها جذب میشوند و از طریق جریان خون به بسیاری از قسمتهای بدن پخش میشوند.
قرار گرفتن در معرض مواد شیمیایی خاص
اگر در معرض مواد شیمیایی خاصی قرار گرفته باشید، خطر ابتلا به AML افزایش مییابد.
به عنوان مثال، قرار گرفتن طولانی مدت در معرض بنزن (benzene) یک عامل خطرزا برای AML است. بنزن حلالی است که در صنایع لاستیک سازی، پالایشگاههای نفت، کارخانههای شیمیایی، تولید کفش و صنایع مرتبط با بنزین استفاده میشود و همچنین در دود سیگار، بنزین و اگزوز وسایل نقلیه موتوری و برخی چسبها، محصولات پاک کننده، شویندهها، لوازم هنری و رنگ یافت میشود.
برخی از مطالعات خطر ابتلا به AML را با قرار گرفتن در معرض فرمالدئید شدید در محل کار مرتبط میدانند اما این ارتباط در برخی از مطالعات دیگر دیده نشده است.
تحت درمان قرار گرفتن با داروهای شیمی درمانی خاص
بیماران مبتلا به سرطان که با داروهای شیمی درمانی خاص درمان میشوند، در سالهای بعد از درمان احتمال بیشتری برای ابتلا به AML دارند.
داروهایی به نام عوامل آلکیله کننده با افزایش خطر ابتلا به AML مرتبط هستند. اغلب یک بیمار قبل از AML به بیماری به نام سندرم میلودیسپلاستیک (myelodysplastic) مبتلا میشود.
نمونههایی از داروهای آلکیله کننده عبارتند از: سیکلوفسفامید (cyclophosphamide)، مکلورتامین (mechlorethamine)، پروکاربازین (procarbazine)، کلرامبوسیل (chlorambucil)، ملفالان (melphalan)، بوسولفان (busulfan)، کارموستین (carmustine)، سیس پلاتین (cisplatin) و کربوپلاتین (carboplatin).
داروهای شیمیایی معروف به مهارکنندههای توپوایزومراز II نیز با AML مرتبط هستند. AML مرتبط با این داروها معمولاً بدون ایجاد سندرم میلودیسپلاستیک در ابتدا رخ میدهد. نمونههایی از مهارکنندههای توپوایزومراز II شامل اتوپوزید (etoposide)، تنیپوزید (teniposide)، میتوکسانترون (mitoxantrone)، اپی روبیسین (epirubicin) و دوکسوروبیسین (doxorubicin) است.
قرار گرفتن در معرض تشعشعات
قرار گرفتن در معرض پرتوهای با دوز بالا (مانند بازماندگان انفجار بمب اتمی یا حادثه راکتور هستهای) خطر ابتلا به AML را افزایش میدهد. خطر ابتلا به لوسمی حاد در بازماندگان بمب اتمی ژاپن بسیار زیاد بود.
پرتو درمانی برای سرطان نیز با افزایش خطر ابتلا به AML مرتبط است. این خطر بر اساس میزان تشعشع داده شده و ناحیه تحت درمان متفاوت است.
خطرات احتمالی سرطان خون ناشی از قرار گرفتن در معرض سطوح پایین تابش، مانند آزمایشهای تصویر برداری مانند اشعه ایکس یا سی تی اسکن، به خوبی تعریف نشده است. قرار گرفتن در معرض چنین تشعشعی، به ویژه در اوایل زندگی، ممکن است خطر ابتلا به سرطان خون را افزایش دهد اما میزان خطر آن مشخص نیست.
اگر میزان خطر افزایش یافته باشد، احتمالاً این افزایش مقداری کوچک است اما برای ایمن بودن، بیشتر پزشکان سعی میکنند تا حد امکان قرار گرفتن در معرض تشعشع را در آزمایشها، به ویژه برای کودکان و زنان باردار، محدود کنند.
داشتن برخی اختلالات خونی
به نظر میرسد افراد مبتلا به برخی اختلالات خونی در معرض خطر ابتلا به AML هستند. این اختلالات شامل اختلالات میلوپرولیفراتیو مزمن (chronic myeloproliferative disorders) مانند پلی سیتمی ورا (polycythemia vera)، ترومبوسیتمی ضروری (essential thrombocythemia) و میلوفیبروز ایدیوپاتیک (idiopathic myelofibrosis) است. اگر این اختلالات با برخی از انواع شیمی درمانی یا پرتو درمانی درمان شوند، خطر ابتلا به AML افزایش مییابد.
برخی از افراد مبتلا به سندرم میلودیسپلاستیک (MDS) ممکن است به AML مبتلا شوند. بیماران مبتلا به MDS تعداد سلولهای خونی پایینی داشته و سلولهای غیر طبیعی در خون و مغز استخوان خود دارا هستند. MDS میتواند در طول زمان به AML تبدیل شود. AML که پس از MDS ایجاد میشود، اغلب روند درمان سختی دارد.
داشتن سندرم ژنتیکی
به نظر میرسد برخی از سندرمهایی که در اثر جهشهای ژنتیکی (تغییرات غیر طبیعی) در بدو تولد ایجاد میشوند، خطر ابتلا به AML را افزایش میدهند. این سندرومها شامل:
- کم خونی فانکونی (Fanconi anemia)
- سندرم بلوم (Bloom syndrome)
- آتاکسی تلانژکتازی (Ataxia-telangiectasia)
- کم خونی Diamond-Blackfan
- سندرم شواچمن-دیاموند (Shwachman-Diamond syndrome)
- سندرم Li-Fraumeni
- نوروفیبروماتوز نوع 1 (Neurofibromatosis type 1)
- نوتروپنی مادرزادی شدید (همچنین به نام سندرم کاستمن یا Kostmann syndrome)
کروموزومها رشتههای طولانی DNA (ژنها) در داخل سلولهای ما هستند. برخی از اختلالات کروموزومی موجود در بدو تولد نیز با خطر بالاتری از ابتلا به AML مرتبط هستند، از جمله:
- سندرم داون (Down syndrome یا متولد شدن با یک نسخه اضافی از کروموزوم 21)
- تریزومی 8 (Trisomy 8 یا متولد شدن با یک نسخه اضافی از کروموزوم 8)
داشتن سابقه خانوادگی
اگرچه تصور نمیشود که اکثر موارد AML پیوند ژنتیکی قوی داشته باشند اما داشتن یکی از بستگان نزدیک (مانند والدین، برادر یا خواهر) مبتلا به AML خطر ابتلا به این بیماری را در فرد افزایش میدهد.
افرادی که دو قلوهای همسانی دارند که قبل از یک سالگی به AML مبتلا شده اند، در معرض خطر بسیار بالایی برای ابتلا به AML هستند.
عوامل خطرزا نامشخص، اثبات نشده یا بحث برانگیز
عوامل دیگری که برای ارتباط احتمالی با AML مورد مطالعه قرار گرفته اند عبارتند از:
- قرار گرفتن در معرض میدانهای الکترومغناطیسی (مانند زندگی در نزدیکی خطوط برق)
- قرار گرفتن در محل کار با گازوئیل، بنزین و برخی مواد شیمیایی و حلالهای دیگر
- قرار گرفتن در معرض علف کشها یا آفت کشها
تاکنون هیچ یک از این عوامل به طور قطعی با AML مرتبط نبوده است. تحقیقات در این زمینهها در حال انجام است.
آیا لوسمی میلوئید حاد (AML) قابل پیشگیری است؟
مشخص نیست که چه چیزی باعث بروز بیشتر موارد لوسمی میلوئید حاد (AML) میشود. از آن جایی که اکثر افراد مبتلا به AML دارای عوامل خطرزا قابل تغییر نیستند، در حال حاضر هیچ روش شناخته شده ای برای پیشگیری از اکثر موارد AML وجود ندارد.
سیگار کشیدن تا حد زیادی مهم ترین عامل خطرزا قابل کنترل برای AML است و ترک آن بیشترین شانس را برای کاهش خطر ابتلا به AML در افراد ارائه میدهد. افرادی که سیگار نمیکشند نیز بسیار کمتر از افرادی که سیگار میکشند در معرض ابتلا به بسیاری از سرطانهای دیگر و همچنین بیماری قلبی، سکته مغزی و برخی بیماریهای دیگر قرار دارند.
درمان برخی سرطانهای دیگر با شیمی درمانی یا پرتو درمانی ممکن است در برخی افراد باعث سرطان خون ثانویه (که در اثر روند درمانی ایجاد میشوند) شود. پزشکان در تلاشند تا چگونگی درمان این سرطانها را بدون افزایش خطر ابتلا به سرطان خون ثانویه بیابند. اما در حال حاضر، مزایای آشکار درمان سرطانهای تهدید کننده زندگی با شیمی درمانی و پرتو درمانی باید در برابر شانس اندک ابتلا به سرطان خون در سالها بعد متعادل شود.
اجتناب از مواد شیمیایی سرطان زا مانند بنزن، ممکن است خطر ابتلا به AML را کاهش دهد. اما اکثر کارشناسان موافقند که قرار گرفتن در معرض مواد شیمیایی محیطی و محیط کار تنها بخش کوچکی از موارد سرطان خون را تشکیل میدهد.
آیا لوسمی حاد میلوئیدی (AML) میتواند زودتر تشخیص داده شود؟
برای بسیاری از انواع سرطان، یافتن زود هنگام سرطان ممکن است درمان آن را آسانتر کند. انجمن سرطان آمریکا آزمایشهای غربالگری را برای تشخیص زودهنگام برخی سرطانها در افرادی که بدون هیچ علامتی هستند، توصیه میکند.
اما در حال حاضر، هیچ آزمایش غربالگری برای یافتن زود هنگام لوسمی میلوئید حاد (AML) مفید واقع نشده است. AML اغلب به سرعت ایجاد میشود (و باعث ایجاد علائم میشود)، بنابراین بهترین راه برای تشخیص زودهنگام AML این است که هر گونه علائم احتمالی AML را فوراً به پزشک گزارش دهید.
افرادی که در معرض خطر ابتلا به AML هستند
برخی از افراد به دلیل داشتن برخی اختلالات خونی (مانند سندرم میلودیسپلاستیک) یا اختلالات ارثی (مانند سندرم داون) یا به دلیل اینکه تحت درمان با داروهای شیمی درمانی خاص یا پرتو درمانی قرار گرفتهاند، در معرض افزایش خطر ابتلا به AML هستند. اکثر پزشکان توصیه میکنند که این افراد معاینات پزشکی دقیق و منظم را انجام دهند. این افراد معمولاً به سرطان خون مبتلا نمیشوند اما آنها و پزشکانشان باید با علائم احتمالی AML آشنا باشند.
آزمایشات لوسمی میلوئید حاد (AML)
برخی از علائم و نشانهها ممکن است نشان دهند که یک فرد ممکن است به لوسمی میلوئید حاد (AML) مبتلا باشد اما آزمایشهایی برای تایید تشخیص مورد نیاز است.
تاریخچه پزشکی و معاینه فیزیکی
پزشک میخواهد یک تاریخچه پزشکی کامل، با تمرکز بر علائم شما و مدت زمانی که آنها را داشتهاید، دریافت کند. او همچنین ممکن است در مورد سایر مشکلات مربوط به سلامتی و همچنین در مورد عوامل خطرزا احتمالی سرطان خون از شما سوال بپرسد.
در طول معاینه فیزیکی، پزشک احتمالاً به چشمها، دهان، پوست، غدد لنفاوی، کبد، طحال و سیستم عصبی شما توجه زیادی میکند و مناطق دارای خونریزی یا کبودی یا علائم احتمالی عفونت را جستجو میکند.
اگر دلیلی وجود داشته باشد که فکر کنید ممکن است مشکلات ناشی از سطوح پایین سلولهای خونی (کم خونی، عفونت، خونریزی یا کبودی و غیره) وجود داشته باشد، پزشک به احتمال زیاد آزمایش خون را برای بررسی تعداد سلولهای خونی شما تجویز میکند. همچنین ممکن است به یک متخصص هماتولوژی ارجاع داده شوید، پزشکی که در بیماریهای خونی (از جمله سرطان خون) تخصص دارد.
انواع نمونههای مورد استفاده برای آزمایش AML
اگر پزشک فکر کند که شما ممکن است سرطان خون داشته باشید، باید نمونههایی از سلولهای خون و مغز استخوان شما را بررسی کند تا از این تشخیص خود مطمئن شود. سایر نمونههای بافتی و سلولی نیز ممکن است برای کمک به درمان از شما گرفته شود.
نمونههای خون
آزمایش خون معمولاً اولین آزمایشی است که برای بررسی سرطان خون انجام میشود. خون از ورید (سیاهرگ) بازو گرفته میشود.
نمونههای مغز استخوان
سرطان خون از مغز استخوان شروع میشود، بنابراین بررسی مغز استخوان برای سلولهای سرطان خون بخش مهمی از آزمایش آن است. نمونههای مغز استخوان از 2 آزمایش که معمولاً همزمان انجام میشوند به دست میآید:
- آسپیراسیون مغز استخوان (Bone marrow aspiration)
- بیوپسی یا نمونه برداری مغز استخوان (Bone marrow biopsy)
نمونهها معمولاً از پشت استخوان لگن (hip) گرفته میشوند اما گاهی اوقات به جای این استخوان از استخوانهای دیگری نیز استفاده میشود. اگر قرار باشد فقط آسپیراسیون انجام شود، ممکن است نمونه از جناغ سینه (استخوان سینه) گرفته شود.
برای آسپیراسیون مغز استخوان، روی یک میز دراز میکشید (به پهلو یا روی شکم). پزشک پوست لگن را تمیز میکند و سپس با تزریق یک بی حس کننده موضعی، ناحیه و سطح استخوان را بی حس میکند. این کار ممکن است باعث سوزش یا إحساس سوختگی مختصری شود. سپس یک سوزن نازک و تو خالی به استخوان وارد میشود و از یک سرنگ برای مکیدن مقدار کمی از مغز استخوان مایع استفاده میشود. حتی با استفاده از داروی بی حسی، اکثر بیماران هنوز در هنگام برداشتن مغز استخوان کمی درد دارند.
بیوپسی مغز استخوان معمولاً درست بعد از آسپیراسیون انجام میشود. یک تکه کوچک از استخوان و مغز آن با یک سوزن کمی بزرگتر که به پایین به داخل استخوان فشار داده میشود، برداشته میشود. این کار ممکن است باعث درد مختصری نیز شود. پس از انجام بیوپسی، برای کمک به جلوگیری از خونریزی، به محل فشار وارد میشود.
این آزمایشهای مغز استخوان برای کمک به تشخیص سرطان خون استفاده میشوند، اما ممکن است بعداً تکرار شوند تا مشخص شود آیا سرطان خون به روند درمانی پاسخ میدهد یا خیر.
مایع نخاعی (Spinal fluid)
مایع مغزی نخاعی (CSF) مغز و نخاع را احاطه کرده است. AML گاهی اوقات میتواند به ناحیه اطراف مغز و نخاع گسترش یابد. برای بررسی این گسترش، پزشکان ممکن است نمونهای از CSF را برای آزمایش بردارند (روشی به نام پونکسیون کمری (lumbar puncture) یا ضربه ستون فقرات (spinal tap)). پونکسیون کمری اغلب برای آزمایش AML استفاده نمیشود، مگر اینکه فرد علائمی داشته باشد که میتواند ناشی از وجود سلولهای سرطانی خون باشد که به مغز و نخاع گسترش یافته اند.
برای این آزمایش، ممکن است به پهلو دراز بکشید یا بنشینید. پزشک ابتدا ناحیه ای از پوست را در قسمت تحتانی پشت روی ستون فقرات بی حس میکند. سپس یک سوزن کوچک و تو خالی بین استخوانهای ستون فقرات در ناحیه اطراف نخاع وارد میشود تا مقداری از مایع خارج شود.
همچنین گاهی اوقات از پونکسیون کمری برای رساندن داروهای شیمی درمانی به CSF برای کمک به پیشگیری یا درمان گسترش لوسمی به نخاع و مغز استفاده میشود.
تستهای آزمایشگاهی برای تشخیص و طبقه بندی AML استفاده میشود
یک یا چند مورد از آزمایشات آزمایشگاهی زیر ممکن است بر روی نمونهها برای تشخیص AML و یا تعیین زیر نوع خاص AML انجام شود.
شمارش کامل خون (Complete blood count) و اسمیر خون محیطی (peripheral blood smear)
شمارش کامل خون (CBC) آزمایشی است که میزان سلولهای مختلف خون مانند گلبولهای قرمز، گلبولهای سفید و پلاکتها را اندازه گیری میکند. CBC اغلب همراه با دیفرانسیل (بازه اختلافی) انجام میشود که به تعداد انواع مختلف گلبولهای سفید خون میپردازد.
برای اسمیر خون محیطی، نمونهای از خون زیر میکروسکوپ بررسی میشود. تغییر در تعداد و ظاهر انواع مختلف سلولهای خونی اغلب به تشخیص سرطان خون کمک میکند.
اکثر بیماران مبتلا به AML تعداد زیادی گلبول سفید نابالغ در خون خود داشته و گلبولهای قرمز یا پلاکت کافی ندارند. بسیاری از گلبولهای سفید خون ممکن است میلوبلاست (اغلب فقط بلاست نامیده میشود) باشند که اشکال بسیار اولیه سلولهای خون ساز هستند و به طور معمول در خون یافت نمیشوند. این سلولها مانند گلبولهای سفید طبیعی و بالغ عمل نمیکنند. این یافتهها ممکن است نشان دهنده سرطان خون باشند اما این بیماری معمولاً بدون بررسی نمونه ای از سلولهای مغز استخوان تشخیص داده نمیشود.
آزمایشات شیمیایی و انعقاد خون (Blood chemistry and coagulation tests)
این آزمایشها میزان برخی مواد شیمیایی موجود در خون و توانایی لخته شدن خون را اندازه گیری میکنند. این آزمایشها برای تشخیص سرطان خون استفاده نمیشوند اما میتوانند به تشخیص مشکلات کبدی یا کلیوی، سطوح غیر طبیعی برخی از مواد معدنی در خون یا مشکلات لخته شدن خون کمک کنند.
آزمایشات معمول سلولی با میکروسکوپ
نمونههای خون، مغز استخوان یا CSF توسط پاتولوژیست (پزشک متخصص در آزمایشهای آزمایشگاهی) زیر میکروسکوپ بررسی میشوند و ممکن است توسط هماتولوژیست یا انکولوژیست بیمار (پزشک متخصص در سرطان و بیماریهای خونی) بررسی شوند.
پزشکان به اندازه، شکل و سایر ویژگیهای گلبولهای سفید در نمونهها نگاه میکنند تا آنها را به انواع خاصی دسته بندی کنند.
یک عنصر کلیدی این است که آیا سلولها بالغ به نظر میرسند (مانند سلولهای خونی طبیعی) یا نابالغ (بدون ویژگیهای سلولهای خونی طبیعی). نابالغ ترین سلولها میلوبلاست (یا بلاست) نامیده میشوند.
درصد بلاستها در مغز استخوان یا خون اهمیت ویژهای دارد. داشتن حداقل 20 درصد بلاست در مغز یا خون به طور کلی برای تشخیص AML لازم است. (در مغز استخوان نرمال، تعداد بلاستها 5 درصد یا کمتر است؛ در حالی که خون معمولاً حاوی هیچ گونه بلاستی نیست.) در نوع خاصی از AML، اگر با استفاده از آزمایش دیگری تشخیص داده شود که بلاستها تغییرات کروموزومی دارند، AML نیز قابل تشخیص است، حتی اگر درصد تجمع این سلولها به 20 درصد نرسد.
گاهی اوقات فقط شمارش و مشاهده کردن سلولها برای ارائه یک تشخیص واضح کافی نیست. سایر آزمایشات آزمایشگاهی ممکن است برای تأیید تشخیص AML استفاده شود.
سیتوشیمی (Cytochemistry)
در آزمایشهای سیتوشیمی، سلولها در معرض مواد شیمیایی (رنگها) قرار میگیرند که تنها با برخی از انواع سلولهای سرطان خون واکنش نشان میدهند. این مواد باعث تغییرات رنگی میشوند که میتوان آن را زیر میکروسکوپ مشاهده کرد و میتواند به پزشک کمک کند تا نوع سلولهای موجود را تعیین کند.
به عنوان مثال، یک نوع رنگ میتواند به تشخیص سلولهای AML از سلولهای لوسمی لنفوسیتی حاد (ALL) کمک کند. این رنگ باعث میشود گرانولهای اکثر سلولهای AML به صورت لکههای سیاه زیر میکروسکوپ ظاهر شوند اما باعث تغییر رنگ سلولهای ALL نمیشود.
فلوسایتومتری (Flow cytometry) و ایمونوهیستوشیمی (immunohistochemistry)
هم برای فلوسیتومتری و هم برای ایمونوسیتوشیمی، نمونههای سلولی در معرض آنتی بادیهایی – پروتئینهایی هستند که فقط به پروتئینهای خاصی روی سلولها میچسبند – قرار میگیرند (تیمار میشوند). در ایمونوسیتوشیمی، سلولها را زیر میکروسکوپ بررسی میکنند تا ببینند آیا آنتی بادیها به آنها چسبیدهاند یا نه (یعنی این پروتئینها را دارند)، در حالی که برای فلوسیتومتری از دستگاه خاصی استفاده میشود.

این آزمایشات در ایمونوفنوتایپ (immunophenotyping) – طبقه بندی سلولهای لوسمی بر اساس مواد (آنتی ژن) روی سطوح آنها – استفاده میشود. سلولهای لوسمی بسته به نوع سلولهایی که از آنها شروع میشوند و اینکه چقدر بالغ هستند، میتوانند آنتی ژنهای مختلفی داشته باشند و این اطلاعات میتواند در طبقه بندی AML مفید باشد.
آزمایشات کروموزومی
این آزمایشها، کروموزومهای (رشتههای بلند DNA) درون سلولها را بررسی میکنند. سلولهای طبیعی انسان حاوی 23 جفت کروموزوم هستند که هر کدام اندازه مشخصی دارند و به روش خاصی رنگ آمیزی میشوند. گاهی اوقات سلولهای AML تغییرات کروموزومی دارند که میتوان آنها را زیر میکروسکوپ دید یا با آزمایشهای دیگر یافت. شناخت این تغییرات میتواند به شناسایی انواع خاصی از AML کمک کرده و همچنین در تعیین چشم انداز بیمار نیز مهم باشد.
سیتوژنتیک (Cytogenetics): در این آزمایش، سلولها زیر میکروسکوپ بررسی میشوند تا بررسی کنند که کروموزومها دارای ناهنجاری هستند یا خیر. اشکال این آزمایش این است که معمولاً 2 تا 3 هفته طول میکشد زیرا سلولها باید چند هفته در ظروف آزمایشگاهی رشد کنند تا کروموزومهای آنها قابل مشاهده باشد.
نتایج آزمایش سیتوژنتیک به صورت مختصر نوشته شده است که تغییرات کروموزوم را توصیف میکند:
- جابجایی (translocation) به این معنی است که قسمتهایی از دو کروموزوم با یکدیگر مبادله شده اند. به عنوان مثال، اگر کروموزومهای 8 و 21 با هم عوض شده باشند، به صورت (8;21)t نوشته میشود.
- وارونگی (inversion) که به عنوان inv(16) نوشته شده است. به عنوان مثال، به این معنی است که بخشی از کروموزوم 16 اکنون به ترتیبی معکوس قرار گرفته است اما همچنان به کروموزوم متصل است.
- حذف (deletion) که به عنوان (7) del یا -7 نوشته میشود. برای مثال، نشان میدهد بخشی از کروموزوم 7 از بین رفته است.
- برای مثال، یک افزودن (addition) یا تکرار (duplication)، مانند 8+، به این معنی است که تمام یا بخشی از کروموزوم 8 تکرار شده است و کپیهای زیادی از آن در داخل سلول یافت میشود.
همه تغییرات کروموزومی را نمیتوان در زیر میکروسکوپ مشاهده کرد.
سایر آزمایشات آزمایشگاهی اغلب میتوانند این تغییرات را تشخیص دهند.
هیبریداسیون در محل فلورسنت (FISH یا Fluorescent in situ hybridization)
این آزمایش با استفاده از رنگهای فلورسنت خاصی که فقط به ژنها یا قسمتهایی از کروموزومهای خاص متصل میشوند، با دقت بیشتری به DNA سلول میپردازد. FISH میتواند تغییرات کروموزومی (مانند جابهجاییها) را که در زیر میکروسکوپ در آزمایشهای سیتوژنتیک استاندارد قابل مشاهده است و همچنین برخی تغییراتی که آنقدر کوچک هستند که با آزمایشهای سیتوژنتیک معمولی قابل مشاهده نیستند را پیدا کند.
از FISH میتوان برای جستجوی تغییرات در ژنهای خاص یا بخشهایی از کروموزومها استفاده کرد. میتوان از آن بر روی نمونههای معمولی خون یا مغز استخوان بدون رشد آنها در آزمایشگاه استفاده کرد. این بدان معناست که نتایج اغلب سریعتر از آزمایشهای سیتوژنتیک معمولی در دسترس هستند.
واکنش زنجیرهای پلیمراز (PCR)
این یک آزمایش بسیار حساس است که میتواند برخی از تغییرات ژنی و کروموزومی بسیار کوچک را تشخیص دهد که در زیر میکروسکوپ دیده نمیشوند. این روش برای یافتن تغییرات ژنی که فقط در چند سلول وجود دارد مفید است که همین امر آن را برای یافتن تعداد کمی از سلولهای سرطانی خون در نمونه (مانند حالتی که فرد تحت درمان قرار گرفته است) مفید است.
سایر آزمایشات مولکولی و ژنتیکی
انواع جدیدتر آزمایشات آزمایشگاهی نیز میتواند بر روی نمونهها انجام شود تا به دنبال ژن خاص یا سایر تغییرات در سلولهای لوسمی باشند.
تستهای تصویر برداری برای AML
تستهای تصویر برداری از اشعه ایکس، امواج صوتی، میدانهای مغناطیسی یا ذرات رادیو اکتیو برای ایجاد تصاویری از داخل بدن استفاده میکنند. لوسمی معمولاً تومورها را تشکیل نمیدهد، بنابراین آزمایشهای تصویر برداری اغلب برای تشخیص این سرطان مفید نیستند.
هنگامی که آزمایشهای تصویر برداری در افراد مبتلا به AML انجام میشود، بیشتر به دنبال عفونت یا سایر مشکلات هستید نه اینکه به دنبال خود سرطان خون باشید. در موارد معدودی، اگر تصور شود که سرطان ممکن است فراتر از مغز استخوان و خون گسترش یافته باشد، ممکن است آزمایشهای تصویر برداری برای کمک به تعیین وسعت بیماری انجام شود.
اشعه ایکس (X-rays)
در صورت مشکوک شدن به عفونت ریه، ممکن است عکس برداری معمول با اشعه ایکس قفسه سینه انجام شود.
توموگرافی کامپیوتری (CT) اسکن (Computed tomography (CT) scan)
سی تی اسکن از اشعه ایکس برای ایجاد تصاویر دقیق و مقطعی از بدن شما استفاده میکند. این آزمایش میتواند نشان دهد که آیا غدد لنفاوی یا اندامهای بدن شما بزرگ شده اند یا خیر. سی تی اسکن معمولاً برای تشخیص AML لازم نیست اما اگر پزشک مشکوک باشد که سرطان خون در اندامی مانند طحال شما در حال رشد است، ممکن است انجام شود.
بیوپسی سوزنی با هدایت CT (CT-guided needle biopsy)
در برخی موارد، میتوان از CT برای هدایت سوزن بیوپسی به سمت یک ناهنجاری مشکوک، مانند آبسه (abscess)، استفاده کرد. برای این روش، در حالی که پزشک سوزن بیوپسی را از طریق پوست و به سمت توده حرکت میدهد، روی میز سی تی اسکن دراز میکشید. سی تی اسکن تا زمانی که سوزن در داخل توده قرار گیرد، تکرار میشود. سپس یک نمونه برداشته شده و به آزمایشگاه فرستاده میشود تا زیر میکروسکوپ بررسی شود.
PET/CT
برخی از دستگاهها سی تی اسکن را با اسکن PET (PET/CT scan) ترکیب میکنند. برای اسکن PET، گلوکز (نوعی قند) حاوی یک اتم رادیواکتیو به خون تزریق میشود. از آن جایی که سلولهای سرطانی در بدن به سرعت رشد میکنند، مقادیر زیادی قند رادیو اکتیو را جذب میکنند. سپس یک دوربین مخصوص میتواند تصویری از مناطق پرتوزا در بدن ایجاد کند. با اسکن PET/CT، پزشک میتواند نواحی با رادیو اکتیویته بالاتر در اسکن PET را با ظاهری دقیقتر آن ناحیه در CT مقایسه کند.
اسکن تصویر برداری رزونانس مغناطیسی (MRI)
مانند سی تی اسکن، اسکن MRI تصاویر دقیقی از بافتهای نرم بدن ایجاد میکند. اما در اسکن MRI به جای اشعه ایکس از امواج رادیویی و آهنرباهای قوی استفاده میشود.
اسکن MRI برای بررسی مغز و نخاع بسیار مفید است اما معمولاً در افراد مبتلا به AML مورد نیاز نیست.
سونوگرافی (Ultrasound)
اولتراسوند از امواج صوتی و پژواک آنها برای تهیه تصاویری از اندامها یا تودههای داخلی استفاده میکند.
سونوگرافی را میتوان برای بررسی غدد لنفاوی نزدیک سطح بدن یا برای بررسی غدد لنفاوی بزرگ یا اندامهایی مانند کبد، طحال و کلیهها در داخل شکم استفاده کرد. (از آن نمیتوان برای نگاه کردن به داخل قفسه سینه استفاده کرد زیرا دندهها امواج صوتی را مسدود میکنند.) گاهی اوقات برای کمک به هدایت سوزن بیوپسی به داخل یک غده لنفاوی بزرگ شده استفاده میشود.
رسیدگیهای درمانی
درمان لوسمی میلوژن حاد به عوامل مختلفی از جمله نوع فرعی بیماری، سن، سلامت کلی و ترجیحات شما بستگی دارد.
به طور کلی، روند درمان به دو مرحله تقسیم میشود:
- درمان القای بهبودی (Remission induction therapy): هدف از مرحله اول روند درمان، از بین بردن سلولهای سرطانی خون در خون و مغز استخوان شما است. با این حال، القای بهبودی معمولاً همه سلولهای سرطان خون را از بین نمیبرد، بنابراین برای جلوگیری از بازگشت بیماری به روند درمان طولانیتری نیاز دارید.
- تحکیم درمانی (Consolidation therapy): این مرحله از درمان که درمان پس از بهبودی (post-remission therapy) یا درمان نگهدارنده (maintenance therapy) نیز نامیده میشود، با هدف از بین بردن سلولهای سرطانی خون باقی مانده است. این مرحله برای کاهش خطر عود مجدد بیماری بسیار مهم در نظر گرفته میشود.
درمانهای مورد استفاده در این مراحل عبارتند از:
- شیمی درمانی (Chemotherapy): شیمی درمانی شکل اصلی درمان القای بهبودی است، اگرچه میتوان از آن برای درمان تحکیم نیز استفاده کرد. شیمی درمانی از مواد شیمیایی برای از بین بردن سلولهای سرطانی در بدن شما استفاده میکند.
افراد مبتلا به AML به طور کلی در طول روند درمانی شیمی درمانی در بیمارستان میمانند زیرا این داروها بسیاری از سلولهای خونی طبیعی را در روند کشتن سلولهای سرطانی خون از بین میبرند.
اگر سیکل اول شیمی درمانی باعث بهبودی نشود، میتوان آن را تکرار کرد.
- درمان هدفمند (Targeted therapy): درمانهای دارویی هدفمند بر روی ناهنجاریهای خاص موجود در سلولهای سرطانی تمرکز دارند. با مسدود کردن این ناهنجاریها، درمانهای دارویی هدفمند میتوانند باعث مرگ سلولهای سرطانی شوند. سلولهای لوسمی شما آزمایش میشوند تا بررسی شود که آیا درمان هدفمند ممکن است برای شما مفید باشد یا خیر. درمان هدفمند را میتوان به تنهایی یا در ترکیب با شیمی درمانی در روند درمانهای القایی و تحکیمی (نگهدارنده) استفاده کرد.
- پیوند مغز استخوان (Bone marrow transplant): پیوند مغز استخوان که پیوند سلولهای بنیادی نیز نامیده میشود، ممکن است برای درمان تحکیمی استفاده شود. پیوند مغز استخوان با جایگزینی مغز استخوان ناسالم با سلولهای بنیادی بدون سرطان خون که مغز استخوان سالم را بازسازی میکنند، به بازسازی سلولهای بنیادی سالم کمک میکند.
قبل از پیوند مغز استخوان، دوزهای بسیار بالایی از شیمی درمانی یا پرتو درمانی دریافت میکنید تا مغز استخوان مولد لوسمی را از بین ببرید. سپس تزریق سلولهای بنیادی را از یک اهدا کننده سازگار با شما (پیوند آلوژنیک یا allogeneic transplant) دریافت میکنید.
همچنین اگر قبلاً در حال بهبودی بوده اید و سلولهای بنیادی سالم خود را برداشته و برای پیوندی آینده ذخیره کرده اید، میتوانید سلولهای بنیادی خود (پیوند اتولوگ یا autologous transplant) را نیز دریافت کنید.
- آزمایشات بالینی (Clinical trials): برخی از افراد مبتلا به لوسمی انتخاب میکنند تا در آزمایشات بالینی ثبت نام کنند تا درمانهای در حال آزمایش یا ترکیبات جدیدی از درمانهای شناخته شده را امتحان کنند.
مطالب مرتبط:
- دوره مهارت آموزی هماتولوژی
- مورفولوژی غیر طبیعی RBC
- اختلالات گلبول قرمز
- لوسمی دوران کودکی (Childhood Leukemia) چیست؟
- لوسمی مزمن میلوئیدی (Chronic Myeloid Leukemia یا CML) چیست؟
- لوسمی لنفوسیتی حاد (ALL یا Acute Lymphocytic Leukemia)
مترجم: فاطمه فریادرس




